如何控制术后炎性肠梗阻的“蝴蝶效应”
——以肠瘘术后为例探讨
张玉亮,龚冠闻,江志伟
作者单位:南京中医药大学附属医院普外科,江苏 南京210000
肠道手术病人术后肠梗阻发生原因复杂,目前大量研究表明肠道的手术创伤及机体炎症反应是导致术后肠梗阻的主要原因[1-4]。术后早期肠梗阻发生率在5%左右[5],其中炎性肠梗阻占90%[6-7],由此可见肠道手术后肠梗阻主要以炎性肠梗阻为主。根据目前的治疗共识[8],尽管术后早期炎性肠梗阻经过对症治疗有效,然而仍然有部分病人治疗过程中存在病情进一步加重的可能,甚至危及其生命。如何避免术后炎性肠梗阻进行性加重,以及怎样规范治疗术后进行性加重炎性肠梗阻,尚需要进一步研究。本研究通过分析1例肠瘘术后进行性加重炎性肠梗阻病人的治疗过程,为该种疾病进一步的规范治疗及病情评估提供参考依据。具体情况报告如下。
1 资料与方法
1.1 一般资料男,77 岁,身高171 cm,体质量55 kg,体质量指数(BMI)18.8 kg/m2,腹壁结肠造口停止排气、排便20 d。病人于2019 年3 月19 日在全麻下行腹腔镜辅助直肠癌腹会阴联合切除术,术后病理诊断为直肠溃疡型管状腺癌,病理分期为T3N0M0。病人术后行6 次化学治疗,其中1 次同步放化疗。2020 年5 月于外院复查发现肝转移,进而行单抗化疗(具体疗程及用药不详),化疗过程顺利,复查磁共振检查(MR)肝内转移灶体积未见明显减小,后改用口服靶向药物治疗。2020 年8 月24 日因腹部疼痛及肛门部肿痛不适,病人于外院就诊,考虑小肠瘘,予冲洗引流保守治疗。因保守治疗效果不佳,遂于2020年9月27日行脓肿冲洗切开引流术+末端回肠部分切除吻合术,术后予以消炎、抗感染、止血等对症治疗。2020 年10 月11 日出现腹胀、无排气排便,腹部手术切口持续渗出淡黄色样液体,予以复查腹部CT 提示:(1)直肠术后,腹壁造瘘术后;骶前软组织肿胀;部分小肠扩张积液,肠壁稍增厚;(2)肝脏多枚低密度灶,考虑部分转移瘤、部分囊肿可能。考虑病人术后继发肠梗阻,遂予抗感染、胃肠减压、营养支持等对症治疗。虽经积极治疗,病情未见好转,反而进一步加重。病人于2020 年11月3日转入南京中医药大学附属医院普外科进一步治疗。病人入院时意识清楚,精神萎靡,腹胀比较明显,偶有腹痛,无发热,近期体质量下降约5 kg。
1.2 治疗方案基础治疗:禁食禁饮,维持水电解质平衡,输入白蛋白维持蛋白在正常范围,根据病情需要连续使用抗生素6 d,同时常规使用生长抑素及抑酸护胃治疗。联合使用激素短期治疗,每日静脉输入一次甲泼尼龙40 mg,连续使用4 d。营养治疗:病人接受中心静脉导管输入全肠外营养支持治疗,每天输注时间持续18~20 h。肠外营养方案为碳水化合物3.2 g·kg−1·d−1,氮量0.2 g·kg−1·d−1,脂肪乳1 g·kg−1·d−1,糖与胰岛素比为5∶1,ω-3 鱼油脂肪乳10 g,谷氨酰胺20 g,并补充维生素、水、电解质和微量元素等。肠道减压治疗:胃镜下将经鼻型小肠梗阻导管插入胃部,通过导管中的导丝引导将导管远端尽可能推送到扩张明显的肠管处,导管尽量推向小肠远端,使用注射器向导管末端前气囊注入约10 mL 生理盐水。在确定导管放置位置后,缓慢拉出管中导丝,留置在鼻腔外面的导管松弛,鼻外缘处导管暂不固定,导管外接负压吸引引流胃肠道的积气、积液。小肠导管可由肠管蠕动慢慢到达梗阻远端,让病人适当活动促进导管推送,告知病人在活动的过程中注意保护导管,避免牵拉脱位。
1.3 观察指标观察记录病人每日导管引流出的液体及气体量、腹胀情况、通气情况、排便情况;采用流式细胞仪测定T淋巴细胞亚群CD3+、CD4+、CD8+细胞、CD4+/CD8+比值;采用酶联免疫吸附测定检测血清炎性因子白介素(IL)-1b、IL-2、IL-6、IL-8、IL-10、肿瘤坏死因子α(TNF-α)水平;记录治疗过程中白细胞、中性粒细胞、淋巴细胞、超敏C 反应蛋白(hs-CRP)、总蛋白、白蛋白、前白蛋白的指标变化;观察治疗过程中腹部CT检查影像学变化。
2 结果
2.1 临床疗效变化病人在入院治疗15 d 后肠道功能明显改善,11月20日造口排气,11月21日恢复少量饮水,11 月28 日拔出小肠梗阻导管,并在拔出小肠梗阻导管的当天恢复肠内营养,11月30日停用肠外营养后恢复半流质饮食,并以肠内营养粉为辅助营养,于12 月3 日恢复正常饮食痊愈出院。根据护理观察记录小肠梗阻导管引流情况,导管置入第1~4天主要以大量气体为主,从第5天开始以引流液为主,到第12 天引流量达到最高值,此后引流量逐渐下降,见图1。
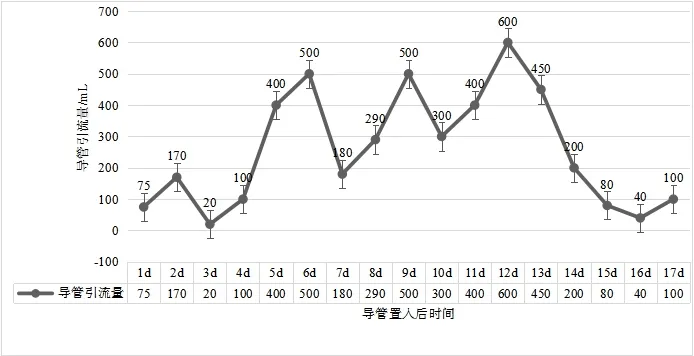
图1 肠瘘术后进行性加重炎性肠梗阻导管置入治疗过程中引流量变化情况
2.2 治疗过程中炎性指标、营养指标变化病人在入院治疗后第3 天,白细胞计数及中性粒细胞计数降低,并逐渐平稳在正常指标范围;白细胞及中性粒细胞计数较治疗前轻微降低,淋巴细胞计数较治疗前增加,见图2。hs-CRP 在治疗过程中阶梯式显著下降,在治疗后第14 天指标恢复正常,见图3。IL-6 的水平较治疗前明显降低,IL-1b、IL-2、IL-8、IL-10、TNF-α 指标水平治疗前后无明显改变;CD3+、CD4+T 淋巴计数较治疗前明显升高,CD8+T 淋巴细胞恢复在正常范围。见表1。治疗后总蛋白、白蛋白逐渐恢复并维持在正常范围,前白蛋白在治疗过程中递进式显著增加,见表2。

表1 肠瘘术后进行性加重炎性肠梗阻治疗过程中细胞因子、免疫指标变化情况/(g/L)
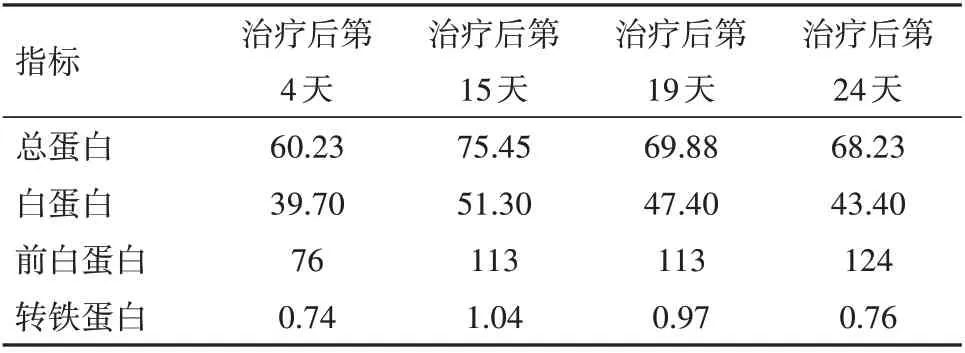
表2 肠瘘术后进行性加重炎性肠梗阻治疗过程中营养指标变化情况/(g/L)
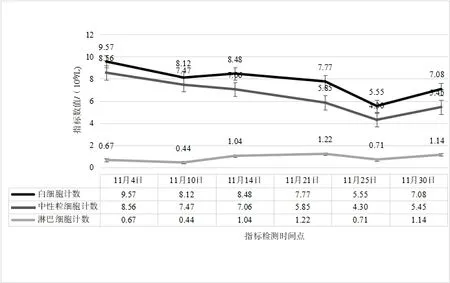
图2 肠瘘术后进行性加重炎性肠梗阻疗程中白细胞、中性粒细胞及淋巴细胞计数变化情况
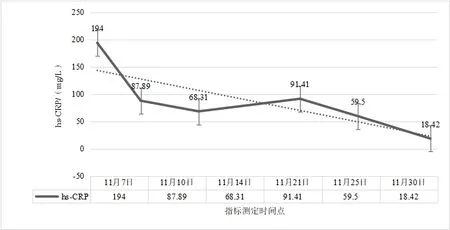
图3 肠瘘术后进行性加重炎性肠梗阻超敏C反应蛋白(hs-CRP)水平在治疗过程中变化情况
2.3 腹部CT 检查图像变化2020 年11 月9 日腹部CT 检查提示直肠癌术后改变,中下腹壁皮下积气、积液,考虑感染可能,腹部肠管扩张伴气液平、盆腔积液,考虑肠梗阻;11月18日复查CT检查提示直肠癌术后改变,较2020 年11 月9 日片相仿,肠梗阻较前有所好转,盆腔积液较前减少;12月3日腹部CT 检查显示腹部肠管扩张伴气液平较治疗前明显好转,盆腔少量积液。
3 讨论
3.1 术后炎性肠梗阻与损伤、炎症术后炎性炎性肠梗阻多发生在各种腹部手术之后,发生时间多在2 周之内[9],部分病人甚至可能在术后1 月之后发病[10]。术后炎性肠梗阻发病最主要原因与手术直接相关,尤其胃肠道相关手术的损伤是直接诱发因素。首先,手术的损伤是发病的基础,肠壁的损伤势必会直接造成结构的改变,从而引起功能的改变[11]。由于手术所致肠壁黏膜受损、术中附近组织破坏、术中坏死组织残留等因素,从而引起损伤部位的炎症发生、继发腹腔内炎症反应,进一步造成肠壁广泛水肿、炎性渗出而促使炎性肠梗阻发生的可能[12-13]。术后炎性肠梗阻一般是无菌性炎症表现,部分合并腹腔细菌感染,如果治疗方案精准,大部分术后炎性肠梗阻经过保守对症治疗可痊愈。为什么部分手术后病人会发生炎性肠梗阻?因为医疗技术水平的差异,总有部分病人术后发生炎性肠梗阻,甚至在治疗过程中病情进一步加重,肠道梗阻广泛扩张加重腹腔压力升高、甚至肠壁坏死穿孔,进而腹腔感染诱发脓毒症,以致危及生命。因此,及时有效的治疗手段是挽救术后炎性肠梗阻病人的关键。控制炎症进一步加重是前提,应根据病人不同炎症反应状况,给予针对性控制炎症反应治疗。本例病人是肠瘘术后所致,本身合并腹腔感染,根据病情的需要,在治疗早期给予抗生素抗感染、甲泼尼龙抗炎,这样有助于快速有效的控制炎症。抗生素在使用6 d 后,根据病人体征及复查结果,予以及时停用,持续长时间使用抗生素对治疗意义不大,反而可能有害。糖皮质激素能快速有效的控制炎症反应[14-15],使用甲泼尼龙明显改善术后炎性肠梗阻病情,但是长时间使用可能会造成免疫抑制、增加吻合口瘘等风险[16]。根据目前相关研究及本例病人治疗特点,甲泼尼松短期使用对促进病人康复是有积极意义的,对于炎性梗阻较重的病人是否能延长使用时间,从而得到更多的益处,则需要进一步临床论证。血清hs-CRP 水平的变化可以反映机体炎症情况;机体活化的单核巨噬细胞能合成和分泌大量炎性因子,这些炎性因子大量的释放进一步加重机体炎症反应,从而加重病人病情[17]。在治疗过程中,病人白细胞及中性粒细胞计数有所降低,并维持在正常范围之内波动。然而,病人血清hs-CRP 及IL-6的水平较治疗前逐渐显著降低,这表明hs-CRP 和IL-6 的指标变化与术后炎性肠梗阻改善有密切相关性,且反映炎症变化敏感性较强。IL-1b、IL-2、IL-8、IL-10、TNF-α 在治疗过程中未见明显改变,虽然有研究表明TNF-α 在儿童术后炎性肠梗阻的治疗过程中有所降低[18]。
3.2 术后炎性肠梗阻与肠腔压力炎性肠梗阻如梗阻未能有效控制,病人肠腔会进一步积气、积液,加重肠腔扩张,肠道扩张水肿以致炎症反应加重,促进肠腔又进一步积液、积气,从而形成恶性循环,肠梗阻病情进一步加重。因此,肠腔压力的大小变化可以直接反映肠道梗阻症状是否得到有效控制,及时地减轻肠腔压力是治疗梗阻的重要措施。本例病人在保守治疗1个月过程中,病情逐渐加重,入院后予以复查CT 检查提示小肠明显扩张,大量积气、积液。根据此前的治疗结果分析,目前简单的胃肠减压治疗对缓解肠腔压力作用微乎其微,予以及时行小肠梗阻导管置入至小肠梗阻肠腔,从而可以快速减轻肠道压力、减轻肠道水肿、降低炎性渗出,进一步减轻病变部位炎症反应[19]。病人在小肠导管置入后前5 d,导管引流主要以气体为主,考虑导管尚未进一步深入所致。随着导管进一步到达梗阻部位,液体引流量明显增加,并且达到峰值。在接下来治疗过程中,随着病情的改善,导管引流量呈波浪形进行性下降。随着肠梗阻导管引流量的持续降低,病人的症状明显改善,治疗过程中复查腹部CT检查提示肠道扩张显著改善。因此,在炎性肠梗阻常规减压治疗而未见好转的情况下,可考虑及时更换肠道减压治疗方式,由于肠腔压力不能及时控制,单纯的抗炎、使用生长抑素减少肠液分泌等常规治疗,并不能控制病人病情,反而病情可能呈现波浪式进行性加重,以致延误病人治疗。虽然有研究表明肠梗阻导管置入对老年胃肠肿瘤病人术后早期炎性肠梗阻治疗效果确切[20],但是肠梗阻导管置入的最佳治疗时机该如何选择,目前尚未有具体标准。如果考虑肠梗阻导管治疗方式优于常规的胃肠减压治疗,那么所有的炎性肠梗阻病人都采取这种治疗方式,可能会给部分病人增加经济负担和治疗不适,因为有部分早期炎性肠梗阻病人常规胃肠减压治疗也可治愈。如何制定肠梗阻导管置入标准、如何选择最佳治疗时机,到达“合理”“及时”的治疗效果,将是今后进一步的研究方向。
3.3 术后炎性肠梗阻与营养营养支持治疗对术后炎性肠梗阻病人治疗尤为重要,机体营养摄入依靠肠内或肠外营养,因病人肠道梗阻,暂不能肠内营养,维持机体营养代谢平衡主要依靠肠外营养。肠外营养不仅能基本维持病人机体营养状况、电解质平衡,而且减轻肠腔负担,可以影响机体消化液的分泌,进一步减轻肠道压力,间接改善肠道扩张,能有效抑制肠壁周围炎症反应,这有利于促进术后炎性肠梗阻病人肠道功能尽快恢复正常状态[21]。肠外营养不仅要满足机体稳定剂能量代谢的需要,而且要充分合理使用减轻炎症反应、保护肠道黏膜的营养制剂,目前常用的减轻炎症反应及保护肠黏膜屏障的药物是鱼油脂肪乳和谷氨酰胺。研究表明鱼油脂肪乳剂可明显降低胃肠肿瘤术后炎症反应、增强免疫,因此在术后炎性肠梗阻病人肠外营养中合理添加鱼油脂肪乳,可能对减轻肠道炎症反应有积极作用。因此在本例病人肠外营养配置中,合理使用了鱼油脂肪乳剂及谷氨酰胺,这样可以起到减轻炎症、增强免疫和保护肠黏膜功能的协同加强作用[22-23]。病人在治疗过程中,白蛋白水平升高并逐渐稳定,血清前白蛋白进行性升高,同时淋巴细胞计数、CD3+、CD4+T 淋巴计数较治疗前明显升高,这表明营养功能改善的同时,机体免疫功能也得到明显改善。免疫功能的增强不仅能增加机体抵抗力,而且还能促进炎症反应的降低,进而可减少机体营养物质分解,体现了营养、免疫及炎症反应三者相互协同作用。
综上所述,根据本例病人治疗过程的疗效分析,表明了在术后炎性肠梗阻治疗过程中,有效的控制炎症反应、合理的营养支持、及时的肠腔减压如同“三驾马车”并驾齐驱,同时又相互影响。这“三驾马车”如果使用不当,那么就很可能控制不了“蝴蝶的翅膀”,进而发生对预后严重不良影响的“蝴蝶效应”,例如术后进行性加重炎性肠梗阻的发生。hs-CRP 和IL-6 的指标变化可考虑作为术后炎性肠梗阻不良“蝴蝶效应”的重要观察指标,从而能够有效的评估病情变化,及时指导更改治疗方案,但需要今后进一步大量的临床病例研究验证。

