二代测序技术检测内蒙古地区晚期肺腺癌病人血浆循环肿瘤DNA中表皮生长因子受体突变状态的应用价值
巴雅力格,孙岩岩,李卉
作者单位:1内蒙古医科大学附属医院干细胞研究中心,内蒙古自治区 呼和浩特010050;
2内蒙古自治区人民医院肿瘤内科,内蒙古自治区 呼和浩特010017
肺癌是我国发病率和病死率最高的恶性肿瘤[1]。而非小细胞肺癌(NSCLC)的发病率约占所有肺癌的85%~90%[2-3],其中腺癌占50%以上。绝大多数NSCLC 病人在确诊时已经为晚期,其标准治疗方式为针对驱动基因的靶向治疗。表皮生长因子受体(EGFR)是目前最重要的肿瘤驱动基因之一,是突变NSCLC 病人表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)治疗中的重要靶点。驱动基因的检测以组织活检为金标准,但在正确反映肿瘤各部位的基因突变情况存在不足。而液体活检技术,以操作简便、非侵入性、重复性高及可以获得较全面的疾病信息等特点,对检测驱动基因、选择治疗方案及监测疗效等方面体现了很高的应用价值。在NSCLC 中应用最为广泛的是循环肿瘤DNA(cir‑culating tumor DNA,ctDNA)液体活检技术,然而ctDNA 在循环中极少,传统的方法检测率低,限制了液体活检在诊疗中的应用。因此本研究采用二代测序技术检测血浆ctDNA,同时用突变阻滞扩增系统PCR(amplification refractory mutation system,ARMS-PCR)方法检测石蜡包埋组织中EGFR 突变状态,比较两种检测样本中EGFR 突变状态的一致性,为临床应用ctDNA 液体活检技术提供理论依据。不同地域环境、不同种族和不同饮食人群中有些基因表达存在差异,本研究立足于在内蒙古地区肺腺癌病人中检测EGFR 表达状态,希望能够获得本地区临床应用中更多的参考依据。
1 资料与方法
1.1 一般资料分析内蒙古自治区人民医院肿瘤内科2016 年11 月至2017 年12 月收治的经病理组织学确诊的50 例晚期肺腺癌病人。男性27 例,女性23 例,中位年龄64 岁。按照第八版临床TNM 分期:Ⅲ期病人9 例,Ⅳ期病人41 例。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 检测方法
1.2.1组织样本采集与处理 组织样本通过支气管镜及经皮肺穿刺活检获得,石蜡包埋组织切片进行DNA 脱蜡及消化,采用石蜡组织DNA 提取试剂盒QIAamp DNA FFPE Tissue Kit 进行样本DNA 提取。后采用人类EGFR 基因突变检测试剂盒进行EGFR基因检测,判定突变状态。
1.2.2 血浆样本采集与处理 使用CF 管采集静脉血10 mL,以1 600 g 离心10 min,取离心管装离心后的上清(血浆)。将上清再次以室温1 600 g 离心10 min 去除残余细胞及细胞碎片,后将上清转入新的离心管中,即得所需的血浆。采用血浆游离DNA 提取试剂盒QIAamp Circulating Nucleic Acid Kit 进行样本DNA 提取,提取的DNA 按照二代测序文库定量试剂盒进行文库构建,再用Hiseq 4000 基因测序仪进行二代测序,最后记录测序数据。
1.3 统计学方法应用SPSS 23.0 软件进行分析。计数资料用χ2检验。组织与血浆样本中EGFR的一致性分析用Kappa检验,以组织检测为金标准,分析二代测序液体活检技术的灵敏度、特异度等。P<0.05为差异有统计学意义。
2 结果
2.1 病人EGFR 突变状态与临床基线特征的相关性组织与血浆样本检测结果一致,组织样本EG‑FR 总突变率为56%(28/50),血浆样本总突变率为68%(34/50)。EGFR 突变与性别、吸烟史、癌胚抗原及细胞角蛋白19 片段(cytokeratin 19 fragments,CY‑FRA-211)有相关性(P<0.05),与年龄、分期、脑转移、骨转移及CA125无相关性(P<0.05)。见表1。
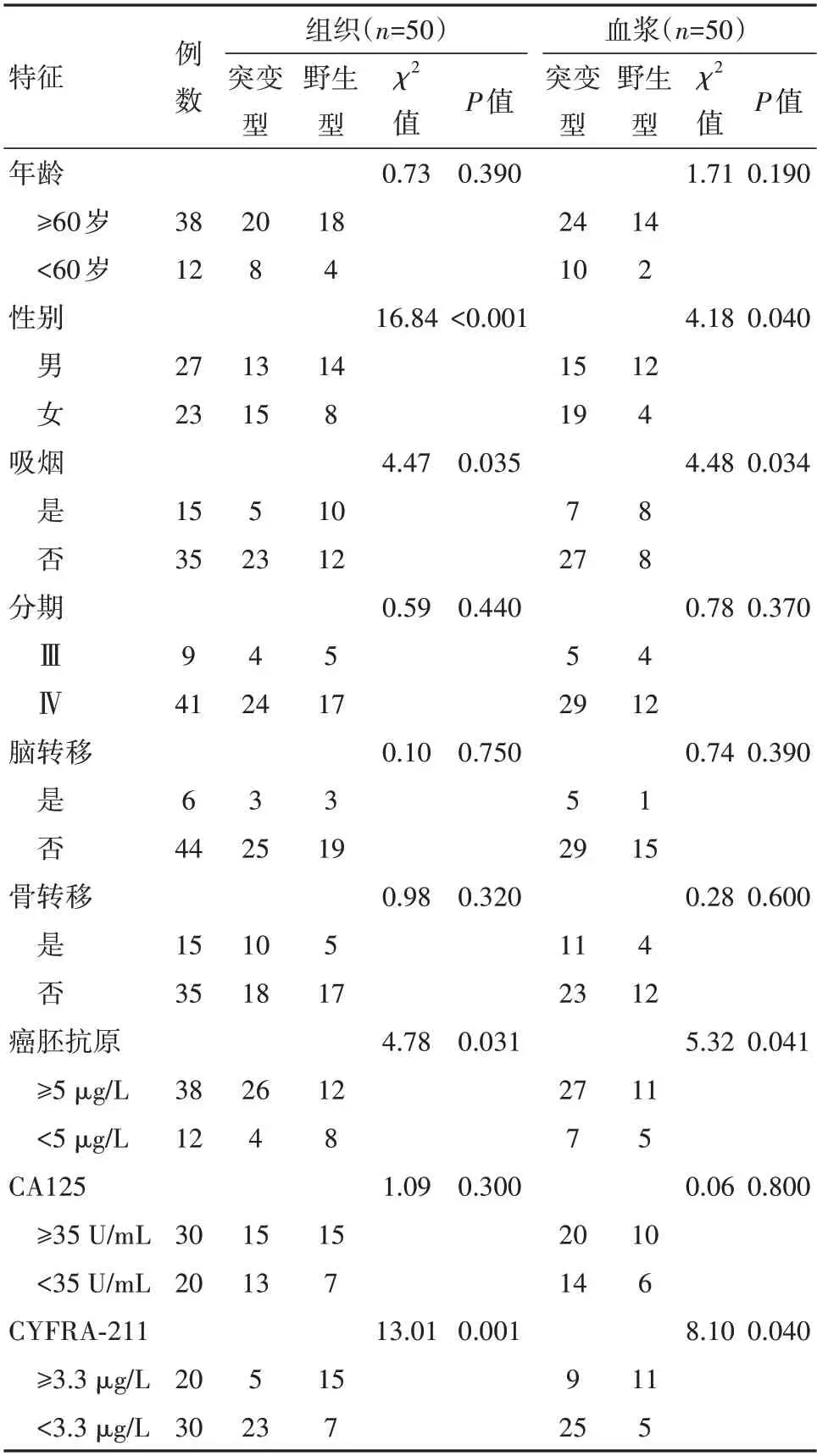
表1 内蒙古地区晚期肺腺癌病人50例基线特征及表皮生长因子受体(EGFR)突变状态/例
2.2 EGFR 突变位点的一致性组织样本双突变占10.7%(3/28),分别为1 例19del+T790M,2 例G719X+S768I。血浆样本双突变占14.7%(5/34),分别为2 例19del+T790M,2 例G719X+S768I,1 例L858R+T790M。具体见表2。将表2 数据进行统计分析,得到Kappa=0.66,P=0.001,说明两种样本检测结果的一致性较好。

表2 内蒙古地区晚期肺腺癌病人50例表皮生长因子受体(EGFR)突变位点组织与血浆两种样本一致性比较/例
2.3 组织与血浆检测结果比较两种样本均为突变型的为54%(27/50),均为野生型的为30%(15/50),一致率为84%,具体见表3。以组织检测为金标准,二代测序液体活检的灵敏度、特异度、阳性预测值、阴性预测值分别为96%、68%、79%、94%。

表3 内蒙古地区晚期肺腺癌病人50例表皮生长因子受体(EGFR)突变状态组织与血浆检测结果/例
3 讨论
肺癌确诊时80%以上为中晚期,其5 年生存率仅为19.8%[4-5]。分子靶向治疗的应用和发展给肺癌病人带来了新的希望,尤其EGFR-TKIs 对EGFR 突变型NSCLC 的疗效得到了肯定。EGFR 突变存在明显种族及地区差异,2015 年发表的一项研究[6]中提出,中国大陆NSCLC 病人中EGFR 基因突变率为50.2%,且突变率在女性及非吸烟者中较高。在本研究中,组织与血浆样本检测到的EGFR 突变率在女性、非吸烟者中均高于男性、吸烟者(P<0.05),与既往研究结果一致。研究显示,肺腺癌病人血清癌胚抗原水平与EGFR 基因突变相关,随着癌胚抗原水平的增加,EGFR 基因突变率升高[7-9]。杨柳等[10]发现,随着CYFRA-211 水平的升高EGFR 突变率降低。本研究中,EGFR 基因突变型组癌胚抗原水平明显高于野生型组、CYFRA-211 水平明显低于野生型组,两种样本检测结果一致。
肿瘤组织是检测EGFR 突变状态的首选样本。但由于晚期肿瘤病人取材困难及肿瘤异质性,组织活检难以获得具有代表性的标本,对病人的治疗指导价值有限[11]。液体活检克服了组织活检的有创性及肿瘤异质性等不足,还能反复多次地检测,因而可动态反映EGFR 的突变状态及突变丰度的变化,已成为组织活检的有效补充,有助于NSCLC 的精准诊断和治疗[12-13]。该活检方法可以使用不同的液体衍生材料,例如循环肿瘤细胞、ctDNA、循环肿瘤RNA 或外泌体等,它们几乎从所有体液中获得[14]。目前ctDNA 应用最为广泛,研究发现,ctDNA携带有基因突变、缺失、重排、拷贝数异常和甲基化等信息[15]。其含量由个体状况决定,取决于肿瘤的类型、肿瘤负荷或分期,在中晚期病人外周血循环DNA 总量中一般占8%~10% ,在早期肿瘤低至0.01%~1.70%[16]。因此需要灵敏度高的检测技术检测ctDNA,而二代测序有着高灵敏度、高通量、高度自动化等特性[17],能够检测出大部分晚期病人。有数据显示,血液EGFR 检测与组织检测一致性在60%~95%之间[18]。本研究中,虽然血浆样本68%的突变率与组织样本56%的突变率稍有差异,但总体一致率为84%,灵敏度、特异度分别为96%、68%,可见二代测序检测血浆样本中EGFR 突变的灵敏度较高。而特异度偏低,考虑与组织检测野生型的病人在ctDNA 中G719X 突变率较高密切相关。由于本研究中评价灵敏度及特异度时将EGFR 基因状态分为突变型及野生型,突变型又以突变位点的不同进一步分为少见的G719X、L861Q、T790M 及S768I 突变,常见的19del和L858R突变。因此与灵敏度和特异度相比,Kappa 检验比较两种样本的一致性更有说服力,分析得出Kappa=0.66,P=0.001,说明两种样本检测结果一致性较好。
综合以上研究结果,在内蒙古地区,EGFR 的突变率在女性、不吸烟及癌胚抗原水平升高的病人中高于男性、吸烟及癌胚抗原水平正常者。基于二代测序的血浆EGFR 检测与组织检测具有较好的一致性。可以通过二代测序液体活检技术来反映晚期肺腺癌病人的基因突变情况,为无法获取病理组织的病人带来新的希望。

