中药材中多环芳烃的残留量测定及风险评估
王亚琼,钟水生,张华锋,周坚,薛满
作者单位:苏州市药品检验检测研究中心,江苏 苏州215104
多环芳烃是有机物不完全燃烧时产生的分子中含有2 个或2 个以上苯环稠合而成的挥发性碳氢化合物。早在20世纪,多环芳烃的致癌作用就被研究者们关注,15种多环芳烃在1976年被国际癌症研究中心列为化学致癌物,脂溶性的致癌物对中药水煎剂的风险较低,但对注射液的影响极大[1-2]。多环芳烃是具有慢性毒性和致癌、致畸、致突变作用的重要环境和食品污染物。多年来,大气、土壤、水体中多环芳烃的浓度受到广泛关注。我国食品安全国家标准GB 2762—2017《食品中污染物的限量》中规定有食品中苯并(a)芘的限量。欧盟在2015年10月27 日修改了多环芳香烃在部分产品中的最高限量,其中涉及干的草药苯并(a)芘、苯并(a)蒽、苯并(b)荧蒽总和的限量。而国内目前尚无中药来源样品中多环芳烃的限量要求。
多环芳烃的分析方法包括液相色谱法[3]、液质联用法[4]、气相色谱法[5]、气质联用法[6]等,多见于环境和食品专业的报道[7-17]。近年来,中药材中多环芳烃污染也逐渐受到中药安全性研究者们的关注,天花粉、大黄、葛根等药材中均检出多环芳烃的残留[6,18]。本研究以平时抽检工作中收集的多来源中药样品为研究对象,采用环境污染监测国际通用的16 种多环芳烃为指标,气相色谱-串联质谱法(GCMS/MS)测定中药材中多环芳烃的残留,为今后中药中多环芳烃残留量标准的制定提供参考。
1 材料与方法
1.1 材料超细匀浆机AS145S-P(上海昂尼仪器仪表有限公司,China),高速打粉机(Asone,Japan),电子天平AG245(METTLER,Swiss),超声仪(HU615 OF,China)。气相质谱(GC-MS)系统(GC:Agi‑lent6890N 气相色谱仪,配Agilent7683B 自动进样器;MS:Agilent7000c,USA)。气相毛细管柱(DB-5MS,0.25µm,30 m×0.25 mm,J&W Scientific,USA)。16 种多环芳烃混合标准品(2 000 ng/µL in Acetone/Benzene,Germany),4 种氘代同位素内标(CDN ISO‑TOPES,Canada)(表1),乙腈、乙酸乙酯、环己烷(HPLC,Honeywell 农残级别,USA)。SPE 小柱(200 mg/3 mL,Agilent,USA),QuEChERS SPE(SHIMAD‑ZU-GL,Japan)。实验样品:根类药材34 份、木类药材8 份、果实种子类药材8 份、花类药材31 份(其中金银花25份)、皮类药材6份、菌类药材4份、动物类药材4 份、寄生类药材4 份、叶类药材3 份及全草类药材7 份,共计109 份样品来自日常检验工作中的对照药材、抽检及送检。所有样品照现行标准检验结果均符合规定。
1.2 方法
1.2.1色谱及质谱条件 气相升温程序:初始温度75 ℃,保持1 min,以15 ℃/min 升温至150 ℃,再以3 ℃/min 升温至300 ℃,保持1 min,再以30 ℃/min 升温至320 ℃,保持1 min。载气为高纯氦,流速1.5 mL/min。进样口温度:310 ℃,不分流脉冲进样。离子源为EI,电子能量:70 eV。四级杆温度:180 ℃,离子源温度:310 ℃。16 种及4 种氘代同位素内标多环芳烃质谱多反应监测技术(MRM)模式具体选择离子见表1。
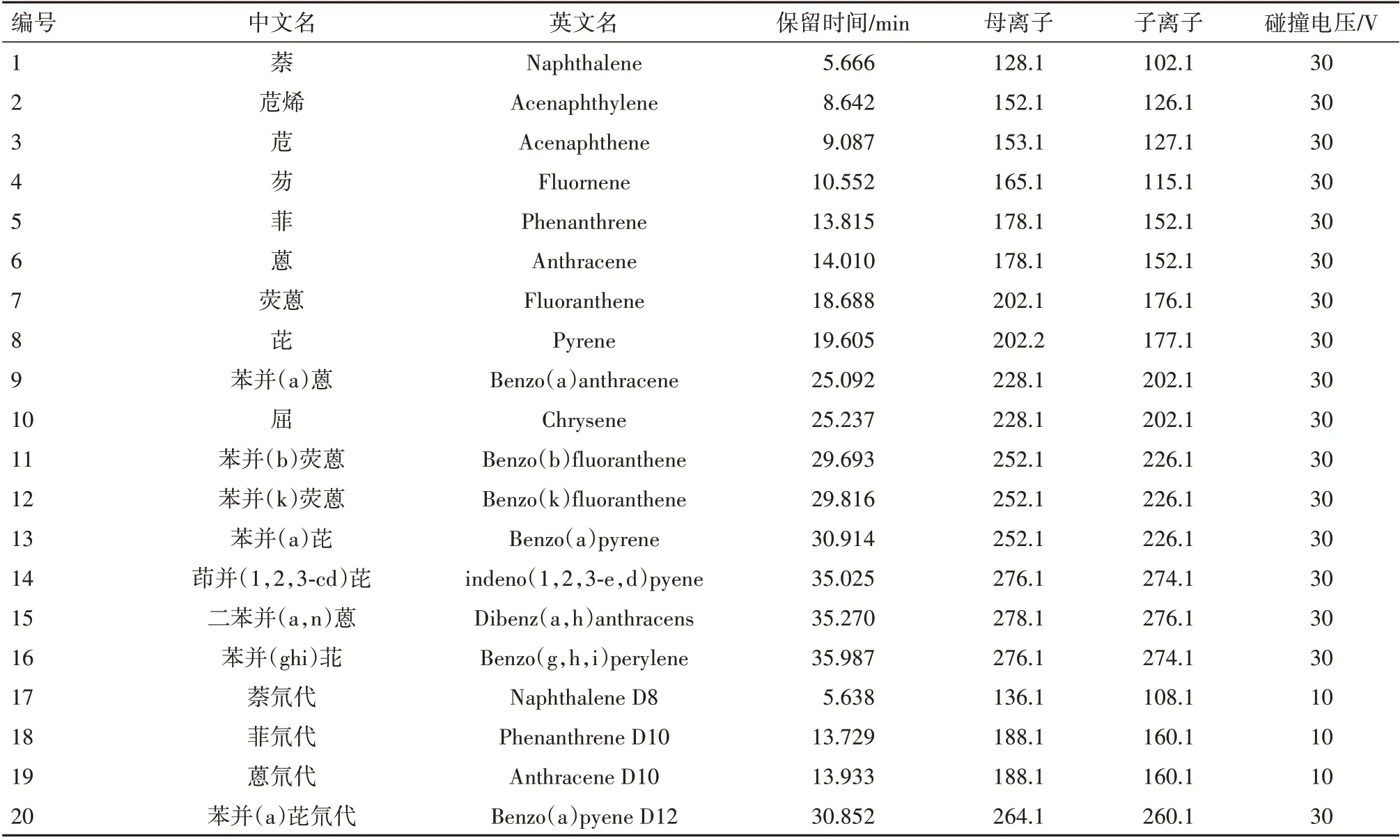
表1 16种及4种氘代同位素内标多环芳烃质谱多反应监测技术(MRM)模式具体选择离子
1.2.2 样品提取 精密称取药材细粉2 g,加含4 种同位素内标(10 µg/L)乙腈溶液10 mL,静置24 h 后超声提取10 min,过滤,即得。
1.2.3 数据处理 将测定数据导入Agilent Mass‑Hunter Quantitative Analysis 进行定量分析,采用基质标曲内标法计算。
1.2.4 方法学考察
1.2.4.1 标准曲线、定量限、检出限及基质效应 用乙腈将16 种多环芳烃标准溶液稀释成一定浓度的贮备液,逐步稀释,进样,S/N=3 时为检测限,S/N=10时为定量限,根据定量限的结果我们加入内标溶液逐级稀释成多环芳烃质量浓度分别为1、2、5、10、25、50、100、150、200 µg/L 的系列混合标准溶液,内标质量浓度均为20 µg/L。以待测物相对浓度为横坐标(x),待测物与对应内标物峰面积相对响应为纵坐标(y),用Agilent MassHunter Quantitative Analysis进行分析,可得内标法标准曲线线性回归方程,同时用空白基质样品(目标物低于检出限)配制标准曲线,制备有基质的系列标准曲线样品,进行分析。标准曲线、检测限、定量限及相关系数R2具体结果见表2。由空白标准曲线与基质标准曲线的斜率比较得知目标化合物的基质效应较低,基本对测定无影响,满足痕量测定要求。

表2 16种多环芳烃分析用内标物及标准曲线
1.2.4.2 重复性、稳定性 重复性样本取金银花样品6份,按“1.2.2”方法分别提取后进样,计算目标物相对标准差(RSD)。稳定性样本提取后室温放置0、2、4、8、16、32、48 h 进样,计算目标物在所有时间段的总RSD。结果见表3。结果可见目标测定物的重复性及稳定性均较好。
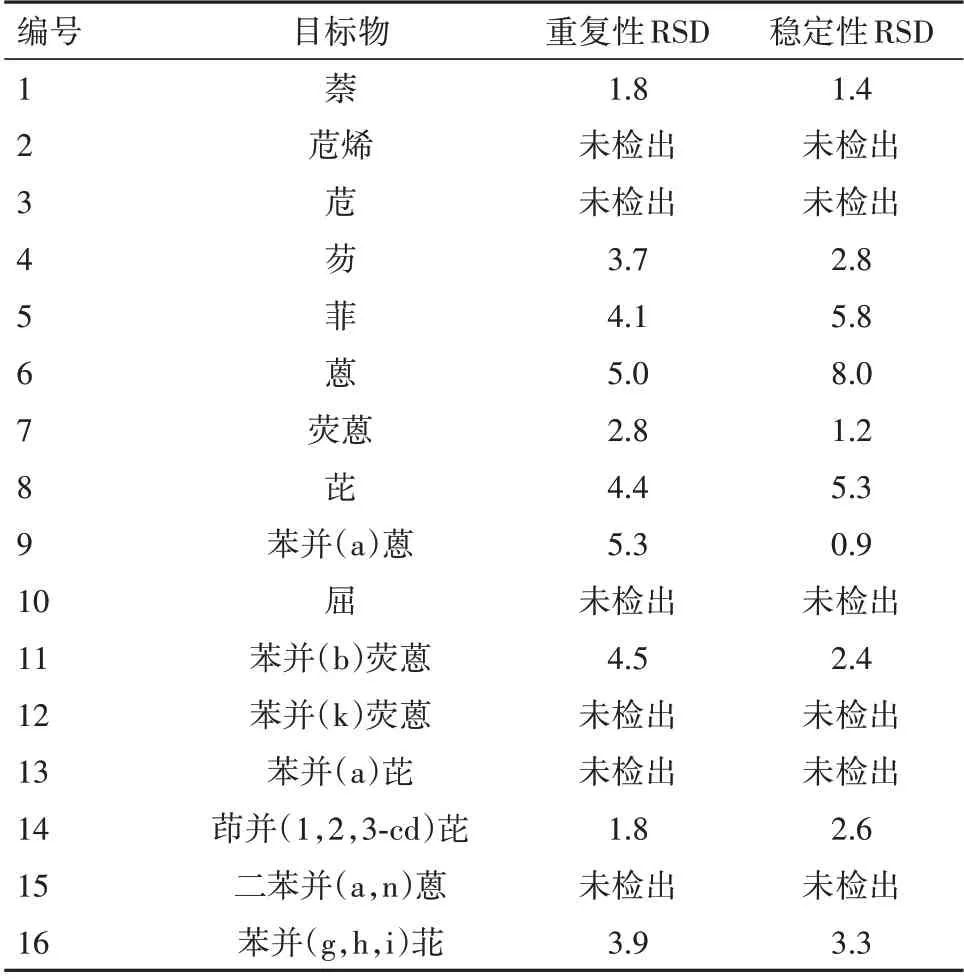
表3 16种多环芳烃的重复性、稳定性/%
1.2.4.3 精密度 取标准曲线高、中、低(150µg/L,40µg/L,2µg/L)3个浓度点样品分别进样6次,计算RSD。结果见表4。

表4 16种多环芳烃的精密度/%
1.2.4.4 回收率 参考国内外多数法定标准采用苯并(a)芘不得超过5 µg/kg 的限量标准,进行3 水平添加实验[6]。取空白基质样品分别添加高浓度25µg/kg、中浓度5µg/kg、低浓度1µg/kg的混合标准溶液,每个浓度水平平行测定3 份,计算回收率及RSD,结果见表5。

表5 16种多环芳烃的回收率/%
2 结果
本次实验分析方法学满足痕量分析要求,个别多环芳烃单体基质效应影响较大,因此所有样品采用基质标曲计算浓度。109 份样品均检出多环芳烃污染物,多环芳烃单体浓度范围为未检出至548.3µg/kg,16 种多环芳烃之和的浓度范围为27.5~2 409.4 µg/kg。2-4 环的多环芳烃检出率较高,5 环及以上的检出率较低。样品中以小分子多环芳烃为主。从各类样品平均检出总浓度看,花类>叶类>动物类>果实种子类>皮类>根类>菌类>全草类>木类>寄生藤类。花类样品对多环芳烃富集浓度最高,叶类、动物类、根类等次之。
3 讨论
(1)毒性当量因子评价:国际上对苯并(a)芘的研究最早,且具有很强的致癌性,常以其作为多环芳烃污染的标志物,食品安全国家标准GB 2762—2017《食品中污染物的限量》中规定食品中苯并(a)芘在谷物、肉类和水产动物产品中限量为5 µg/kg。参考该限量指标,利用毒性当量因子[19]计算样品中16种多环芳烃总毒性当量浓度(toxic equivalent con‑centration,TEC),即相对于苯并(a)芘的浓度,用于进行风险评估。109 份样品中11.8%的根类、12.5%的果实种子类、9.7%的花类结果超限。
(2)点评估法评价:采用点评估法,以金银花样本为例,对多环芳烃摄入暴露风险进行研究,美国环境保护署(EPA)点评估模式,急性点评估和慢性点评估的暴露量模型分别按公式(1)和(2)计算。
EXPa=LP×HR/bw…(1),
式(1)中:EXPa 为急性膳食暴露量(acute di‑etaryexposure portion),LP 为金银花日消费最大量97.5 百分位点值(kg/d),根据《中国药典》2015 年版金银花项下日用量为6~15 g 的规定,取0.015 kg 作为日消费最大量;HR 为金银花中检出的多环芳烃最大值(mg/kg);bw为平均体质量(kg),以60 kg计。
EXPc=I×R/bw…(2),
式(2)中:EXPc 为慢性膳食暴露量(chronic di‑etary exposure portion),I为人参的平均日消费量(kg/d),依据《中国药典》取值为0.001 kg;R 为金银花中多环芳烃(µg/kg)平均值。每日允许摄入量(accept‑able daily intake,ADI)值以5 µg/kg 为参考计算,风险评估采用EXPa 和EXPc 与ADI 值比值评价急性、慢性摄入风险,即急性风险商和慢性风险商。当比值≤1时,认为该危害物产生的风险是可接受的;当≥1 时,认为该危害物产生的风险超过可接受的限度,应采取适当的风险管理措施。经计算EXPa=6.4×10-6,EXPc=0.3×10-6,急性风险商为5.1 和慢性风险商为0.34,从结果可看出,金银花中多环芳烃的EX‑Pc 显著低于ADI 值,慢性风险商远低于1,说明慢性风险较小。而急性暴露风险,急性风险商明显高于1,超过临界值,急性暴露风险较高,需要进行控制,急需制定相关的标准进行控制。
本研究对10 种类别109 份中药样本中16 种多环芳烃的残留量进行GC-MS/MS 内标法的含量测定,以25 份金银花样本为例,采用点评估法进行风险评估。发现中药中多种来源的样本均存在多环芳烃的污染,按食品及欧盟的标准,多环芳烃超标率较高,存在一定的风险。建议尽快制定控制中药中多环芳烃残留量的相关标准,保障中药的安全使用。

