飞燕草素葡萄糖苷通过下调微小RNA-106a保护缺氧复氧引起的心肌细胞损伤
厉广洲
作者单位:日照心脏病医院心血管内科,山东 日照276800
心肌缺血再灌注损伤是心血管疾病中常见的主要病理特征,其发病机制尚未完全清楚,有效抑制心肌细胞凋亡,从而保护心肌细胞损伤是治疗心肌缺血再灌注损伤的重要途径之一[1-3]。研究表明中药具有保护心肌缺血再灌注损伤的作用[4]。飞燕草素葡萄糖苷(delphinidin glucoside,DPg)是飞燕草素与葡萄糖以糖苷键结合产生的一种花色苷化合物,有显著的抗氧化活性,DPg能显著抑制氧化型低密度脂蛋白诱导的内皮细胞氧化应激损伤[5]。DPg还可通过减少高糖诱导的血管内皮细胞ROS 生成,从而减少细胞凋亡,保护高糖引起的血管内皮细胞损伤[6]。DPg 可显著抑制血小板活化和血栓形成,有助于预防心血管疾病[7]。研究表明微小RNA(mi‑croRNA,miRNA/miR)也参与调控了心肌缺血再灌注损伤的进展,其可作为治疗靶点[8-10]。有研究发现miR-106a 在体内外肥厚心肌中均上调表达,miR-106a 是促进肥大的重要因素[11]。在大鼠肾脏缺血再灌注损伤后期miR-106a 的表达水平显著升高[12]。然而DPg 和miR-106a对缺氧复氧(H/R)引起的心肌细胞损伤的影响还尚未可知,2018 年4 月至2019 年10 月,本实验以H/R 复制心肌细胞H9C2 体外缺血/再灌注环境[13],观察DPg 在此过程中是否具有保护作用,及其机制是否与miR-106a有关。
1 材料与方法
1.1 材料心肌细胞H9C2购自深圳市百恩维生物科技有限公司;DPg 购自上海惠诚生物科技有限公司;MTT 法试剂盒、蛋白提取试剂盒、二甲基亚砜(DMSO)、膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)和碘化丙啶试剂盒购自北京Beyotime Biotech‑nology 公司;Trizol 试剂、荧光定量试剂盒、Lipo‑fectamineTM2000转染试剂购自美国Invitrogen公司。
1.2 方法
1.2.1 细胞培养与H/R 处理 H9C2 细胞用含10%胎牛血清的低糖DMEM 培养基,在37 ℃、5%二氧化碳条件下培养。
H/R:H9C2 细胞在无血清低糖的DMEM 中,置于入95%氮气+5%二氧化碳的缺氧培养箱中保持2 h,然后更换为含10 % 胎牛血清的高糖DMEM,37 ℃、5%二氧化碳的无菌箱中继续培养6 h。正常条件培养的细胞作为对照组。
1.2.2 细胞转染和分组 用终浓度为50 µmol/L、100 µmol/L、1 000 µmol/L 的DPg 培养液处理H9C2细胞24 h,而后进行H/R 处理,分别记为H/R+50µmol/L DPg 组、H/R+100 µmol/L DPg 组、H/R+1 000µmol/L DPg 组;抗miR-106a(anti-miR-106a)阴性对照(anti-miR-con)、anti-miR-106a 质粒转染至H9C2细胞后进行H/R 处理记为H/R+anti-miR-con 组,H/R+anti-miR-106a 组。 miR-106a 阴性对照(miRcon)、miR-106a 分别转染至H9C2 细胞中同时用100µmol/L的DPg处理24 h,而后进行H/R处理,记为H/R+DPg+miR-con组,H/R+DPg+miR-106a组。上述载体质粒均构建自金瑞斯公司。
1.2.3 MTT 法检测细胞活性 各组H9C2 细胞分别加入20 µL 的噻唑蓝(MTT)溶液,继续孵育4 h;加入150 µL DMSO 振荡反应10 min,酶标仪检测490 nm 处吸光度值。细胞存活率(%)=实验组吸光度值/空白对照组吸光度值×100%。
1.2.4 蛋白质印迹法(Western blotting)检测活化胱天蛋白酶-3(cleaved-caspase-3)、细胞周期蛋白D1(cyclin D1)蛋白表达水平 提取各组H9C2 细胞总蛋白,二辛可宁酸法测定浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后,将蛋白电转至聚偏二氟乙烯(PVDF)膜上,50 g/L 脱脂奶粉室温封闭1 h;分别4 ℃加入一抗,过夜;室温加入二抗,孵育2 h;暗室中曝光显影,晾干后用Quantity One凝胶分析软件处理,测定各组蛋白条带的灰度值,以目的条带和β 肌动蛋白(β-actin)条带的比值作为蛋白表达水平。
1.2.5 流式细胞术检测细胞凋亡 各组细胞培养48 h 后用胰蛋白酶消化,预冷PBS 洗涤后重悬。按照Annexin V-FITC 和碘化丙啶试剂盒说明书,流式细胞仪检测细胞凋亡情况。
1.2.6 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测miR-106a 表达水平 提取细胞总RNA,紫外分光光度计检测RNA 纯度和浓度。用逆转录试剂盒将RNA 逆转录成互补DNA(cDNA),按照荧光定量使用说明书,在95 ℃30 s,60 ℃30 s;72 ℃30 s,40 个循环;60 ℃延长5 min 的循环条件下进行PCR 扩增。相对表达量采用2−ΔΔCt法计算。miR-106a 正向引物序列:5´-AAAAGTGCTTACAGTG‑CAGGTAG-3´,反向引物序列:5´-CTACCTGCACTG‑TAAGCACTTTT-3´;内参U6 正向引物序列:5´-ATT‑GGAACGATACAGAGAAGATT-3´,反向引物序列:5´-GGAACGCTTCACGAATTTG-3´。
1.3 统计学方法实验数据用SPSS 22.0 进行统计分析,结果以±s表示。两组间数据比较采用两独立样本t检验,多组间数据比较采用单因素方差分析,多组间的两两比较采用LSD 法。以P<0.05 为差异有统计学意义。
2 结果
2.1 DPg 对H9c2 细胞的增殖的影响以下各组细胞存活率比较,F=23.56,P<0.001。与对照组相比,H/R 组H9C2 细胞存活率[(46.38±4.65)% 比(100.86±10.08)%]显著降低;与H/R 组相比,50、100、1 000 µmol/L 浓度DPg 处理组H9C2 细胞存活率[(60.03±6.01)%、(83.76±8.38)%、(85.38±8.50)%比(46.38±4.65)%]显著升高。均差异有统计学意义(P<0.05)。
2.2 DPg 对H9C2 细胞凋亡的影响H/R 组cleaved-caspase-3表达水平、细胞凋亡率均比对照组显著升高(P<0.05);H/R+100µmol/L DPg 组cleavedcaspase-3 表达水平、细胞凋亡率均比H/R 组降低(P<0.05)。见图1、表1。
表1 DPg对各组心肌细胞H9C2凋亡影响的研究/± s

表1 DPg对各组心肌细胞H9C2凋亡影响的研究/± s
注:DPg为飞燕草素葡萄糖苷,H/R为缺氧复氧,cleaved-caspase-3为活化胱天蛋白酶-3。①与对照组比较,P<0.05。②与H/R组比较,P<0.05。
重复次数细胞凋亡率/%7.05±0.71 18.35±1.83①10.25±1.03②62.13<0.001组别对照H/R H/R+100µmol/L DPg F值P值333 cleaved-caspase-3 0.25±0.02 0.88±0.09①0.42±0.04②94.66<0.001
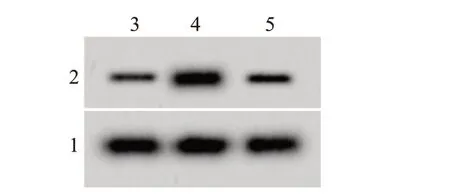
图1 飞燕草素葡萄糖苷(DPg)对各组心肌细胞H9C2凋亡的影响
2.3 DPg 对miR-106a 表达的影响以下各组miR-106a 表达水平比较,F=100.08,P<0.001。与对照组(1.00±0.11)相比,H/R 组miR-106a 表达水平(3.56±0.36)显著升高(P<0.05);与H/R 组相比,H/R+100µmol/L DPg 组miR-106a 表达水平(1.53±0.15)显著降低(P<0.05)。
2.4 miR-106a 低表达对H9C2 细胞增殖和凋亡的影响H/R 组miR-106a、cleaved-caspase-3 表达水平、细胞凋亡率比对照组显著升高,cyclin D1表达水平、存活率比对照组显著降低(P<0.05);H/R+antimiR-106a 组miR-106a、cleaved-caspase-3 表达水平、细胞凋亡率比H/R+anti-miR-con 组显著降低,cyclin D1 表达水平、存活率比H/R+anti-miR-con 组显著升高(P<0.05)。见图2、表2。
表2 miR-106a低表达对心肌细胞H9C2增殖和凋亡的影响/± s

表2 miR-106a低表达对心肌细胞H9C2增殖和凋亡的影响/± s
注:H/R为缺氧复氧,cyclin D1为细胞周期蛋白D1,cleaved-caspase-3为活化胱天蛋白酶-3。①与对照组比较,P<0.05。②与H/R+anti-miR-con组比较,P<0.05。
组别对照H/R H/R+anti-miR-con H/R+anti-miR-106a F值P值细胞凋亡率/%7.12±0.72 19.03±1.90①19.23±1.95 11.35±1.15②46.20<0.001重复次数3333 miR-106a 1.00±0.12 3.52±0.35①3.60±0.36 1.42±0.14②78.49<0.001 cyclin D1 1.20±0.12 0.45±0.05①0.43±0.04 1.02±0.10②65.30<0.001 cleaved-caspase-3 0.30±0.03 0.88±0.09①0.92±0.10 0.45±0.05②53.52<0.001细胞存活率/%100.13±10.02 45.36±4.55①49.06±4.92 89.13±8.91②41.23<0.001
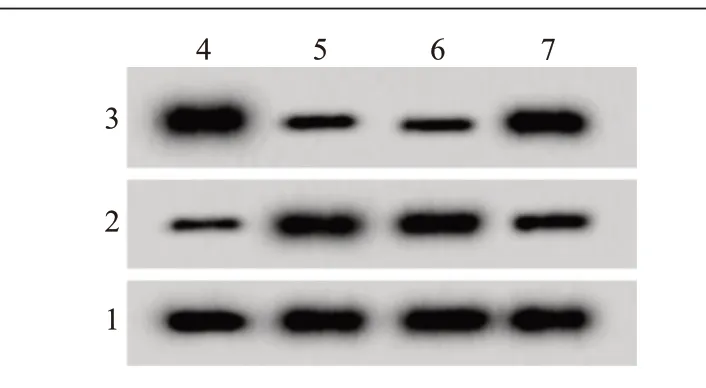
图2 蛋白质印迹法检测miR-106a低表达的心肌细胞H9C2 cyclin D1、cleaved-caspase-3表达
2.5 高表达miR-106a可以逆转100μmol/L DPg对H9C2 细胞增殖和凋亡的影响H/R+DPg 组miR-106a、cleaved-caspase-3 表达水平、凋亡率显著低于H/R 组,cyclin D1 表达水平、存活率显著高于H/R 组(P<0.05);H/R+DPg+miR-106a 组miR-106a、cleavedcaspase-3 表达水平、凋亡率显著高于H/R+DPg+miR-con 组,cyclin D1 表达水平、细胞存活率显著低于H/R+DPg+miR-con组(P<0.05)。见图3、表3。
表3 高表达miR-106a可以逆转100µmol/L DPg对心肌细胞H9C2增殖和凋亡的影响/± s

表3 高表达miR-106a可以逆转100µmol/L DPg对心肌细胞H9C2增殖和凋亡的影响/± s
注:DPg为飞燕草素葡萄糖苷,H/R为缺氧复氧,cyclin D1为细胞周期蛋白D1,cleaved-caspase-3为活化胱天蛋白酶-3。①与H/R组比较,P<0.05。②与H/R+DPg+miR-con比较,P<0.05。
组别H/R H/R+DPg H/R+DPg+miR-con H/R+DPg+miR-106a F值P值细胞凋亡率/%18.06±1.81 10.02±1.05①10.38±1.03 16.39±1.65②24.90<0.001重复次数3333 miR-106a 1.00±0.12 0.38±0.04①0.36±0.03 0.86±0.09②52.78<0.001 cyclin D1 0.45±0.04 1.12±0.12①1.18±0.11 0.62±0.06②49.78<0.001 cleaved-caspase-3 0.90±0.09 0.40±0.04①0.45±0.05 0.80±0.08②40.19<0.001细胞存活率/%100.75±10.08 145.86±14.59①147.38±14.75 110.37±11.10②10.58<0.001
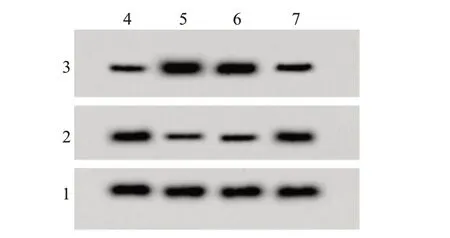
图3 高表达miR-106a可以逆转100µmol/L飞燕草素葡萄糖苷(DPg)对心肌细胞H9C2 cyclin D1、cleaved-caspase-3蛋白表达的影响
3 讨论
研究发现花色苷对阿霉素造成的心肌损伤具有保护作用[14]。如矢车菊素-3-葡萄糖苷可改善阿霉素诱导的小鼠心脏毒性[15]。DPg 是花色苷的一种,研究报道DPg能显著增加内皮细胞活力、抑制细胞凋亡从而抑制内皮细胞氧化低密度脂蛋白损伤[16]。DPg可保护人脐静脉内皮细胞免受氧化的低密度脂蛋白诱导的损伤[17]。本实验为研究DPg 对H/R 诱导的心肌细胞损伤的影响,成功建立心肌细胞损伤模型,用不同浓度的DPg 处理H/R 诱导的心肌细胞,结果显示,心肌细胞存活率增加,但细胞凋亡率减少。说明DPg 可以通过促增殖和抗凋亡作用,缓解H/R 导致的心肌细胞损伤。提示,DPg 可能是潜在的H/R心肌细胞损伤保护药物。
本研究结果显示,H/R 诱导的心肌细胞中miR-106a 表达水平显著升高。有研究表明,miR-106a 在大鼠肾缺血再灌注损伤后表达水平升高[12]。本实验结果与上述研究结果类似。miR-106a 是miR-17家族的成员[18],有研究报道miR-106a 通过调节TH‑BS2 加重了脂多糖诱导的TCMK-1 细胞的炎症和细胞凋亡进而加重了败血症诱导的急性肾损伤[19]。表明miR-106a 可能通过调控细胞炎症和凋亡引起肾损伤。本实验为研究miR-106a 对H/R 诱导的心肌细胞损伤的影响,转染miR-106a 抑制表达载体,结果显示,转染后心肌细胞呈现较高的存活率、较低的细胞凋亡率。说明抑制miR-106a 可抑制H/R引起的心肌细胞凋亡;保护心肌细胞免受损伤。
为研究DPg 与miR-106a 的关系及其是否相互作用影响H/R 诱导的心肌细胞损伤,本实验检测了DPg 处理的心肌细胞中miR-106a 的表达水平,结果显示miR-106a 表达水平显著降低,表明DPg 可降低miR-106a 表达。结果表明,高表达miR-106a 逆转了DPg 对H/R 诱导的心肌细胞损伤的保护作用。提示,DPg 可能通过下调miR-106a 的表达而对H/R 诱导的心肌细胞损伤发挥保护作用。
综上所述,在H/R 引起的心肌细胞损伤中,DPg可促增殖、抑凋亡,发挥保护作用;其机制可能与下调miR-106a 有关。将可为保护心肌缺血/再灌注损伤提供药物防治的理论依据。

