急性髓系白血病67种基因突变检查及临床意义
黄 莉, 林丽娥, 符祥俊, 郭 丽, 孟 灿
(海南省人民医院/海南医学院附属海南医院血液内科, 海南 海口 570311)
急性髓系白血病(acute myeloid leukemia,AML)是来源于髓系造血干祖细胞的恶性克隆性血液系统疾病,临床以正常造血抑制、组织器官浸润等为主要症状[1]。当前,多种强效化疗药物的联合应用是临床AML治疗的主要手段,但老年AML患者免疫力普遍较低,无法耐受强效化疗药物,在一定程度上影响了治疗疗效[2]。若能对老年患者进行综合性的评估,拟定个体化治疗方案,将有利于老年患者的预后。研究发现,AML在细胞遗传学和分子水平上具有高度异质性,而基因突变在AML的发生发展、预后分层中发挥重要作用[3]。当前,有关老年AML基因突变的研究多局限于个别基因,包含多种基因突变的基因突变谱与老年AML患者临床特征、预后的关系有待进一步研究。本研究分析了AML患者67种基因突变的发生情况及其与患者临床特征、预后的关系,旨在加强对AML发病机制的理解,为老年AML患者临床治疗方案的制定提供新的思路。
1 资料与方法
1.1一般资料:选取2018年5月至2019年5月在本院接受治疗的AML(非急性早幼粒细胞白血病)患者117例,纳入标准:①临床检查符合AML的诊断标准[4],且均经细胞形态学、分子生物学、遗传学及免疫学检查确诊:外周血或骨髓原始细胞≥20%、存在克隆性重现性细胞遗传学异常、2个髓系免疫表型阳性且淋系标记<2个或髓过氧化物(MPO,+)或非特异性酯酶(+)或丁酸盐(+);②患者性别不限,年龄≥60岁,均为初诊确诊患者;③均接受化疗治疗患者;④患者知情同意,均签署知情同意书。排除标准:①急性早幼粒细胞白血病及其他类型白血病患者;②合并其它恶性肿瘤、血液疾病患者;③接受造血干细胞移植患者;④一般临床资料不完整,不能定期复查患者。本研究经医院伦理委员会批准,符合赫尔辛基宣言。
1.2方 法
1.2.1一般临床资料收集:收集患者的性别、年龄、初诊时白细胞计数(whtie blood count,WBC)、血红蛋白(Hemoglobin,HGB)和骨髓原始细胞水平等一般临床资料。
1.2.2AML分类及染色体核型分析:患者就诊后行骨髓穿刺术抽取骨髓血0.2~0.3mL涂片,进行形态学及细胞化学染色检查;参考法美英(France-America-British,FAB)分类标准将AML患者分为M0~M7型[5]。骨髓细胞经过24h~48h培养后,收集细胞常规制片,采用G显带技术进行核型分析,根据患者染色体核型结果进行危险度分层,将AML患者分为低危核型、中危核型和高危核型。
1.2.3基因突变检测:采用二代测序技术进行基因突变检测。取患者血液样本,分离并收集骨髓单个核细胞,采用QIAamp DNA Blood Mini kit试剂盒提取基因组DNA,紫外分光光度仪(UV240型,岛津实验器材有限公司)测定基因组DNA浓度和纯度,样品稀释至50ng/μL备用。取样品基因组DNA10~17ng,采用Ion Torrent检测平台中的Ion Ampliseq超高多重PCR靶向技术,富集112个基因血液系统疾病相关基因的外显子区、UTR及靠近外显子的部分内含子区域。测序后数据利用dbSNP,1000genome,polyphen2,cosmic等数据库进行筛选和突变验证。
1.2.4治疗方案:患者接受DA(柔红霉素+阿糖胞苷)方案、IDA(去甲柔红霉素+阿糖胞苷)方案或以维甲酸、亚砷酸为主的初始诱导化疗方案进行化疗。诱导治疗后达完全缓解患者接受4个疗程的巩固化疗(阿糖胞苷);部分缓解和原始细胞下降大于50%者给予第2次诱导化疗,2个疗程后再进行疗效评价,确定是否进行巩固化疗。
1.2.5随访:对基因检测结果显示基因突变的患者进行随访,随访形式包括门诊定期随访、问卷及电话随访。随访截止为出院后2年,确诊之日至死亡或末次随访日期为总体生存(OS)时间。
1.3统计学处理:采用SPSS20.0统计软件对数据进行分析。非正态分布的计量资料以中位数(P25~P75)表示,行Mann-Whitney非参数检验;计数资料以n(%)表示,行Fisher确切概率检验,两两比较采用矫正检验水准的Bonferroni法;采用Kaplan-Meier法绘制生存曲线,生存率比较采用log-rank检验;预后影响因素分析采用Cox比例风险回归分析;检验水准:α=0.05。
2 结 果
2.1AML患者一般临床资料分析:117例患者中,男61例,女56例;中位年龄69(60~79)岁;初诊时WBC中位数12.83(2.36~53.48)×109L-1,HGB中位数78.46(61.47~98.71)g/L,骨髓原始细胞中位数65.47(10.53~80.24)%;FAB分型及危险度分层见图1。
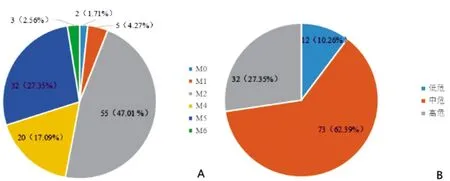
图1 117例AML患者FAB分型及危险度分层(A)FAB分型;(B)危险度分层
2.2AML患者基因突变发生情况分析:117例患者中,108例(92.31%)患者检查基因突变,其中单基因突变25例(21.37%),2个基因突变共存36例(30.77%),同时携带≥3个基因突变的47例(40.17%)。检测到的基因突变共涉及67种基因,108例患者中突变检出率≥10%的突变基因依次为NRAS突变25例(23.15%),NPM1突变21例(19.44%),DNMT3A突变17例(15.74%),TET2突变16例(14.81%),WT1突变13例(12.03%),CEBPA突变13例(12.03%),FLT3-ITD+TKD突变12例(11.11%),GATA2突变12例(11.11%),ASXL1突变11例(10.19%),BCORL1突变11例(10.19%)。其他突变检出率不足10%但大于5%的突变基因包括:IDH1、IDH2、JAK2、PTPN11、RUNX1、SETBF1、SRSF2突变9例(8.33%),KIT、ETNK1、NF1、KRAS、SRP72、STAG2、TP53突变6例(5.56%)。突变检出率不足5%的突变基因包括:ABL1、AKNRD26、ATM、BCOR、BRAF、CALF、CBL、CSF3R、CSMD1、CUX1、DDX41、EP300、ETV6/TEL、EZH2、GATA1、GNAS、IKZF1、JAK1、JAK3、NFE2、KMT2C/MLL3、KMT2D/MLL2/MLL4、MPL、LNK(SH2B3)、PDGFRA、NOTCH1、PHF6、PIGA、PRPF40B、PRPF8、PTEN、RAD21、ROBO1、ROBO2、SF1、SF3A1、SF3B1、SMC1A、SMC3、SUZ12、TET2、U2AF1/U2AF35、U2AF2、ZRSR2。
2.3AML患者基因突变的功能类型分布:将突变检出率≥5%的突变基因按照功能进行聚类分析,常见突变基因涉及的通路包括:表观遗传学(占57.41%,包括:DNMT3A、TET2、ASXL1、IDH1、IDH2),信号通路(占50.93%,包括:NRAS、JAK2、PTPN11、KIT、KRAS),转录调节(占49.07%,包括:WT1、CEBPA、GATA2、RUNX1、STAG2),细胞增殖或凋亡(占25.00%,包括:NPM1、TP53),剪切因子(占8.33%,包括:SRSF2),其他(占35.19%)。
2.4部分基因突变与AML患者临床特征之间的关系:NRAS基因突变患者HGB水平低于无突变患者(P<0.05),NPM1基因突变WBC水平高于无突变患者(P<0.05);DNMT3A基因突变患者WBC、HGB和髓原始细胞水平与无突变患者比较,差异无统计学意义(P>0.05),见表1。
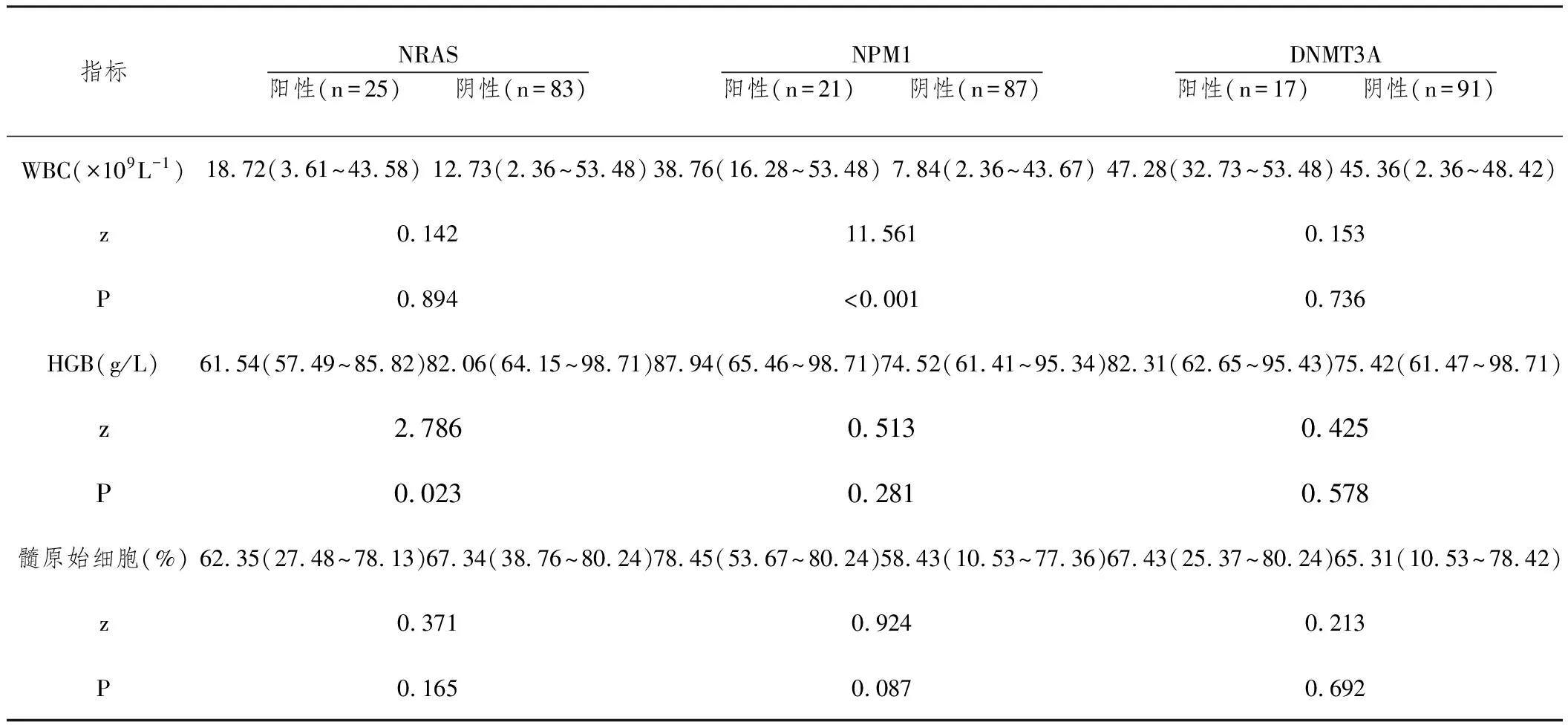
表1 部分基因突变与AML患者临床特征之间的关系[M(P25~P75)]
2.5部分基因突变与AML患者染色体核型危险度分层之间的关系:NPM1、DNMT3A基因突变在中危患者中的检出率高于低、高危患者(P<0.05),NRAS基因突变在低危、中危和高危患者中的检出率比较,差异无统计学意义(P>0.05),见表2。
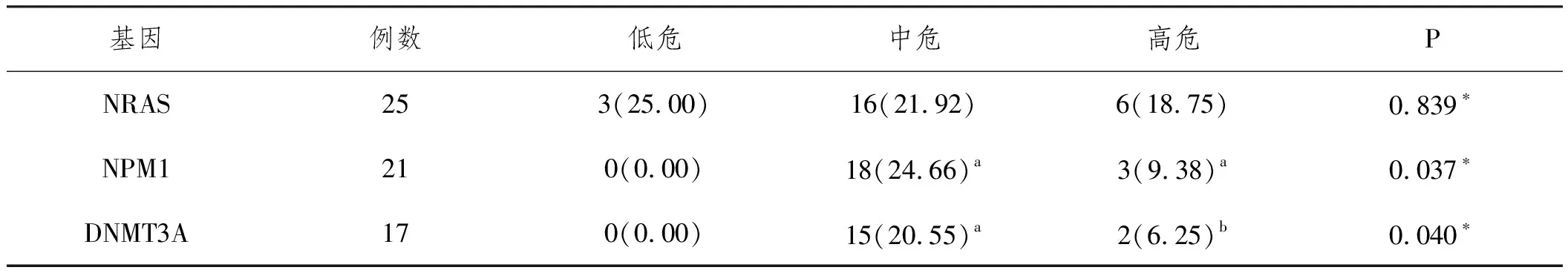
表2 不同染色体核型危险度分层患者的部分基因突变检出情况n(%)
2.6基因突变AML患者预后情况分析:108例AML患者的中位OS为8个月,两年累计生存率为45.37%。NPM1基因突变患者的两年累计生存率为66.67%,较无突变患者(40.23%)高(χ2=4.770,P=0.029);DNMT3A基因突变患者的两年累计生存率为23.53%,较无突变患者(49.45%)低(χ2=3.949,P=0.038);NRAS基因突变患者与无突变患者的两年累计生存率(36.00%vs.48.19%)比较,差异无统计学意义(χ2=1.080,P=0.216)。基因突变数目≥3个患者的两年累计生存率为31.91%(15/47),基因突变数目<3个的患者(55.74%,34/61)低(χ2=5.806,P=0.012),见图2。
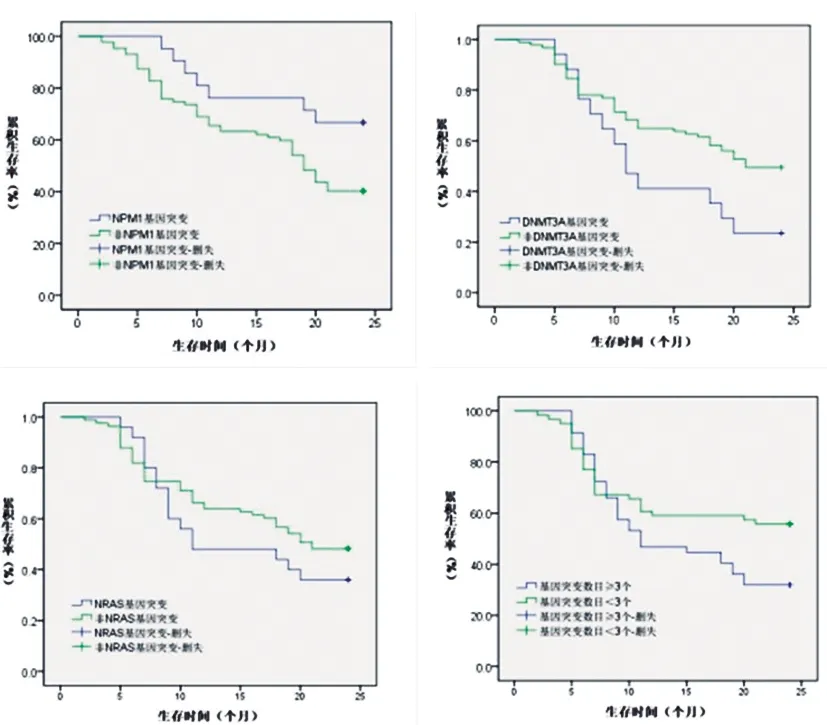
图2 AML患者的总生存曲线
2.7基因突变与患者OS之间的关系:多因素分析结果显示,NPM1基因未突变、DNMT3A基因突变、基因突变数目≥3个与AML患者较差OS相关(P<0.05)。见表3。
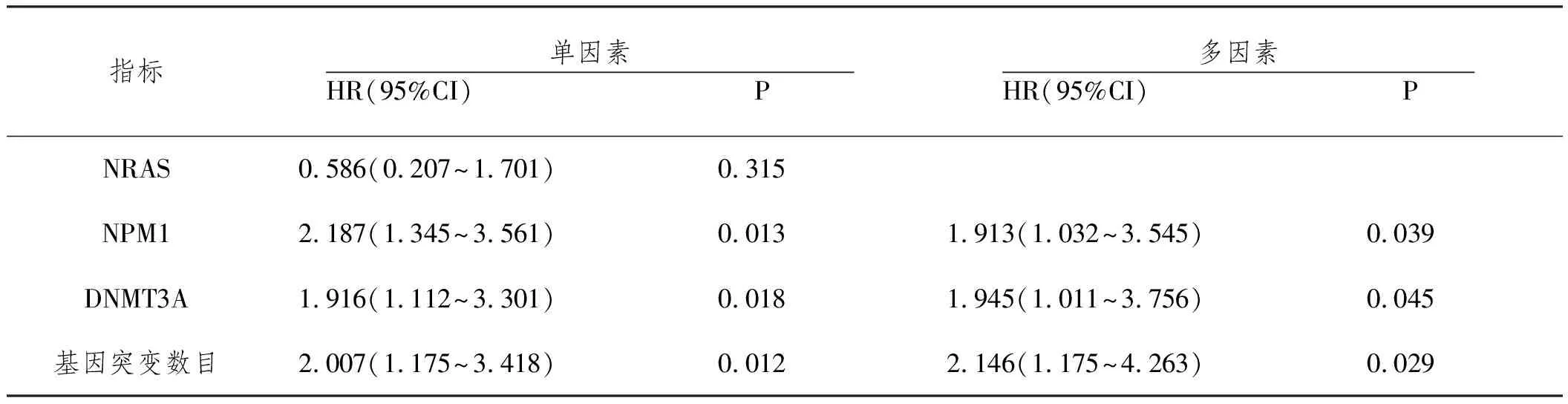
表3 基因突变与患者OS之间的关系
3 讨 论
既往研究表明,与年轻成人AML患者相比,老年AML患者的具有的细胞遗传学和分子生物学预后不良因素比例较高,临床疗效明显较差,了解老年AML患者的基因突变特征可为进一步理解老年AML的生物学特点及指导临床治疗提供可靠依据[6]。近年来,基因测序技术的发展为临床分析AML的基因突变提供了便利,越来越多具有临床意义的基因突变被发现[7]。本研究应用二代测序技术分析了老年AML患者的基因突变情况,研究结果显示,117例AML患者中,基因突变检出率达92.31%,且以同时携带≥3个基因突变的检出率最高,与既往研究[8]结果类似,提示AML患者基因突变发生率较高,大部分患者至少携带1个基因突变。
3.1AML患者基因突变发生情况分析:本研究中,检测到的基因突变共涉及67种基因,其中突变检出率≥10%的突变基因依次为NRAS、NPM1、DNMT3A、TET2、WT1、CEBPA,FLT3-ITD+TKD、GATA2、ASXL1和BCORL1。Prassek等[9]分析了75岁以上老年AML患者的基因突变谱,发现患者基因突变个数的中位数是4个,且以TET2、DNMT3A、NPM1、SRSF2和ASXL1基因为最常见的突变基因,与本研究结果存在差异,考虑与纳入对象年龄不同、不同人种基因突变频率不同有关。吕晓东等[10]在有关AML患者克隆异质性的研究中指出,AML患者检出的突变基因主要以信号传导相关基因、表观遗传相关基因和转录调节相关基因为主,认为疾病早期出现异常基因易导致基因表观遗传修饰和转录调控等遗传信息的不稳定性,易造成克隆异质性,影响疾病进展及预后。本研究也发现,AML相关基因突变主要涉及的通路有表观遗传学、转录调节、细胞增殖或凋亡和剪切因子等,与既往研究结果类似。
3.2部分基因突变对AML患者临床特征及预后的影响:为明确基因突变与AML患者临床特征及预后的关系,本研究选择性分析了NRAS、NPM1和DNMT3A基因与患者临床特征及预后的关系。研究结果显示,NRAS基因突变患者HGB水平低于无突变者,NPM1基因突变患者WBC水平高于无突变者;NPM1、DNMT3A基因突变在中危患者中的检出率高于低、高危患者,提示NRAS、NPM1和DNMT3A基因突变与AML患者的临床特征存在相关性。NRAS基因可编码膜蛋白,是一种可将细胞外信号转至细胞核以调节细胞增殖、分化和凋亡的“分子开关”,其外显子及密码子的错义突变参与了AML的发生发展,而在AML发展过程中,患者骨髓造血功能出现障碍,使机体不能造血,最终影响WBC、HGB等水平。李甜甜等[11]分析了NRAS基因突变在成人AML患者中的表达,也发现合并NRAS基因突变的患者其HGB水平较无突变者低。NPM1基因位于人类染色体5q35上,可以伴侣蛋白的形式促使核糖体合成,并经由抑癌基因p53等调控细胞增殖及调控。肖蓉等[12]报道在老年急性非早幼粒细胞白血病患者中,NPM1基因突变阳性患者的WBC水平显著高于NPM1基因突变阴性患者,认为NPM1基因突变与CD34、CD117低表达相关,患者免疫功能下降,进而影响WBC的水平。也有研究发现,NPM1、DNMT3A基因突变与患者染色体核型危险度分层之间无相关性,可能与患者年龄组成、遗传学危险分组及构成不同有关[13]。进一步分析不同基因突变患者的预后情况可知,NPM1基因未突变、DNMT3A基因突变、基因突变数目≥3个与AML患者较差OS相关,提示基因突变数目和类型与AML患者OS存在明显相关性,因此推测NPM1、DNMT3A等基因突变与基因突变数目可增加AML患者预后不良的危险度,而NPM1基因突变可能与良好预后有关。
综上所述,AML患者基因突变率较高,基因突变数目和类型与患者临床特征、预后相关,评估患者基因突变特征可为AML的疾病诊断、治疗选择及风险分层提供有效的参考信息。

