多发性骨髓瘤合并侵袭性真菌感染患者外周血淋巴单核比淋巴细胞亚群变化及其与预后的关系
陈丽娟, 张家友, 韩少玲, 吴 晶, 陈园园, 代明辉
(1.成都医学院第二附属医院/核工业四一六医院, 四川 成都 610051 2.四川省绵阳市第三人民医院血液科, 四川 绵阳 621000)
多发性骨髓瘤(Multiple myeloma,MM)是一种血液系统原发性的浆细胞性肿瘤,是血液系统中仅次于淋巴瘤发生率排名第二的恶性肿瘤,据研究报告显示,2016年我国MM患者的发病率约为1.03/10万人口左右[1]。临床主要表现为进行性的骨痛、继发性贫血、肾功能损伤和感染等,严重影响患者生存水平。而且MM患者骨髓瘤细胞可以合成大量单克隆免疫球蛋白,抑制机体正常免疫球蛋白的合成,使得患者免疫功能受到损伤导致免疫力下降,引发侵袭性真菌感染(Invasive Fungal Infections,IFI),对患者的生命安全造成严重威胁。MM合并IFI患者常并发多种症状累及多个器官,加快疾病进程,因此早期明确MM合并IFI患者疾病进展相关指标,对于判断疾病预后有重要意义。外周血淋巴细胞与单核细胞比(Lymphocyte-to-Monocyte Ratio,LMR)是可以反映机体免疫状态的淋巴细胞与单核细胞的比值,其表达与患者免疫系统与肿瘤诱导免疫功能障碍有关[2]。淋巴细胞亚群主要包括T淋巴细胞、B淋巴细胞以及NK淋巴细胞等,其中分别以CD3+、CD19+和CD16+56+较具代表性,其能够参与免疫应答,与MM的起病和进展关系密切[3]。当前临床对于MM合并IFI的患者诊断主要是通过病理学、影像学、实验室等检查进行确诊,未明确准确度高、检测便捷和操作相对简单的指标从而对患者预后进行判断,本研究将分析LMR和CD3+、CD19+和CD16+56+水平在MM合并IFI患者中的表达及其意义,现报道如下:
1 资料与方法
1.1一般资料:选择2016年1月至2018年3月我院收治的MM合并IFI患者105例作为研究对象,选择MM未合并IFI的患者98例作为对照组。依据Durie-Salmon分期[4](DS分期)分为Ⅰ~Ⅱ期46例,Ⅲ期59例。DS分期标准:Ⅰ期(符合下列4项):血红蛋白>100g/L;血清钙正常≤3.0mmoL/L;骨骼X线示结构正常或孤立性骨浆细胞瘤;低M蛋白量:免疫球蛋白G(Immunoglobulin G,IgG)<50g/L,免疫球蛋白A(Immunoglobulin A,IgA)<30g/L,24h尿液中本周氏蛋白<4g。Ⅱ期:不符合Ⅰ~期和Ⅲ期的患者。Ⅲ期(符合任意一项或以上):血红蛋白<85g/L;血清钙>3.0mmoL/L;骨骼X线示溶骨性病灶超过3个;高M蛋白量:IgG>70g/L,IgA>50g/L,24h尿液中本周氏蛋白>12g。诊断标准:符合《中国多发性骨髓瘤诊治指南(2015年修订)》中关于MM的诊断标准[5]:①MM的诊断:症状性MM:骨髓组织活检测存在浆细胞瘤或者骨髓中单克隆浆细胞的比例超过10%;采用琼脂糖凝胶免疫固定电泳技术在尿液或血液中检测出克隆性免疫球蛋白且伴有组织和器官的损害。无症状MM:单克隆性免疫球蛋白大于等于30g/L或者骨髓克隆性的浆细胞比重大于等于10%。②IFI的诊断:参照2013年发布的血液病/恶性肿瘤IFI诊断标准与治疗原则(第四次修订版)[6]中诊断依据:在通常无菌而临床表现或放射学检查存在感染的部位病理学检查呈阳性,且在无菌条件下取得的标本培养结果呈阳性或(和)脑脊液经镜检出现隐球菌呈阳性,血液真菌培养呈念珠菌、霉菌或酵母菌阳性且具有感染的症状体征。纳入和排除标准:纳入标准:①初诊患者;②既往未发生真菌感染者。排除标准:①其他血液系统疾病或代谢性疾病;②合并多个系统器官疾患;③免疫功能障碍或其他感染性疾病。观察组和对照组患者年龄、性别、M蛋白分型[IgA,IgG,免疫球蛋白D型(Immunoglobulin D,IgD,轻链型]和Durie-Salmon分期(DS分期)资料比较差异不具有统计学意义(P>0.05),见表1。

表1 观察组与对照组一般资料比较
1.2方法:采用流式细胞术检测上述各组外周血淋巴细胞计数和单核细胞计数,计算LMR,测定患者的CD3+、CD19+和CD16+56+水平。具体操作如下:①采集各组患者和健康人晨起空腹静脉血5mL,分别置于乙二胺四乙酸二钠抗凝管和生化管中备用。②分别将两支流式试管编号为a和b,然后各加入荧光抗体各10μL。③将抗凝血置于室温平衡6h后轻轻摇匀,反向加样将50μL全血加入试管内,避光在室温下保存放置15min;取出试管,每管加10倍的稀释液450μL,混匀。④将试管避光静置10min,待管内液体澄清透亮后在4℃避光,然后使用流式细胞仪(深圳市默赛尔生物医学科技发展有限公司,迈瑞BriCyte E6P)测定。
1.3统计学方法:采用SPSS20.0统计软件对数据进行分析,计量数据比较采用独立样本t检验,计数数据用构成比表示,进行χ2检验,相关性使用Spreaman等级相关性分析法,用受试者工作特征曲线(receiver operating characteristic curve,ROC)、曲线下面积(Area under the Curve,AUC)、灵敏度、特异度分析各因子对MM合并IFI患者DS分期和预后的诊断及预测价值,检验水准α=0.05。
2 结 果
2.1MM合并IFI患者LMR、CD3+、CD19+和CD16+56+水平的表达:观察组患者外周血LMR和CD19+、CD16+56+较对照组均降低,且CD3+较对照组升高,差异具有统计学意义(P<0.05),见表2。
表2 MM合并IFI患者LMR CD3+ CD19+和CD16+56+水平的表达
2.2DS不同分期MM合并IFI患者血清LMR、CD3+、CD19+和CD16+56+水平的表达:DS分期Ⅲ期患者LMR和CD19+、CD16+56+均较Ⅰ~Ⅱ期降低,CD3+显著高于Ⅰ~Ⅱ期,差异有统计学意义(P<0.05),见表3。
表3 Ⅰ~Ⅱ期与Ⅲ期MM合并IFI患者LMR CD3+ CD19+和CD16+56+水平表达
2.3外周血LMR、CD3+、CD19+和CD16+56+水平与MM合并IFI患者DS分期的关系:运用Speraman等级相关性分析方法,结果显示:外周血LMR、CD19+和CD16+56+水平与MM合并IFI患者DS分期呈负相关(rs=-0.686、-0.659、-0.661,P<0.01),CD3+与DS分期呈正相关(rs=0.551,P<0.01)。
2.4外周血LMR、CD3+、CD19+和CD16+56+水平对MM合并IFI患者DS分期的诊断价值:经过ROC曲线分析,外周血LMR、CD3+、CD19+和CD16+56+水平指导MM合并IFI患者DSⅠ~Ⅱ与Ⅲ期的分期均有较高效能,LMR≤6.14时诊断MM合并IFI患者DS分期为Ⅲ期的效能最高,敏感度和特异度分别为91.53%和89.13%。见表4和图1。
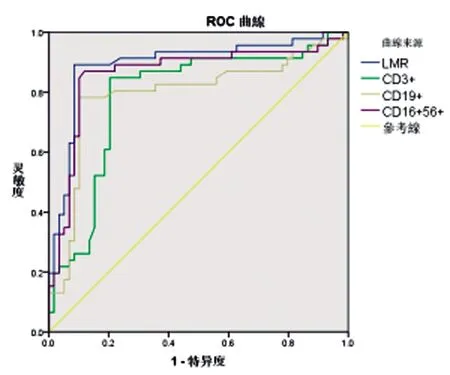
图1 外周血LMR、CD3+、CD19+和CD16+56+水平指导MM合并IFI患者DSⅠ~Ⅱ期与Ⅲ期的ROC曲线图
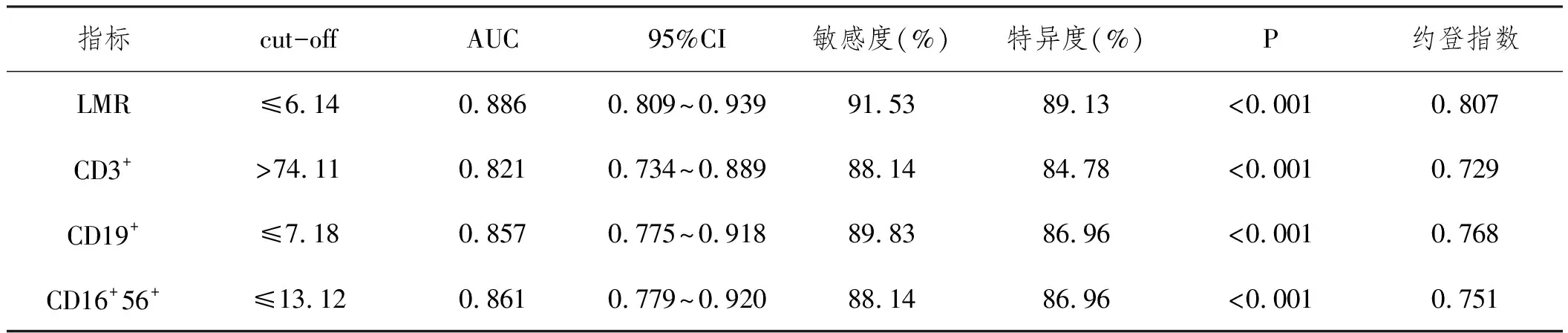
表4 LMR CD3+ CD19+和CD16+56+水平指导MM合并IFI患者DS的ROC分析
2.5MM合并IFI生存组和死亡组患者外周血LMR、CD3+、CD19+和CD16+56+水平表达:死亡患者外周血LMR、CD19+和CD16+56+水平均低于存活组,CD3+水平高于存活组,差异具有统计学意义(P<0.05),见表5。
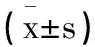
表5 MM合并IFI生存与死亡组患者外周血LMR CD3+ CD19+和CD16+56+水平表达比较
2.6外周血LMR、CD3+、CD19+和CD16+56+水平对MM合并IFI患者结局的预测价值:经过ROC曲线分析,外周血LMR、CD3+、CD19+和CD16+56+水平指导MM合并IFI患者预后均有较高效能,LMR≤4.02时预测MM合并IFI患者死亡的效能较高,其敏感度和特异度分别为79.56%和88.42%。见表6和图2。
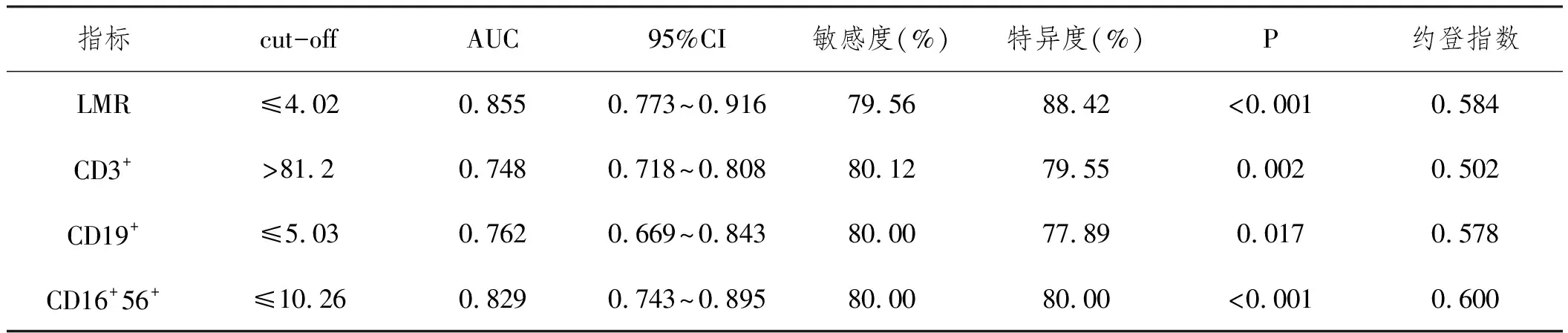
表6 LMR CD3+ CD19+和CD16+56+水平指导MM合并IFI患者预后的ROC分析
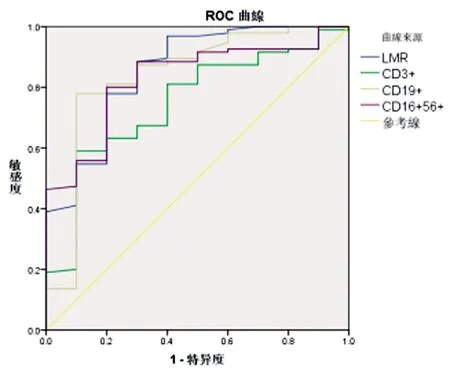
图2 外周血LMR、CD3+、CD19+和CD16+56+水平指导MM合并IFI患者生存与死亡预后评估的ROC曲线图
3 讨 论
MM属于一种浆细胞恶性增殖性的血液系统疾病,患者的体液免疫功能和细胞免疫功能均会受到影响,容易导致支气管、肺部等部位遭受真菌的侵袭,而出现气道黏膜炎症、坏死性肺炎等,严重影响患者的预后[7]。MM合并IFI患者病情进展迅速,早期及时诊治可以有效改善患者的预后,延缓疾病进展,延长患者的生存时间。国外研究[8]发现MM患者在疾病进展过程中体内免疫系统存在缺陷,其中主要包括淋巴细胞、单核细胞以及淋巴细胞亚群中T淋巴细胞、B淋巴细胞和NK淋巴细胞等的功能缺陷或数量异常。据蒙沙等[9]人的研究也证实低外周血淋巴细胞和低LMR是MM患者预后不良的独立危险因素。在既往研究基础上,本研究分析了MM合并IFI患者外周血LMR和淋巴细胞亚群水平的变化,而且明确了上述因子与MM合并IFI患者DS分期进展的关系,能够在早期指导患者病情的判断,从而指导临床治疗改善预后。
本研究数据显示,观察组患者外周血LMR和CD19+较对照组均显著降低,且CD3+和CD16+56+均较对照组显著升高,说明LMR和T淋巴细胞、B淋巴细胞以及NK淋巴细胞参与了疾病的发生和进展。分析原因为LMR作为淋巴细胞和单核细胞的比值,能够反映患者免疫功能受损和障碍的程度,据袁茂林等[10]的研究报道已经证实患者病情进展与肿瘤免疫微环境关系密切,而且LMR也被发现与乳腺癌患者的临床分期和转移有关,这与本研究的方向一致,但本研究明确了MM合并IFI患者外周血LMR较正常健康人水平明显降低;T淋巴细胞、B淋巴细胞属于特异性免疫细胞,而NK淋巴细胞和树突细胞等为固有免疫细胞,肿瘤患者体内的抗肿瘤免疫应答主要是由T淋巴细胞进行介导从而维持机体免疫稳定;而B淋巴细胞可以通过中和、调理和激活补体的方式介导机体的体液免疫应答,其还可以给淋巴T细胞加工提供可溶性抗原。而活化的B细胞能够分泌多种细胞因子调节机体免疫功能,CD56作为来源于造血干细胞NK淋巴细胞的表面标志物,其可以直接杀伤肿瘤细胞和已经被感染的细胞,当MM发生且集体感染严重时外周血NK细胞基数下降。因此,MM合并IFI患者存在体液免疫功能低下和免疫调节功能障碍,外周血LMR和CD19+、CD16+56+显著降低,且CD3+升高。
上述研究数据还显示,MM合并IFI患者DS分期重度患者的LMR和CD19+、CD16+56+均低于轻中度组,CD3+高于对照组,而且LMR和CD19+、CD16+56+水平与MM合并IFI患者DS分期呈负相关,CD3+与DS分期呈正相关,说明LMR和淋巴细胞亚群与MM合并IFI患者疾病进展密切相关。分析原因为淋巴细胞对于宿主抗肿瘤和抗感染的防御有重要作用,淋巴细胞计数降低的患者可能使得对恶性肿瘤的免疫反应减弱从而加快肿瘤细胞的增殖,加重疾病进展。桂前乐等[11]关于肿瘤相关性巨噬细胞在MM中的浸润及其临床意义的研究中提出,骨髓微环境中的单核细胞能够抑制宿主抗肿瘤的免疫力和促进肿瘤血管的生成,而且分化成的肿瘤相关巨噬细胞(Tumor Associated Macrophages,TAM)可以通过支持血管的生成以促进肿瘤生长而且还能通过诱导免疫抑制保护肿瘤细胞免于凋亡,骨髓微环境中的TAM与MM的发生、发展密切相关。因此当淋巴细胞低表达且单核细胞增多时,LMR值降低并且反映宿主抑制肿瘤的功能降低,进而加重MM合并IFI患者疾病进展,使患者预后不良。淋巴细胞根据细胞表面分化群可以分为CD3+T淋巴细胞、CD19+B淋巴细胞以及CD16+56+NK淋巴细胞等,而CD3+又可分为CD4+辅助/诱导T细胞和CD3+CD8+T即CD8+抑制、杀伤T细胞(即Th细胞、Ts细胞),上述淋巴细胞亚群相互协作相互制约从而实现机体免疫应答机制,维持机体免疫平衡。袁中健等[12]的研究显示,MM患者体内抗肿瘤免疫应答主要由T细胞发挥作用,其中CD3+中Th细胞是免疫应答中的主要反应细胞,Th相关细胞因子的异常表达参与了MM的发生发展,这也说明了CD3+的升高与MM的进展关系密切,这与本研究中CD3+与DS分期呈正相关结果一致。而CD8+T细胞是由抑制性T细胞和细胞毒性T细胞组成,然后对靶细胞产生毒性作用,因此,CD3+的升高反映T细胞的抗肿瘤免疫功能受到抑制,从而减轻了其对骨髓中浆细胞的抑制作用,导致浆细胞的进一步增殖加重病情。活化的B细胞可以分泌多种因子调节机体免疫,本研究中MM患者CD19+水平降低,说明随着DS分期的加重,患者体液免疫功能进一步受到抑制,这与既往研究证实的B淋巴细胞通过诱导成熟蛋白-1的水平与MM预后呈负相关的观点一致[13]。NK细胞能够直接杀伤靶细胞从而发挥抗感染、抗肿瘤等作用,其随着DS分期而逐渐降低反应宿主抗肿瘤能力加重患者病情,导致不良预后。
据外周血LMR、CD3+、CD19+和CD16+56+水平指导MM合并IFI患者DS的ROC分析显示,LMR对于指导鉴别MM合并IFI患者DS严重程度和生存与死亡的预后情况的效能更高,说明LMR变化可以用来提示患者病情进展,并指导患者预后情况。分析原因为随着病原菌的进一步侵蚀,淋巴细胞的耗竭会引起宿主免疫功能的持续下降,造成感染病原体无法及时清除造成机体免疫受损,而且淋巴细胞对于抗肿瘤和抗感染的作用十分重要,其水平一旦降低,便有利于肿瘤细胞的增殖;单核细胞分化而来的TAM可以改变肿瘤微环境同时释放多种促血管生成细胞因子等进一步促进肿瘤的浸润、转移和生长造成免疫抑制等,而且,王毅均等[14]研究表明TAM是判断结直肠癌患者预后重要指标,高TAM浸润的患者预后较差,这与本研究的方向一致。所以作为淋巴细胞与单核细胞比值的LMR对于机体免疫功能和疾病进展具有明显的指导价值,另外,Chen XQ等[15]的研究提出诊断时LMR升高的患者无进展生存期和总生存期更长,认为LMR比单纯比较淋巴细胞和单核细胞能更好的反应预后,这也与本研究的观点一致。LMR可以同时反应肿瘤微环境以及宿主当前的免疫功能水平,更准确地提示患者的预后信息。本研究数据还显示,MM合并IFI死亡患者外周血LMR、CD19+和CD16+56+水平均显著低于存活组,CD3+水平高于存活组,说明LMR、CD3+、CD19+和CD16+56+水平与患者预后密切相关。分析原因为当具有抗肿瘤作用的淋巴细胞计数降低,而有分泌促肿瘤细胞生长的单核细胞计数增多时会导致LMR降低,随着LMR的进一步下降,宿主抑制肿瘤的功能减弱,加重MM合并IFI患者病情进展;另外,随着T淋巴细胞CD3+的升高、B淋巴细胞CD19+以及NK细胞CD16+56+的降低使得患者免疫功能低下,而且随着真菌的入侵,会导致患者出现肺炎等并发症以及多个器官的损伤乃至死亡,因此,LMR、CD3+、CD19+和CD16+56+水平与患者的预后密切相关。
多发性骨髓瘤合并侵袭性真菌感染患者外周血LMR和CD19+、CD16+56+降低,CD3+升高,其与疾病进展及预后均存在关联,可以指导鉴别MM合并IFI患者的DS分期和预后。

