同步推量加速调强放疗联合化疗治疗局部晚期非小细胞肺癌的前瞻性研究
黄利生,伍方财,林柏翰,许镒洧,李东升,陈洁
1.汕头大学医学院附属肿瘤医院放疗科,广东汕头 515041;2.汕头大学医学院附属肿瘤医院检验科,广东汕头 515041
前言
根据2020年全球癌症研究机构的报告,肺癌已成为我国发生率和死亡率占首位的癌种[1];高达30%~40% 的非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)患者在初诊时已达到Ⅲ期[2]。因为局部晚期NSCLC 无法手术切除,尽管近年来靶向治疗和免疫治疗明显改善了部分患者的生存,但同期放化疗仍然是标准治疗模式,标准的放疗剂量为60 Gy/30 F[3],然而该剂量下局部失败率仍高达85%,5年生存率只有15%~20%[4]。既往有多个Ⅱ/Ⅲ期研究表明通过提高放疗总剂量或者缩短放疗时间可提高NSCLC 放疗的效果[5]。然而RTOG 0617 研究提示高剂量组的中位生存时间、总生存时间均少于标准剂量组,该研究中高剂量组死亡率高、毒性大、局控率下降,这与既往研究不符[6]。Cox[7]在RTOG 0617 结果公布后就发表评论指出该研究采用调强放疗(Intensity-Modulated Radiotherapy, IMRT)技术比例过小、对靶区剂量要求过严、毒性反应过大,这可能对结果造成负面影响。
通过现代放疗技术控制心脏、肺等正常器官组织的受照射量,高剂量放疗是否能带来获益?基于此,本研究开展了小样本的Ⅱ期前瞻性研究,使用同步推量加速调强放疗技术(Simultaneous Modulated Accelerated Radiotherapy,SMART),联合化疗将局部晚期NSCLC 原发灶放疗剂量提高到69 Gy,转移淋巴结剂量提高到64 Gy,评估方案的可行性,观察治疗相关近期毒性反应,分析其客观缓解率(Overall Response Rate, ORR)、生存期(Overall Survival, OS)和无进展生存期(Progression-Free Survival,PFS)。
1 对象与方法
1.1 病例选择及一般资料
选取2016年9月至2019年9月汕头大学医学院附属肿瘤医院放疗科新诊断Ⅲ期不可切除的NSCLC患者48 例,平均年龄59.2(38.0~69.0)岁,ECOG 评分为0~2 分,临床特征见表1。本研究经医院伦理委员会审查并批准;治疗前均取得患者同意并签署知情同意书;项目在中国临床试验注册中心注册(注册号ChiCTR-OPC-15006113)。

表1 患者临床特征Table 1 Clinical characteristics of patients
1.2 治疗方法
全组病例采用同步放化疗方案,放疗方式采用SMART,联合紫杉醇和卡铂化疗。
(1)靶区勾画。大体肿瘤体积(Gross Tumor Volume,GTV)根据肺窗中肺内肿瘤所见的范围以及纵隔窗中显示的纵隔受累淋巴结(淋巴结短径≥1 cm,或经PET/CT 诊断)进行勾画;临床靶区体积(Clinical Target Volume,CTV)由GTV 轴面外扩6~8 mm,上下两个方向外扩10~20 mm 而形成;计划靶区体积(Planning Target Volume, PTV)包括PTV1(原发灶)和PTV2(转移淋巴结),为GTV 轴面外扩5 mm,上下两个方向外扩10 mm形成;PTV3为CTV轴面外扩5 mm,上下两个方向外扩10 mm而形成。
(2)放疗计划的制定和优化。PTV1 处方剂量为69 Gy,2.3 Gy/F;PTV2 为64 Gy,2.13 Gy/F;PTV3 为60 Gy,2.0 Gy/F,每天1次,每周5次,共6周完成。要求95%PTV体积接受>100%的处方剂量照射。
(3)主要危及器官的剂量限制。参考NSCLC 的NCCN 指南[8-9]中对放疗计划危及器官的剂量限制和汕头大学医学院附属肿瘤医院食管癌团队SMART的实践经验[10]对危及器官进行剂量限制。脊髓Dmax<45 Gy;心脏V40<100%、V45<67%、V50<33%;双肺V20<30%、V10<50%、V5<60%;食管Dmax<62 Gy、Dmean<34 Gy。治疗计划完成后需经放疗副主任医师以上审核及验证后才能开始治疗。
(4)同期化疗方案:紫杉醇(45 mg/m²,每周1次)+卡铂(AUC=2,每周1 次)。放疗第1、8、15、22、29和36天使用。
(5)巩固化疗方案。同步放化疗后接受2 周期紫杉醇(200 mg/m²)+卡铂(AUC=6)巩固化疗,放疗完成后3周开始,每3周重复。
1.3 近期疗效判定和急性毒性反应评价
治疗结束后3个月进行近期疗效判定,根据实体瘤疗效评价标准(RECIST 1.1)评估近期放化疗效果[11],包括完全缓解(Complete Response, CR)、部分缓解(Partial Response, PR)、疾病进展(Progressive Disease,PD)和疾病稳定(Stable Disease,SD)。本研究的急性毒性反应主要包括血液毒性、放射性食管炎、放射性肺炎和心脏毒性,评价标准参照世界卫生组织化疗不良反应分级标准和RTOG 急性放射性损伤分级标准[12]。
1.4 随访
采用门诊记录、电话回访和微信等方式,要求患者3年内每3个月门诊复查1次,3年以上每半年门诊复查1 次,期间有不适可以通过线上联系。随访至2021年9月30日,复诊内容主要包括临床症状、体格检查、血液学检查和胸腹部CT 检查,必要时头颅磁共振、骨扫描和全身PET-CT检查。
1.5 统计学方法
采用SPSS 25.0进行统计学分析。计量资料用均数±标准差表示;计数资料用百分率(%)表示。采用Kaplan-Meier 法计算中位生存时间、1年和2年生存率,检验水准设定为α=0.05。
2 结果
2.1 剂量学分析
靶区和危及器官的剂量学参数如表2所示。靶区剂量满足了不同梯度的处方剂量要求;同时,危及器官如双肺、心脏、脊髓和食管的受照射剂量也得到了较好的限制。
表2 靶区和危及器官的剂量学参数(± s)Table 2 Dosimetric parameters of target areas and organs-at-risk(Mean±SD)

表2 靶区和危及器官的剂量学参数(± s)Table 2 Dosimetric parameters of target areas and organs-at-risk(Mean±SD)
研究中PTV3包括了PTV1,因而两者的D5接近
靶区PTV1危及器官双肺PTV2参数Dmean/Gy D99/Gy D95/Gy D5/Gy Dmean/Gy D99/Gy D95/Gy D5/Gy Dmean/Gy D99/Gy D95/Gy D5/Gy 70.3±2.4 67.5±1.2 67.4±1.6 71.8±2.3 66.5±2.1 62.1±2.3 64.3±1.4 68.3±2.3 64.5±3.1 57.4±3.1 60.2±1.5 71.0±2.1心脏PTV3脊髓食管参数Dmean/Gy V5/%V10/%V20/%V30/%Dmean/Gy V30/%V40/%Dmean/Gy Dmax/Gy Dmean/Gy Dmax/Gy 14.8±9.4 51.5±2.2 42.0±5.5 25.2±2.3 15.7±0.8 10.2±11.4 12.1±5.2 8.4±2.6 37.6±3.3 40.2±2.3 45.3±4.2 63.0±1.6
2.2 近期疗效和不良反应
48 例患者均完成同步放化疗,其中,26 例(54.2%)接受2 程巩固化疗,8 例(16.7%)接受1 程巩固化疗,14 例(29.2%)未接受巩固化疗。未出现放疗相关的死亡病例,3 级以上放射性食管炎和放射性肺炎经抗生素和激素治疗后好转,所有患者均未出现急性心脏毒性(表3)。
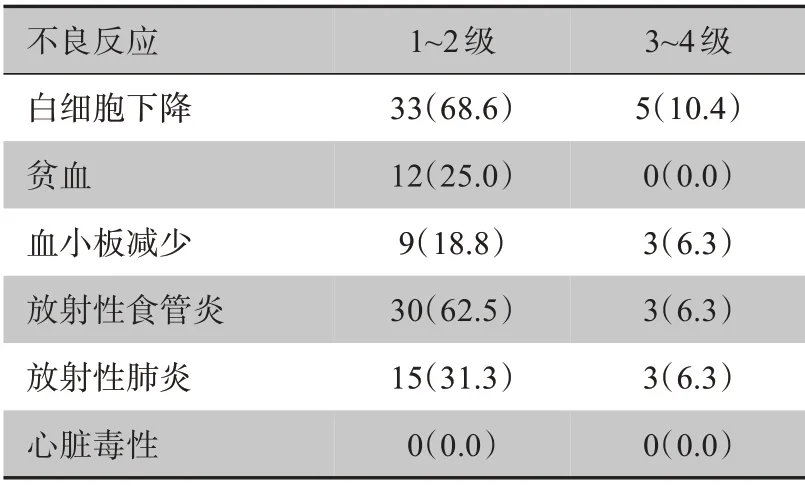
表3 不良反应发生率[例(%)]Table 3 Incidence rate of adverse reactions[cases(%)]
2.3 生存分析
截止至2021年9月30日,19 例患者存活,28 例死亡,1 例失访。ORR(CR+PR)为72.9%,中位OS 为22.0 个月,中位PFS 为17.0 个月,1年生存率为78.7%,2年生存率45.8%。生存曲线见图1。

图1 生存率和无进展生存率Figure 1 Overall survival rate and progression-free survival rate
3 讨论
RTOG 0617 研究结果显示高剂量放疗反而劣于标准剂量放疗,其原因可能是放疗剂量的提高增加了毒性反应,而且该研究中50%以上病例采用三维适形技术,采用IMRT 技术的病例只有45%,这很可能是高剂量组毒性反应高的原因;另外,高剂量组长于标准剂量组的疗程也可能影响了疗效。本研究采用SMART 技术,从靶区和危及器官剂量学分布来看,SMART 在提高治疗靶区剂量的同时也限制了危及器官的受照射剂量;放疗疗程并未延长,能在标准治疗时间内完成放化疗;急性毒性反应多为1~2级,3级以上毒性反应发生率较低,且经治疗后能缓解,耐受性良好,并没有出现RTOG 0617 研究中严重的心脏和肺部毒性,这体现了SMART技术的优势。
在疗效方面,48 例患者ORR 为72.9%,1年生存率为78.7%,中位OS 为22.0 个月,中位PFS 为17.0 个月。本研究1年生存率和中位OS接近RTOG 0617研究中标准剂量(60 Gy)组(78.7%vs81.0%,22.0 个月vs21.7 个月),优于高剂量(74 Gy)组(78.7%vs70.4%,22.0个月vs20.7个月)[6]。虽然本研究为小样本Ⅱ期研究,不能和RTOG 0617 相比较,但也体现了SMART技术治疗NSCLC的有效性。
从放射生物学角度看,NSCLC 对放射线中度敏感,Hayman 等[13]认为对于NSCLC 在常规2 Gy/F 的分割剂量模式下,需要大于84 Gy 的总剂量,才能产生50%以上的肿瘤控制率。RTOG 8311 采用1.2 Gy每天2次的分割方式,将NSCLC的放疗剂量分成5个剂量区间,从60.0 Gy 逐步提高到79.2 Gy,结果显示69.6 Gy 相比60.0 Gy 有明显的生存优势,而更高的74.4 Gy 和79.2 Gy 并没有优势,2年生存率反而低于69.6 Gy[14]。本研究中PGTV(PTV1)的处方剂量为69 Gy/32 F,实际PGTV 的Dmean为(70.3±2.4)Gy,等效生物剂量约为83.9 Gy。参考Hayman 等[13]的研究和RTOG 8311 研究,加速超分割的剂量有可能带来更高的肿瘤控制率。
SMART 的特点是在IMRT 计划设计中同时行肿瘤区同步推量,即原发灶区给予高剂量照射(2.12~2.40 Gy/F)的同时,亚临床灶或其周围扩大区给予较低剂量的照射(1.70~2.10 Gy/F)。SMART 技术是一种加速分割方案,能减少肿瘤克隆源细胞的加速再增殖并提高肿瘤控制率[15];同时明显降低周围正常器官的剂量,减少正常组织器官的急性或远期毒性[16-17]。这一技术也已在头颈部肿瘤中得到广泛应用[18-20]。Dirkx 等[21]在Ⅲ期NSCLC 患者中采用同步加量放疗技术给予化疗前的肿瘤靶区50 Gy,而化疗后的肿瘤靶区70 Gy 的处方剂量,从放射生物学角度推断出同期加量技术可通过缩短总治疗时间,在不增加正常组织放射毒性的前提下提高肿瘤控制率和生存率。徐裕金等[22]的回顾性分析研究显示,SIB-IMRT对局部晚期NSCLC疗效确切,毒性反应可耐受,建议开展随机对照研究以进行进一步探索。巴艳华等[23]采用SMART 技术联合DP 方案(多西他赛+顺铂)同步放化疗治疗局部晚期NSCLC,PGTV处方剂量为69 Gy,结果显示该疗效优于60 Gy,不良反应可接受。以上研究多为回顾性或样本量较小的单臂研究,随着国内先进放疗设备和技术的普及,可进一步进行大样本的前瞻性研究。本研究为前瞻性研究,放疗分割方案和这些研究相似,都是通过同步推量,将原发灶的剂量提高到70 Gy 左右,能在不增加治疗时间和毒性的同时,获得较好的临床效果。
近年来局部晚期NSCLC 的治疗突飞猛进,2021年美国临床肿瘤学会年会上,PACIFIC 研究5年总生存结果显示Ⅲ期NSCLC 患者根治性放化疗后,度伐利尤单抗巩固治疗的5年生存率为42.9%[24],提示放疗和免疫检查点抑制剂良好的协同作用。目前联合治疗的最佳放疗剂量尚不明确,但大分割放疗联合免疫检查点抑制剂巩固治疗是未来趋势之一[25-26]。本研究给予原发灶大分割的放疗,结果显示治疗安全有效,可以提供一定参考;SMART 技术联合免疫检查点抑制剂巩固治疗的策略也值得进一步探索。
采用SMART 技术联合化疗治疗局部晚期NSCLC 疗效确切,耐受性好。本研究为前瞻性小样本研究,主要提供安全性和近期有效率的参考,不足之处在于非随机性、样本量较小、没有对照研究,且随访时间较短,需继续长期随访和进一步进行大样本的随机对照研究。