甲状腺未分化肉瘤1例
王丽珍
患者女性,66岁,3年前检查发现甲状腺双叶结节,期间未行任何治疗,1个月前出现声音嘶哑,喝水呛咳。外院甲状腺彩超示:甲状腺右叶偏强回声团,甲状腺左叶多发结节,TR-RADS 3类,未予对症处理,症状无缓解,为进一步诊治遂就诊于我院。术中探查发现:甲状腺结节性肿大,左叶可触及一大小5 cm×4 cm肿物,质硬,边界不清,右叶可触及一大小1.5 cm×1 cm肿物,质硬,边界不清。全麻下行甲状腺双叶部分切除术,快速病理检查结果提示为恶性肿瘤。
病理检查眼观:左侧甲状腺组织,大小16 cm×5 cm×5 cm,切面灰白色,局部灰黄色,实性,质韧,右侧甲状腺组织,大小8 cm×4 cm×1 cm,切面灰红色,边缘可见灰白区,范围2 cm×1.5 cm,界限不清,质韧。镜检:肿瘤弥漫性生长,无明确包膜,肿瘤组织中可见残留的甲状腺滤泡(图1);肿瘤性坏死明显,细胞呈梭形或多形性,可见核仁,核分裂象易见(图2)。免疫表型:梭形细胞vimentin弥漫阳性(图3),SMA局部弱阳性,CK、CK19、TTF-1、TG(残留甲状腺滤泡阳性),CT、MC、S-100、HMB-45、Melan-A、CD45、CD34、CD68、desmin、Syn均阴性,Ki-67局部增殖指数为70%(图4)。
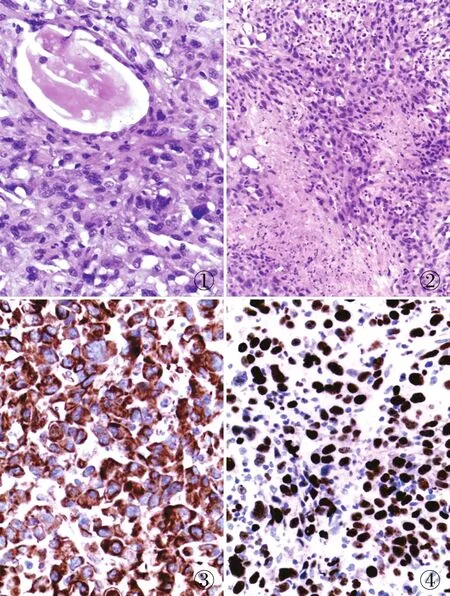
图1 肿瘤弥漫性生长,无明确包膜,肿瘤组织中可见残留的甲状腺滤泡 图2 肿瘤性坏死明显,细胞呈梭形或多形性,可见核仁,核分裂象易见 图3 梭形细胞弥漫表达vimentin,MaxVision法图4 Ki-67局部增殖指数为70%,MaxVision法
病理诊断:双侧甲状腺未分化肉瘤。
讨论甲状腺癌是甲状腺最常见的恶性肿瘤,与甲状腺癌相比,发生于甲状腺的肉瘤非常少见[1],主要包括一些亚型,平滑肌肉瘤、纤维肉瘤、血管肉瘤、脂肪肉瘤、未分化梭形细胞/多形性肉瘤(undiferentiated spindle cell/pleomorphic sarcoma, UPS)等。UPS以往也称为恶性纤维组织细胞瘤(malignant fibrous histiocytoma, MFH),WHO(2013)软组织肿瘤分类废弃了MFH这一命名,并将其归入未分化/未分类肉瘤,这是一组无明确分化方向的异质性肿瘤[2]。UPS由异型梭形细胞和多形性细胞组成,瘤细胞无特异性分化方向,多见于50~70岁中老年人,大多数病因不明,但约25%病例与放疗相关,可发生于机体任何部位,大部分位于深部软组织,发生于甲状腺的UPS罕见报道。
甲状腺UPS与甲状腺癌相似,主要表现为逐渐增大的无痛性肿块,严重者可引起呼吸、吞咽困难和声音嘶哑,无特殊体征及典型的影像学表现,主要需与甲状腺未分化癌、孤立性纤维性肿瘤、恶性神经鞘瘤、黑色素瘤、平滑肌肉瘤、纤维肉瘤等疾病鉴别,还需积极询问病史,全面的体格检查和辅助检查除外以梭形细胞为主的转移性肿瘤的可能。有研究显示,通过超声或CT检查可能有助于鉴别甲状腺癌和肉瘤,但需更多的研究进一步证实[3]。目前普遍认为,诊断UPS主要依靠组织学形态及多组免疫组化标记分析,排除不同分化方向,是一种排除性诊断。本例肿瘤细胞弥漫性生长,梭形细胞形态,异型性明显,核分裂象易见,并见大片肿瘤性坏死,典型恶性肿瘤特征,经免疫组化标记可与上述以梭形细胞为主的甲状腺原发性和转移性肿瘤相鉴别。
UPS具有高度侵袭性,恶性程度高,易发生局部复发和远处转移,预后差。因此,准确的组织学分型可为临床治疗和评估预后提供帮助。目前UPS最主要的治疗方式仍是肿瘤扩大性手术切除。对于肢端的UPS,肿瘤完整切除与否及手术切缘是否干净是影响患者预后的主要因素。而由于头颈部解剖和功能的复杂性,以及肉瘤的高侵袭性,切除足够的边缘较难,因此该部位局部复发的危险性明显高于肢端的UPS[4]。辅助放疗或化疗是治疗肉瘤的另一种手段,尽管一些研究显示在骨或软组织肉瘤中行辅助放疗不能使患者完全收益,但Huber等[5]的一项回顾性研究显示,对于肿瘤直径大于4 cm、组织学分级高、肿瘤靠近切缘或切缘阳性的病例,推荐采用辅助放疗。化疗在UPS中的研究较少,主要见于发生转移的病例,甲状腺UPS的化疗能否可以改善预后,提高生存率还有待进一步研究[6]。本例肿瘤体积较大,虽已扩大手术切除范围,也未发现淋巴结转移及远处转移,但考虑到此肿瘤进展快,复发率高,建议患者继续行进一步治疗。
综上所述,原发性甲状腺UPS是一种罕见的甲状腺恶性肿瘤,易误诊为甲状腺未分化癌,免疫组化标记对于确诊是必要的。该病无任何既定的治疗方法,早期诊断和及时干预对患者预后非常重要。

