乳腺癌转移性胸腔积液14例临床病理学特征及分子分型分析
杨朝晖,林 雅,曹学全,顾华敏,蔡小波,於樱枝,卢洪胜
晚期恶性肿瘤是导致胸腔积液形成的原因之一,常规细胞学涂片阳性率较低。在恶性胸腔积液中可见到多种类型的肿瘤细胞,由于肿瘤细胞具有异质性和相似性,鉴别困难,尤以恶性肿瘤易误诊[1]。晚期乳腺癌胸腔转移病例虽常见,但关于乳腺癌的恶性胸腔积液细胞学形态的报道较少,尚无文献报道乳腺癌胸腔积液基于免疫组化结果的分子分型改变情况,而该现象对临床治疗和预后判断非常重要。本文结合细胞蜡块和临床资料,探讨乳腺癌转移性胸腔积液的细胞学形态、免疫细胞化学特点及分子分型改变。
1 材料与方法
1.1 材料收集2017年11月~2021年4月台州市中心医院(台州学院附属医院)存档的11例和温岭市第一人民医院存档的3例乳腺癌转移性胸腔积液标本。这些标本原发部位的诊断均依据临床资料、影像学和(或)病理检查证实。
1.2 方法使用广州安必平液基细胞沉降式制片染色机,操作步骤严格按试剂盒说明书进行制片,巴氏染色,阅片。取液基制片后剩余胸腔积液放入50 mL离心管中,离心机2 000 r/min离心5 min,弃上清;向沉淀物中加入10%中性福尔马林5 mL,振荡,2 000 r/min离心5 min,弃上清;向沉淀物中加入95%乙醇10 mL,振荡,2 000 r/min离心10 min,弃上清液;将底部沉淀物包于滤纸置入包埋盒中,与常规组织一同行脱水处理,制成细胞蜡块。
1.3 试剂免疫细胞化学染色过程所需单克隆抗体:ER、PR、HER-2、Ki-67、GATA3、p120、CK34βE12、E-cadherin、CK、PCNA、TTF-1、Napsin A、CK7、Villin、CDX-2、CA125、PAX8、AR、P504S、Calretinin和WT-1等鼠抗人单克隆抗体,均购自福州迈新生物公司。具体操作步骤严格按试剂盒说明书进行,用PBS代替一抗作为阴性对照。
1.4 结果判定根据空白、阳性和阴性对照的显色情况,在确定无假阳性和假阴性的前提下,HER-2、p120、CK34βE12、E-cadherin、CK、Napsin A、CK7、Villin、CA125和P504S蛋白表达定位于细胞膜和(或)细胞质,ER、PR、Ki-67、GATA3、PCNA、TTF-1、CDX-2、PAX8、AR、WT-I蛋白表达定位于细胞核,Calretinin蛋白表达定位于细胞核及细胞质,均呈棕黄色颗粒;阳性细胞>10%为阳性。
乳腺癌分子分型采用免疫组化替代分型(2013年St Gallen乳腺癌会议国际共识[2]),即:ER阳性,PR阳性率≥20%,HER-2阴性且Ki-67增殖指数<20%定义为Luminal A型;Luminal B型分两种情况,一种为ER阳性,HER-2阴性,Ki-67增殖指数≥20%或PR阳性率<20%,另一种为ER阳性、HER-2阳性、PR及Ki-67增殖指数任何表达水平;HER-2过表达型定义为ER及PR阴性,HER-2阳性;ER、PR及HER-2均阴性定义为三阴型。
1.5 统计学分析采用SPSS 17.0统计软件进行数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌转移性胸腔积液临床病理学特征及分子分型14例患者年龄44~74岁,平均60.36岁;其中浸润性导管癌Ⅲ级9例(64.3%),浸润性导管癌Ⅱ级3例(21.4%),浸润性小叶癌2例(14.3%);分子分型:2例术后不详,余12例Luminal A型3例(25%),Luminal B型7例(58.4%),三阴型1例(8.3%),HER-2过表达型1例(8.3%)。14例基于胸腔积液的分子分型结果:Luminal A型4例(28.6%),Luminal B型3例(21.4%),三阴型5例(35.7%),HER-2过表达型2例(14.3%);随访期间,生存7例,死亡6例,总生存期10个月~13年,出现胸水至死亡时间均在1年内,失访1例(表1)。
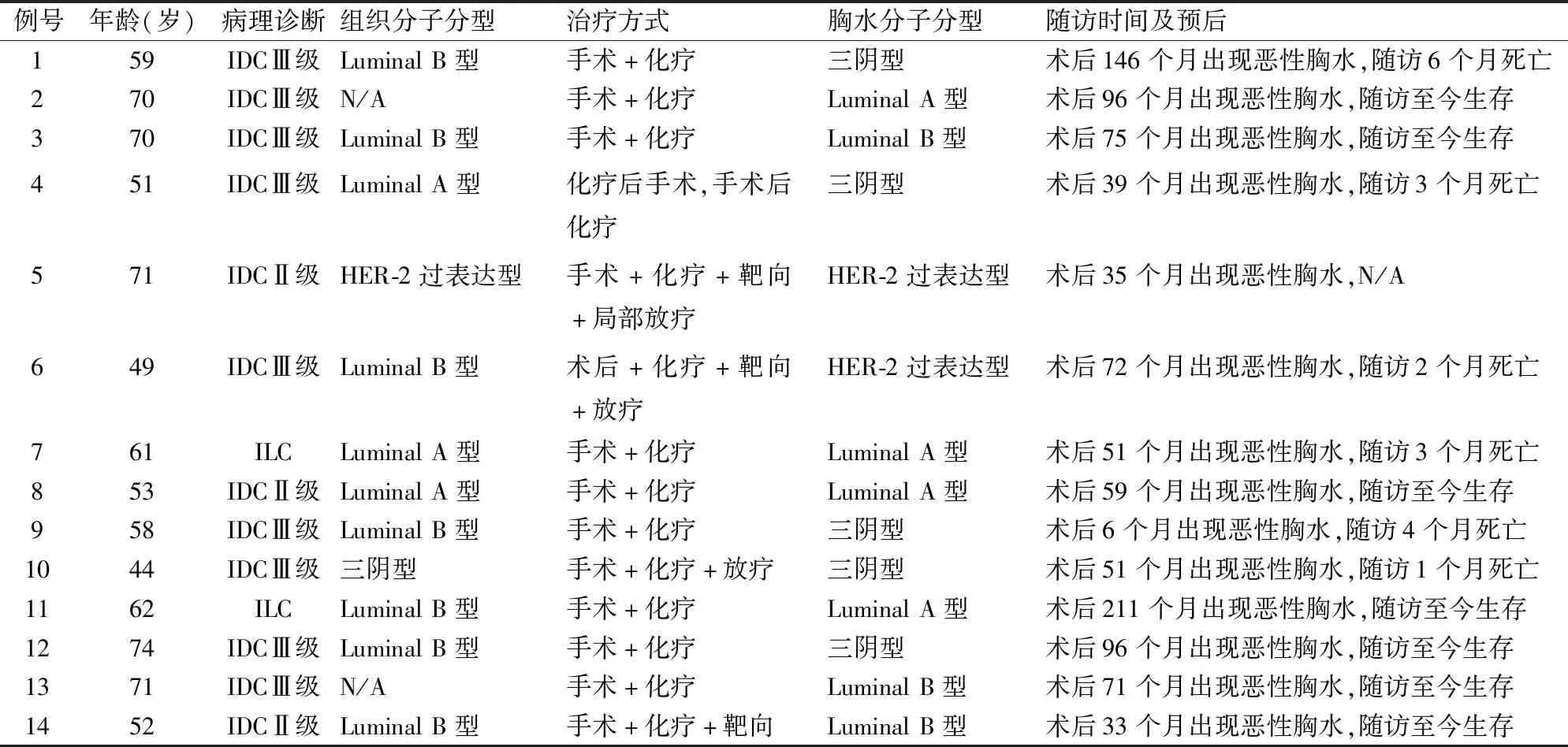
表1 14例胸腔转移乳腺癌临床病理学特征及分子分型
2.2 乳腺癌细胞学特点12例细胞单个或形成不同大小的三维细胞团,圆形、卵圆形或不规则形,可以互相叠加,又称球形或空心球形(图1、2)。免疫细胞化学染色结果:Ki-67、GATA3、p120胞膜(图3)、CK均阳性;ER阳性5例;PR阳性4例。12例对应组织学诊断均为乳腺浸润性导管癌。12例浸润性导管癌中HER-2基因扩增3例,无扩增9例。表型扩增细胞学与组织学免疫组化结果一致。

图1 乳腺浸润性导管癌的液基细胞学涂片,镜下见圆形、卵圆形或不规则形的三维细胞团,巴氏染色 图2 乳腺导管癌的细胞蜡块染色,镜下见球形或空心球形的细胞团,HE染色 图3 乳腺导管癌细胞蜡块p120胞膜阳性,SP法 图4 乳腺浸润性小叶癌的液基细胞学涂片,镜下见单个细胞或单层排列的细胞团,巴氏染色 图5 乳腺浸润性小叶癌的细胞蜡块染色,镜下见单个细胞或小的细胞团,HE染色图6 p120呈细胞质阳性,SP法
2例细胞单个或形成不同大小的细胞团,细胞单层排列,可见核仁(图4、5)。免疫细胞化学染色结果:CK34βE12、p120胞质(图6)、GATA3阳性。2例组织学诊断均为乳腺浸润性小叶癌。免疫组化结果:ER 1例阳性、1例阴性;PR 1例阳性、1例阴性。HER-2基因无扩增。细胞学与组织学免疫组化结果基本一致。
3 讨论
乳腺癌已成为全球女性癌症死亡的主要原因[3],我国乳腺癌已成为威胁女性健康的主要恶性肿瘤。乳腺癌可以通过血行/淋巴和种植转移,如果出现胸腔积液,应考虑是胸膜、肺部转移等造成的。很多恶性肿瘤晚期均可出现胸腔积液,最常见的为肺癌,但出现胸腔积液未必均出现肿瘤转移,即使有肿瘤转移也不一定可以在胸水中找及恶性肿瘤细胞。因此,在胸腔积液中找及恶性肿瘤细胞相对较难,细胞学检测能及时明确诊断,可以指导胸腔灌注化疗或配合放化疗、内分泌治疗及靶向治疗等[4]。
本组14例乳腺癌转移性胸腔积液以浸润性导管癌为主,也可以为浸润性小叶癌,分子分型以Luminal B型为主,随访期间,7例生存,6例死亡,1例失访,总生存期10个月~13年,出现胸水至死亡时间均在1年内,提示伴胸腔积液患者预后较差。有6例胸腔积液的分子分型发生改变,其中3例Luminal B型改成三阴型,1例Luminal A型改成三阴型,1例Luminal B型改成Luminal A型,1例Luminal B型改成HER-2过表达型;进一步分析发现,ER、PR的表达发生明显改变,有6例直接转为阴性,3例表达减弱;HER-2表达未发生改变;Ki-67表达部分增强部分减弱。ER和PR分别是雌激素受体和孕激素受体,其表达与乳腺癌发生及预后有关[5]。HER-2是表皮生长因子受体家族(epithelial growth factor receptor, EGFR)成员,与乳腺癌的侵袭、转移及靶向治疗有关[6],HER-2是乳腺癌的独立预后和预测指标,决定了疾病的侵袭性进程,增加复发的机会、远处转移,并缩短无瘤生存期。HER-2阳性乳腺肿瘤对人源化单克隆抗体赫赛汀治疗亦有反应。病理医师需要报告已知复发或转移性肿瘤患者的HER-2和受体表达状态。这对于确认复发或转移性肿瘤的状态通常是必要的,据报道复发性/转移性乳腺癌与原发肿瘤的受体状态有近36%的差异。Ki-67是一种增殖细胞相关的核抗原,与肿瘤的恶性程度有关[6]。本组病例HER-2检测的一致性较好,但激素受体发生明显改变,这对于临床选择治疗和预后判断具有重要意义,本组5例发生激素受体表达丢失的患者均已死亡,提示激素受体表达转阴者预后更差。
对于胸腔积液免疫表型与原发肿瘤不一致的问题,需要进一步分析可能的原因,以避免不必要的假阳性和假阴性结果,胸腔积液的保存时间、保存温度、保存液的选择等均有可能影响细胞学的制片结果和免疫表型[7-8],正确收集、存储、保存和处理技术的掌握程度对于确保样品的正确处理和成功分析是必不可少的[9]。需要确保细胞蜡块经10%中性福尔马林固定和石蜡包埋,并制作组织对照片[10]。
本组乳腺癌的细胞学特点因组织学类型不同而有所不同。乳腺癌细胞学制片的背景较干净,无炎症细胞。乳腺癌胸腔积液的细胞学形态有两种:(1)细胞单个或形成不同大小的圆形、卵圆形或不规则形的三维细胞团,可以互相叠加,又称球形或空心球形。(2)排列方式为细胞单个或单层排列的细胞团,可见核仁。该排列方式可见于任何一种乳腺癌类型,但对诊断浸润性小叶癌价值更大。p120连环素是catenin家族新成员,与E-cadherin具有特殊的连接性,在细胞黏附、发育和乳腺癌发生中起关键作用[11]。细胞角蛋白CK34βE12与乳腺癌发生及组织学类型相关[12]。CK34βE12阳性提示乳腺癌为浸润性小叶癌。联合检测ER、PR、HER-2、Ki-67、p120及CK34βE12免疫细胞化学染色及病史对诊断恶性胸腔积液乳腺来源及组织学类型非常重要。由于胸腔积液中恶性肿瘤细胞具有异质性和相似性,诊断乳腺癌需与肺腺癌、胃肠道腺癌、卵巢外浆液性癌、恶性间皮瘤等肿瘤进行鉴别[13],可通过特征性的细胞学形态及特异性免疫组化标记进行鉴别。
综上,若肿瘤患者出现胸腔积液,寻找原发部位显得尤为重要。女性患者发现转移性乳腺癌通过形态学特点及免疫组化结果不难诊断,乳腺癌发生胸腔积液一般病理分级较高、预后较差,尤其发生激素受体(ER、PR)转阴的患者,生存时间通常不超过1年。对于乳腺癌胸腔积液分子分型发生改变的标本,需要排除各方面的影响因素进行综合分析,尽可能按照标准化模式制作样本。

