肺原发性滑膜肉瘤5例临床病理分析
冯 宇,倪 皓,童 星,郭凌川
滑膜肉瘤(synovial sarcoma, SS)是临床罕见的恶性肿瘤,主要源于关节、滑膜及腱鞘滑膜的软组织,于1865年由Simon首次报道,占软组织肉瘤的7%~10%[1-2]。肺原发性滑膜肉瘤(primary pulmonary synovial sarcoma, PPSS)更为罕见,临床仅为少数个案报道,约占肺部恶性肿瘤的0.5%,占肺部肉瘤的0.3%~1.3%[3]。PPSS临床特征及影像学表现无明显特异性,且十分罕见,临床极易漏、误诊,诊断PPSS的“金标准”是病理检查和融合基因检测[4]。本文回顾性分析5例PPSS的临床病理学特征、影像学表现、免疫表型和SYT-SSX融合基因,并复习相关文献,荟萃分析SYT-SSX融合基因与术后复发的关系,旨在提高PPSS的认识水平,为其诊疗提供更多的依据。
1 材料与方法
1.1 材料收集苏州大学附属第一医院2011年7月~2019年9月胸外科诊治的5例PPSS患者的临床资料,所有病例均由两名有经验的病理医师重新阅片,分析5例PPSS的临床病理学特征、影像学表现、治疗及预后情况。
1.2 方法
1.2.1免疫组化 5例手术切除标本均经4%多聚甲醛固定,常规取材,脱水,石蜡包埋,切片,HE染色,中性树胶封固等。免疫组化染色采用EnVision两步法,一抗包括SS18-SSX、CK(AE1/AE3)、CD99、BCL-2、vimentin、EMA、TTF-1、TLE-1、CK7、SMA、desmin、S-100及Ki-67等,置于4 ℃冰箱过夜,二抗孵育30 min,DAB显色,常规复染,封片。CK(AE1/AE3)、CD99、CD34、BCL-2、EMA、S-100阳性定位于细胞质/细胞膜,vimentin、desmin、CK7阳性定位于细胞质,SS18-SSX、TTF-1、TLE-1、Ki-67阳性定位于细胞核。
1.2.2FISH 石蜡切片60 ℃烘烤2 h后二甲苯脱蜡,预处理液硫氰酸钠80 ℃处理(12±3) min,蛋白酶K消化10 min,10%中性福尔马林固定10 min后脱水晾干,将SS18基因断裂探针(广州安必平)混合液添加至组织切片杂交区域,再用封片胶固定,原位杂交仪中6 min后37 ℃杂交过夜,荧光显微镜下观察。

2 结果
2.1 临床特征5例PPSS中,男性2例,女性3例,男女比为2 ∶3。年龄14~63岁,中位年龄29岁。临床症状:2例表现为发热、不同程度的胸痛及胸闷等症状;3例无明显症状,体检发现。本组5例患者术前均被误诊为其它肺部良恶性肿瘤或炎性病变,误诊率达100%。
2.2 影像学特征4例CT表现为肺周围型占位,均累及单个肺叶,其中3例位于左侧,1例位于右侧,可见类圆形或团块状软组织密度影,密度不均,增强后可见强化(图1A);1例为肺门中央型占位,病灶边界不清,包绕肺门、纵隔大血管及气管。另外1例CT示巨大类圆形肿块,伴包裹性胸腔积液,肺组织被压缩约90%(图1B)。影像学显示肿瘤最大径为2.1~10.5 cm,病灶平扫平均CT值为(36.6±10.5) HU。
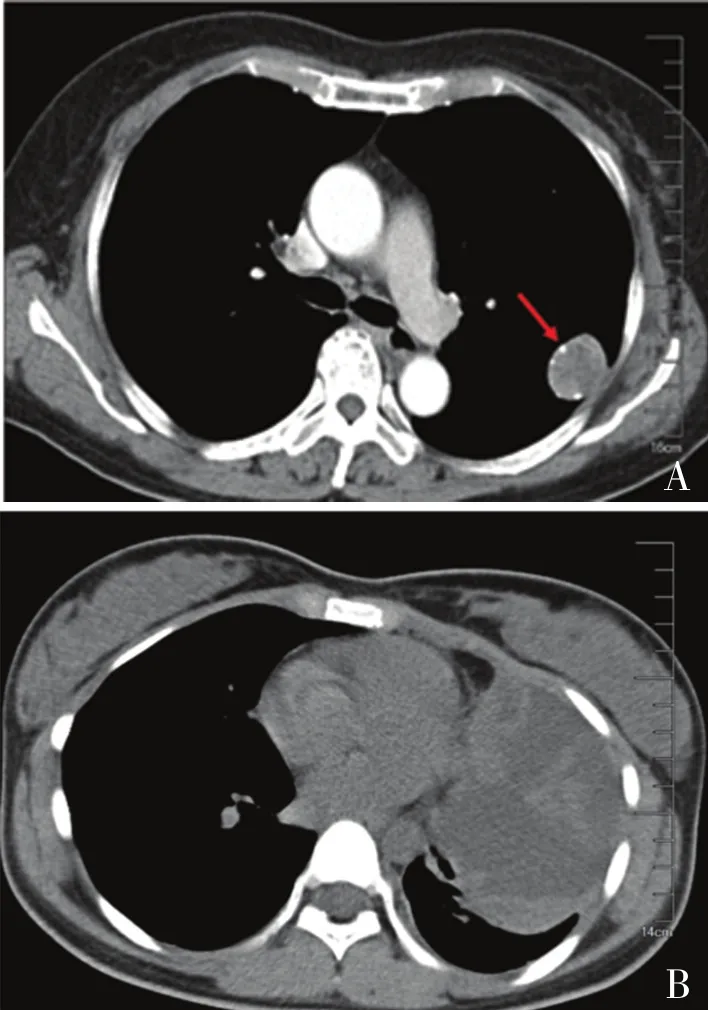
图1 PPSS胸部CT表现:A.类圆形或团块状软组织密度影,密度不均,增强后可见强化(箭头);B.巨大类圆形肿块,伴包裹性胸腔积液,肺组织被压缩约90%
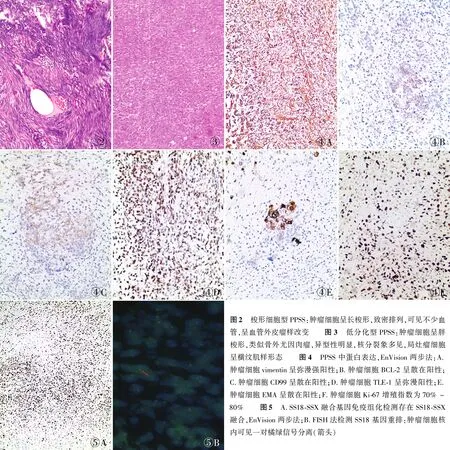
2.3 病理检查眼观:肿块切面灰白色,局灶灰红色,质嫩,无包膜,边界尚清。镜检:4例为梭形细胞型(以往称单相纤维型),肿瘤细胞由纤维母细胞样梭形细胞构成,呈弥漫紧密交织束状排列或漩涡状排列,在梭形细胞间可见多少不等的胶原纤维,局部可见大小不一扩张的裂隙样腔隙,其中1例可见不少血管,并呈血管外皮瘤样改变(图2),瘤细胞胞质丰富,核中等或偏大,可见核仁。核分裂象在不同病例间差异较大。1例为差分化型,由分化差的胖梭形细胞组成,瘤细胞异型性明显,核分裂象易见,局灶见坏死,还可呈横纹肌样形态(图3)。免疫表型:肿瘤细胞vimentin(图4A)、BCL-2(图4B)、CD99(图4C)、TLE-1(图4D)、EMA(图4E)均阳性,2例CD56灶状阳性。Ki-67增殖指数为70%~80%(图4F),CK(AE1/AE3)、CK7、TTF-1、CD34、SMA、S-100等均阴性,SS18-SSX融合特异性抗体呈阳性(图5A)。
2.4 分子遗传学5例PPSS运用SS18基因断裂探针行FISH检测,其中4例检测出SS18基因重排(图5B)。
2.5 治疗5例患者均接受手术治疗,其中行电视辅助胸腔镜术(video-assisted thoracic surgery, VATS)2例,开胸术3例。患者术中术后均无严重并发症,无死亡病例。VATS时间为(2.4±0.85) h,开胸术时间为(2.57±0.15) h,两组差异无统计学意义(P=0.825)。接受VATS患者的术后平均入院时间为(5±2.83)天,行开胸术患者术后平均入院时间为(10.66±4.72)天,两组差异无统计学意义(P=0.192)。
2.6 预后随访期间3例患者死亡,死于全身多处转移;1例患者原位复发,继续随访;1例随访期间暂无复发迹象。
2.7 荟萃分析查阅文献,纳入的7项包含SYT-SSX融合基因与术后复发关系的研究,采用固定效应模型进行计算。结果显示,SYT-SSX融合基因阳性与融合基因阴性的病例相比,术后复发率明显提升(OR=2.47,95%CI:1.54~3.96,P<0.05,图6)。
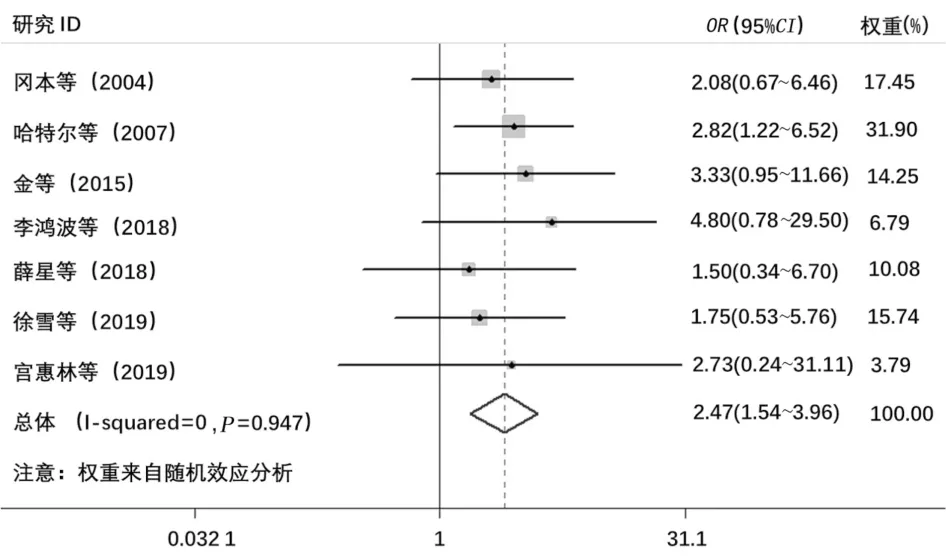
图6 SYT-SSX融合基因与PPSS肿瘤复发的荟萃分析:SYT-SSX融合基因阳性明显提高术后复发的概率,OR=2.47,95%CI:1.54~3.96,P<0.05
3 讨论
PPSS是一种罕见且极具侵袭性的恶性肿瘤,最常见于青少年和年轻成人,男性更易患病,但与抽烟史无关[5]。大多数有症状的PPSS患者主要表现为胸痛、咳嗽、气短、咳血和胸腔积液,临床上仅根据临床症状和影像学表现诊断PPSS难度较大,最终确诊主要依靠病理检查和融合基因检测。
PPSS的CT表现与肺和胸膜其他常见肿瘤的CT表现相似,包括原发性和转移性肺癌、胸膜孤立性纤维瘤、恶性间皮瘤和其他罕见的原发性肺肉瘤,如未分化的多形性肉瘤、平滑肌肉瘤、纤维肉瘤、恶性神经鞘瘤、血管周细胞瘤和肉瘤样癌。主要表现为肺内不均匀实质性团块状影,增强CT可见不均匀强化。生长较慢的肿瘤边缘清楚,圆形或分叶状,表面可由受压的邻近组织形成假包膜,有的肿瘤发生囊性变;生长较快的肿瘤边界不清楚,呈浸润性生长至附近组织。肿瘤常表现为以胸膜为基底的肿块,常伴有患侧胸水,偶尔可发生气胸,肿块内可有钙化。平扫时显示肿块密度不均,内含液化区域,代表坏死或出血[6-7]。本组5例CT表现与上述文献报道相似,其中1例表现为左侧大量液气胸,肺组织被压缩约90%。由于临床医师对该病认识不足,以往易误诊为肺的良性肿瘤或肺癌,术后病理检查和影像学表现可提高PPSS的诊断。
与其他肺肉瘤不同,PPSS在组织学上主要由两种形态不同的细胞组成:上皮样细胞和梭形纤维母细胞样细胞。病理分型为四类:梭形细胞型、双相型、单相上皮型和低分化型。双相型是最常见的类型,被认为是经典类型。上皮样细胞呈立方状或高柱状,细胞核较大,为圆形或椭圆形的囊泡核和丰富的淡染细胞质,可呈嗜伊红色、淡染或透亮状,且具有明显的细胞边界。上皮样细胞可形成实心的绳索或巢式排布,或者形成腺样结构。上皮细胞被梭形纤维母细胞样细胞包围,纺锤形细胞外观均匀,呈梭形或胖梭形;核相对较小,深染,核仁不明显,胞质少而不清晰。在分化较差的病例中,瘤细胞可呈长条束状、鱼骨样或人字形排列,类似纤维肉瘤,在上皮细胞和纺锤形细胞中均出现有丝分裂现象[8]。单相上皮型主要由上皮样细胞组成,对CK和EMA具有免疫阳性,且上皮样细胞呈腺样结构排列,所以很难将其与肺转移癌和原发癌鉴别[9]。低分化型的诊断非常困难,镜下由分化差的小圆形细胞、大圆形细胞和高度恶性的胖梭形细胞组成。在四类亚型中,其病程进展最快,预后最差[10]。
在免疫表型中,PPSS中细胞角蛋白、EMA、BCL-2和vimentin通常阳性,S-100、desmin、SMA和血管肿瘤标志物阴性。梭形细胞型PPSS常见vimentin、CK、EMA、BCL-2等阳性及CD34、S-100阴性。双相型PPSS和梭形细胞型PPSS的梭形细胞CD99、vimentin、BCL-2呈不同程度阳性,部分病例瘤细胞CK(AE1/AE2)或EMA阳性,CD34、desmin、SMA和S-100一般阴性[11]。TLE-1的表达定位于细胞核,在所有组织学类型的SS中阳性率为73%~90%。因其在其他组织中亦表达,如周围神经鞘瘤、孤立性纤维瘤和恶性间皮瘤,所以特异性低。其可与SS中的其他特定标志物联合使用,用于识别角蛋白阴性的SS[12-13]。本组5例PPSS中vimentin、BCL-2、CD99均阳性,2例CD56灶状阳性,Ki-67增殖指数为70%~80%。
PPSS与特异性染色体易位t(X,18)(p11.2;q11.2)相关,该易位涉及SS18(也称为SYT)和SSX1、SSX2或SSX4,>90%的SS中发现了平衡的相互易位。第18号染色体上的SYT基因与X染色体上的SSX1或SSX2基因融合,产生新的融合基因SYT-SSX1或SYT-SSX2[14]。该融合基因在诊断SS中的敏感性和特异度分别为95%和100%,已被广泛应用于SS的诊断。本组5例中4例发生此种易位。目前确认此种基因重排的方法有两种,一种是通过FISH检测SS18基因断裂位点,但其存在非特异性结合,因此,检测效力下降。另一种方式是针对SYT-SSX基因融合位点进行RT-PCR检测,然而这种方法目前并非广泛普及(成本高且耗时久),同时仅针对SYT-SSX1和SYT-SSX2,对于SYT-SSX4等罕见突变则无效。针对这一困境,SYT-SSX融合基因特异性抗体具有极高的敏感性和特异性,可通过免疫组化准确检测到SYT-SSX融合基因的存在[15]。SS18-SSX融合特异性抗体的免疫组化检测还可用于肺转移性SS的鉴别诊断[16]。
手术是治疗PPSS的主要手段,手术切缘是否阴性对预防局部复发至关重要[17]。因PPSS具有较高的侵袭性,发现时通常已处于中晚期,因此,多数病例难以获得满意的手术切缘。药物治疗方面,几种正在研究的新潜在治疗靶标是SS18-SSX融合癌基因、表皮生长因子受体和血管内皮生长因子受体,SS18-SSX衍生的肽疫苗已被尝试作为SS的潜在治疗方法,口服血管内皮生长因子受体抑制剂Pazopanib似乎对平滑肌肉瘤和SS有效[18];已知另一种分子Wnt/β-catenin可以一致地调节SS的发生、发展,为新疗法的开发提出了未来的目标。NY-ESO-1在大多数SS中呈弥漫强阳性,也是潜在的治疗靶点[19]。辅助化疗可以增加患者生存期,但PPSS患者的总体预后较差。PPSS具有较强的侵袭性,5年生存率为50%[20]。不良预后因素包括:肿瘤直径>5 cm、男性、年龄>20岁、广泛的肿瘤坏死、大量的有丝分裂现象(>10/10 HFP)、神经血管浸润和SYT-SSX1变异[19],这与本组的荟萃分析结果一致。除此以外,MDT在PPSS的诊断和治疗中亦扮演着不可或缺的角色,可提高患者的生活质量和预后[21]。
综上所述,临床上PPSS罕见,易发生于年轻成人,恶性程度高,结合CT表现和免疫表型诊断PPSS时,临床医师可以通过FISH检测和SS18-SSX融合基因免疫组化检测来佐证存在SYT-SSX融合基因协助,对于PPSS的标准化治疗还有待深入探究。今后仍需积累更大样本,总结其诊断、治疗、预后及随访,以期提高对其的认识水平。

