经典型骨肉瘤中TIM-3的表达及临床意义
钱云峰,梁恭博,李 静,刘姗姗,王卓才,闫广宁
经典型骨肉瘤(conventional osteosarcoma, COS)是一种高度恶性骨肿瘤,位居原发性骨肉瘤的首位,进展迅速,复发和转移率高,预后差,患者生活质量差[1]。骨肉瘤发生、发展的相关分子机制急需深入探究,为开发新的治疗靶点、预后判断提供参考依据。T淋巴细胞免疫球蛋白黏蛋白-3(T lymphocyte immunoglobulin mucin molecule-3, TIM-3)是一种新的免疫检查点分子,表达于多种免疫细胞[2]。TIM-3作为膜表面抑制性受体,在免疫细胞中主要介导肿瘤免疫抑制。目前,TIM-3在骨肉瘤中的研究鲜有报道[3]。本实验在前期研究的基础上,观察COS中TIM-3蛋白表达,分析其与临床病理学特征的关系及与预后的相关性,以期为免疫治疗及相关研究提供依据。
1 材料与方法
1.1 临床资料收集2007~2016年中国人民解放军南部战区总医院诊治的50例COS。诊断结果由两名资深病理医师再次核对。收集的临床资料和病理特征包括患者性别、年龄、发病部位、切除方式、术前化疗与否、肿瘤最大直径、Ennecking分期及组织学分型等。
1.2 方法标本均经10%中性福尔马林固定,石蜡包埋后常规切片。免疫组化染色采用EnVision法。一抗TIM-3(稀释比1 ∶100,克隆号EPR22241,兔抗人)购自Abcam公司。二抗、抗体稀释剂及DAB显色剂均购自DAKO公司。以PBS缓冲液代替一抗作为阴性对照。实验操作步骤严格按试剂盒说明书进行。
1.3 结果判读TIM-3多数表达于肿瘤浸润性免疫细胞,如淋巴细胞及单核巨噬细胞。细胞膜出现明显棕黄色染色者为阳性,每例切片随机选取10个高倍视野(400×)阳性细胞计数。评分标准:(1)按阳性细胞百分比计分:<3%为0分,3%~25%为1分,26%~50%为2分,>50%为3分;(2)按细胞着色深浅计分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:0~3分为低表达,4~9分为高表达。由两位资深病理医师采用双盲法阅片。
1.4 随访查阅患者门诊、住院记录或进行电话追踪随访。总生存期(overall survival, OS)是指术后第1天至此次肿瘤复发或转移导致的死亡时间,无瘤生存期(disease-free survival, DFS)是指从肿瘤切除后到肿瘤复发或转移的时间。
1.5 统计学分析采用SPSS 25.0软件进行统计学分析。单因素生存分析采用Kaplan-Meier检验法,Log-rank检验生存曲线差异。定性资料的组间分析采用列联表χ2检验或Fisher精确检验。两变量均值比较采用两独立样本t检验。多因素分析采用Cox比例风险模型分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征50例COS患者,男性31例(62%),女性19例(38%);年龄7~68岁,平均24岁,中位年龄20岁;发病部位:股骨29例(58%),胫骨9例(18%),肱骨5例(10%),骨盆3例(6%),腓骨2例(4%),锁骨、骨外各1例(2%);接受新辅助化疗37例(74%),未接受新辅助化疗13例(26%);患者接受肿瘤根治术41例(82%),截肢术9例(18%);Ennecking临床分期:ⅡA期12例(24%),ⅡB期33例(66%),Ⅲ期5例(10%);肿瘤最大径1.4~18 cm,平均8.23 cm;组织学类型:骨母细胞型30例(60%),软骨母细胞型6例(12%),纤维母细胞型14例(28%)。
2.2 TIM-3表达与COS临床病理特征的关系50例COS中TIM-3低表达37例(74%),高表达13例(26%)(图1)。TIM-3高表达组的肿瘤平均直径为10.04 cm,TIM-3低表达组的肿瘤平均直径为7.61 cm,差异有统计学意义(P=0.024)。有完整随访资料的患者中,TIM-3高表达患者肿瘤术后复发比例为53.8%(7/13),低表达患者为22.6%(7/31),差异有统计学意义(P=0.042);TIM-3高表达患者肿瘤转移比例为61.5%(8/13),低表达患者为54.8%(17/31),差异无统计学意义(P=0.682)。TIM-3表达与患者性别、年龄、发病部位、接受新辅助化疗、手术方式、Ennecking分期及组织学分型均无关(表1)。
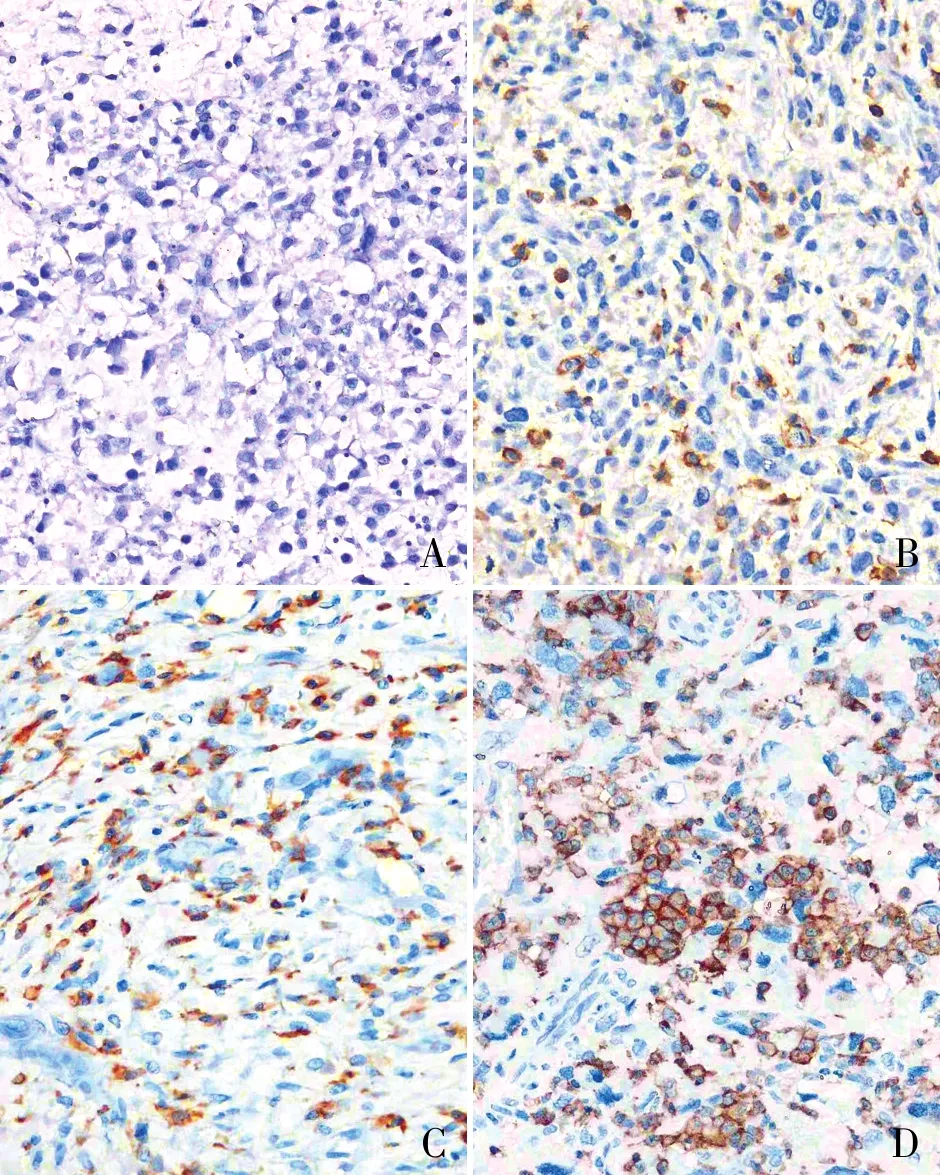
图1 COS中TIM-3的表达,EnVision法:A.阴性;B.弱阳性;C.中等阳性;D.强阳性
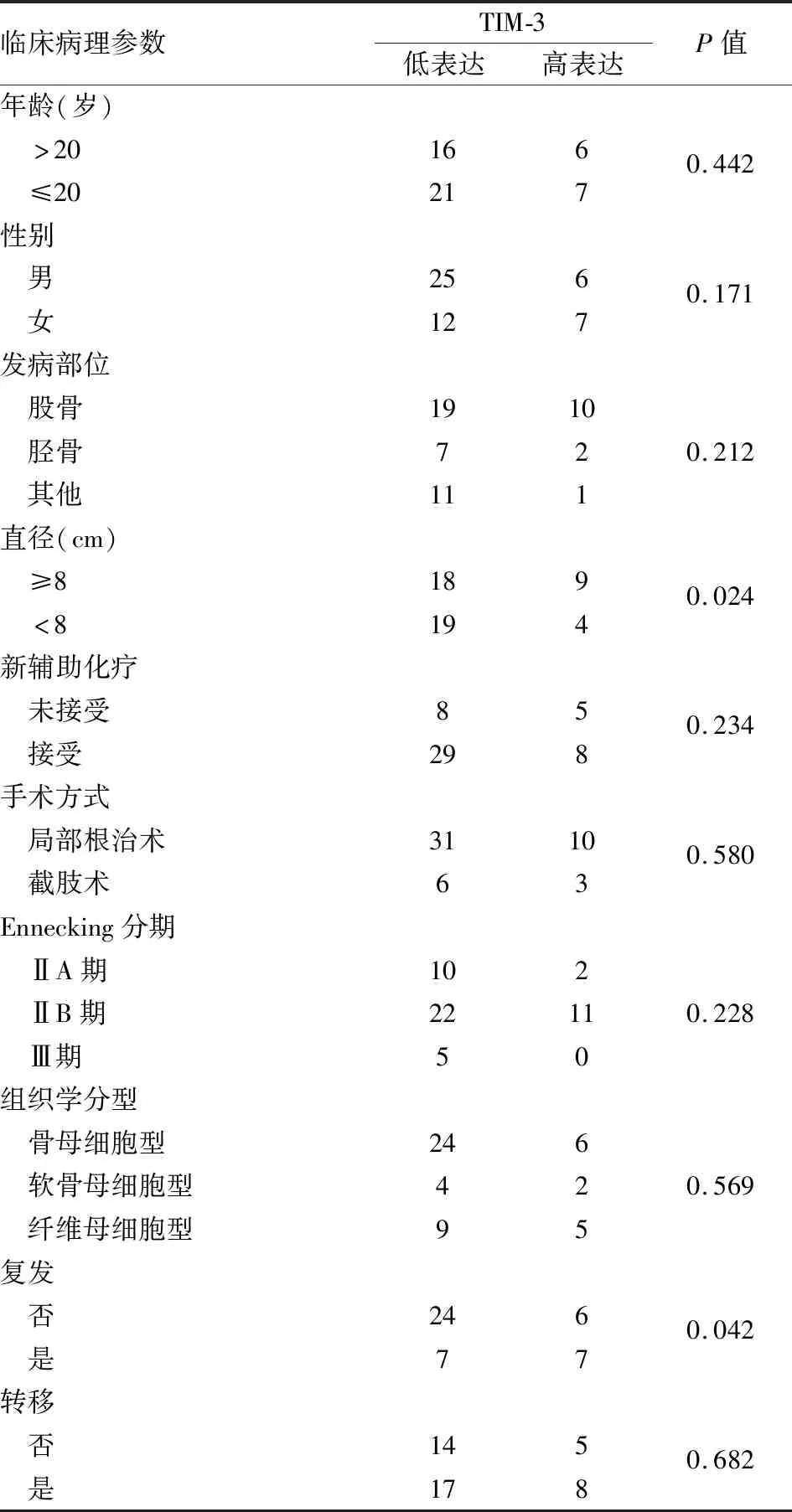
表1 TIM-3表达与COS临床病理特征的关系
2.3 TIM-3表达与COS患者预后的关系50例患者随访13~60个月,中位随访时间为35个月。其中死亡21例,失访6例。Kaplan-Meier生存分析显示,TIM-3低表达和高表达患者病死率分别为37.8%和53.8%,平均OS为38.4个月和38.6个月(P>0.05),平均DFS为28.5个月和28个月(P>0.05),两组相比差异无统计学意义(图2)。Cox多因素分析显示,TIM-3的表达水平不是COS患者OS及DFS的独立影响因素(P>0.05)。
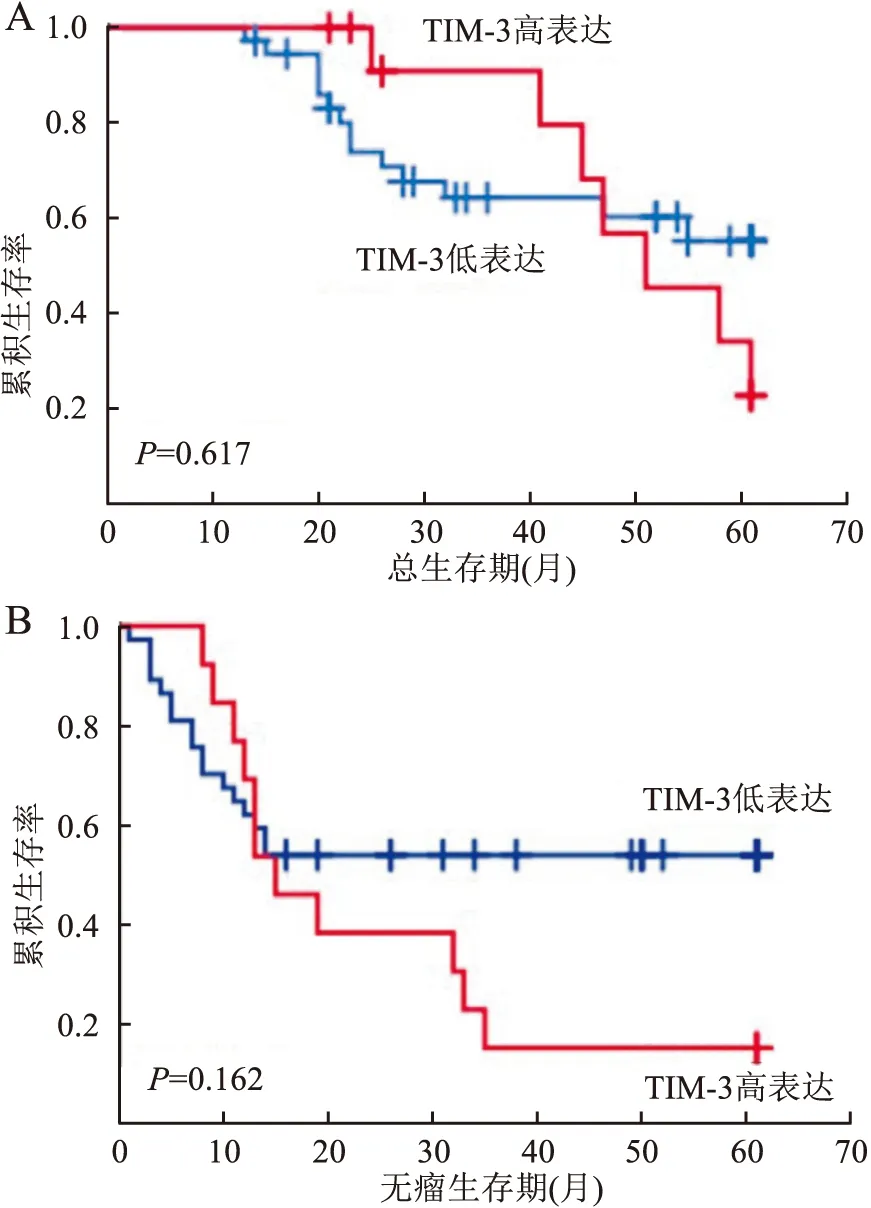
图2 A.TIM-3表达与COS患者OS的关系;B.TIM-3表达与COS患者DFS的关系
3 讨论
COS是青少年常见的原发恶性骨肿瘤,位居青少年恶性肿瘤的第5位[4]。骨肉瘤约占原发骨肿瘤的16%,其中90%为COS,恶性程度高,预后差[5]。近年来随着辅助化疗及手术方式的改善,患者预后有了明显的改善,但患者远期生存率和生活质量仍不理想。COS发病机制复杂,化疗抵抗比例较高,进展快,术后复发转移风险高,患者生活质量差,急需深入研究以寻找更好的治疗方法[6]。
T细胞是抗肿瘤免疫反应过程中的核心参与者,而免疫检查点(immune checkpoints, ICs)是表达于免疫细胞且能调节免疫激活程度的一系列分子(如PD-1/PD-L1、CTLA-4/B7),在维持免疫耐受和机体免疫稳态方面具有重要作用,并负向调控T细胞的抗肿瘤免疫反应[7]。TIM-3属于免疫球蛋白超家族,胞内区含有酪氨酸残基,可与Src家族的磷酸酶相互作用,启动下游信号通路[3]。TIM-3表达见于多种免疫相关细胞及多种肿瘤细胞,常与PD-1分子共同表达于T细胞,是T细胞功能耗竭的重要标志。TIM-3的配体包括半乳凝素-9(Galectin-9)、高迁移率族蛋白1(high mobility group box 1 protein, HMGB1)、癌胚抗原相关细胞黏附分子1(carcino-embryonic antigen related cellular adhesion molecule 1, CEACAM1)等[2]。本课题组前期研制并验证了一组TIM-3单克隆抗体,发现TIM-3蛋白有两种分子量,高分子量的TIM-3表达于肿瘤相关巨噬细胞及T细胞膜[8],为免疫组化检测TIM-3表达提供了良好手段。
在多种恶性肿瘤中发现TIM-3参与调控肿瘤生长。在食管癌中,TIM-3表达与PD-1表达及CD8+的肿瘤浸润淋巴细胞数量呈正相关,TIM-3是患者预后的独立影响因素[9]。在非小细胞肺癌中,TIM-3表达于肿瘤浸润性T淋巴细胞,并与细胞免疫功能相关[10]。TIM-3/Galectin-9参与慢性淋巴细胞白血病患者T细胞的负性调控[11];TIM-3在肝癌中抑制NK细胞功能从而促进肝癌细胞增殖[12-13]。TIM-3可以下调T细胞穿孔素和粒酶B的表达从而降低结肠癌中T细胞的杀伤能力[14]。TIM-3甚至可以通过NF-κB/STAT3通路直接促进乳腺癌的侵袭能力[15]。有关TIM-3在骨肉瘤中的作用研究较少。有研究发现,骨肉瘤中TIM-3阳性T细胞和单核细胞通过结合表达Galectin-9的CD4+/CD25+调节性T细胞进而发挥其免疫抑制作用[16]。骨肉瘤患者血清中可溶性TIM-3量高于良性骨肿瘤及正常骨组织,且血清中TIM-3的表达量与肿瘤体积、组织学分级、临床分期及远处转移均有关,在区分骨肉瘤与良性骨肿瘤和骨组织时有较好的特异性[17]。患者外周血CD4+及CD8+T细胞上TIM-3表达异常升高,且与肿瘤分期、远处转移、病理性骨折以及总生存期相关[18]。TIM-3在骨肉瘤组织中的表达显著高于周围正常组织,TIM-3高表达与患者较短的总生存期有关[19]。TIM-3除了表达于免疫细胞膜,也表达于骨肉瘤细胞和细胞系[20]。骨肉瘤细胞中TIM-3的表达可增强细胞增殖和迁移能力并通过NF-κB通路增强细胞上皮-间质转化[21]。
本实验发现,COS中TIM-3表达水平高低不一。TIM-3高表达组的肿瘤平均直径高于低表达组(P=0.024),提示TIM-3高表达的肿瘤生长速度更快,恶性程度更高,可能与TIM-3抑制肿瘤浸润淋巴细胞的免疫功能有关,也可能与TIM-3对肿瘤细胞的直接作用有关,与以往研究结果一致。TIM-3高表达患者肿瘤术后复发比例明显高于低表达患者(P=0.042),TIM-3高表达患者更易复发,在既往研究中未见相关报道,可能与肿瘤免疫微环境被抑制或TIM-3直接激活肿瘤细胞相关分子通路、激活肿瘤干细胞特性或增强化疗抵抗能力相关。另外,本组结果中TIM-3表达与患者远处转移及生存期无相关性,多因素分析结果未发现TIM-3表达对COS患者预后的独立影响。本组结果中TIM-3对患者预后的影响趋势不明显,可能与纳入样本量有关,也可能与免疫组化检测TIM-3表达的半定量评价相较流式细胞术和酶联免疫吸附法检测TIM-3定量分析不准确有关。后续仍需扩大样本量,更换检测方法进一步验证实验结果。
综上所述,本实验发现COS中TIM-3表达水平与COS的瘤体体积及肿瘤复发风险相关,提示TIM-3对COS的促肿瘤作用。肿瘤免疫检查点抑制剂的研究和应用正在飞速进展,敏感患者的疗效与传统疗法相比,其具有明显优势。骨肉瘤高度恶性,远期生存率低,免疫检查点抑制剂的治疗应用可能为骨肉瘤患者带来临床获益和更好的生存质量。本实验通过探究TIM-3在COS中的表达以及临床病理意义,有望为骨肉瘤免疫治疗研究和靶点选择提供实验依据和思路。

