Silva分型在HPV相关性子宫颈腺癌及原位腺癌中的应用及临床意义
戈文舜,李美平,耿 文,蔡红光,杨惠英,包 磊
子宫颈癌是女性常见的恶性肿瘤,根据2018年GLOBOCAN全球癌症统计报道[1],每年新发病例约57万例,死亡病例达31万,其发病率与病死率均位居女性常见肿瘤的第4位。随着子宫颈癌筛查的积极开展及HPV疫苗的广泛接种,鳞状细胞癌的发病率有所下降,腺癌的检出率却大幅升高(由5%升至25%)[2],且呈年轻化趋势。WHO(2020)女性生殖系统肿瘤分类[3]在HPV相关性子宫颈腺癌(HPV-associated endocervical adenocarcinoma, HPVA)中推荐使用Silva分型体系,此系统根据肿瘤细胞的侵袭模式结合转移的高危因素进行分级,具有更好的预后判断价值。本文回顾性分析78例HPVA及原位腺癌(adenocarcinoma in situ, AIS)患者的临床病理资料,探讨Silva分型模式的应用及临床意义,为患者制定个性化治疗方案提供依据。
1 材料与方法
1.1 临床资料收集2016年1月~2020年12月浙江省绍兴市妇幼保健院存档的78例符合初筛标准的患者,伴或不伴高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL),包括44例AIS、34例HPVA。初筛标准:原病理诊断为AIS或HPVA;完整切除肿瘤,标本为子宫颈锥切、全子宫或子宫颈癌根治标本;记录有完整的临床病理资料,包括肿瘤厚度(指子宫颈黏膜表面至肿瘤浸润最深处的距离)、肿瘤宽度(指肿瘤在子宫颈扩散范围的最大水平距离)、淋巴脉管侵犯、淋巴结转移以及临床分期、术后辅助放化疗及随访情况。根据Silva分型标准重新分类,由3位高年资病理医师复查审核。
1.2 Silva分型标准Silva分型根据肿瘤侵袭特点,分为A、B、C三种亚型(表1)。

表1 Silva分型亚型的病理特征
1.3 随诊术后随诊:2年内每3~4个月随访1次,3~5年每半年随访1次。随诊内容:妇科常规检查、B超、阴道细胞学涂片、HPV检查,必要时行CT及MRI检查。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析。计量资料经正态性检验为非正态分布者以中位数表示,采用Kruskal-WallisH检验。数据资料组间比较采用Fisher精确概率法。P<0.05为差异有统计学意义。
2 结果
2.1 子宫颈AIS及不同Silva型别患者年龄分布本组78例患者年龄28~72岁,平均(44.9±9.2)岁,﹤30岁2例,30~39岁22例,40~49岁29例,50~59岁20例,60~69岁4例,>70岁1例,组间比较差异无统计学意义(χ2=20.5,P=0.066),随着病变侵袭性增强,发病数峰值所处年龄段随之升高(图1)。

图1 子宫颈AIS及不同Silva型别腺癌患者年龄分布图
2.2 子宫颈腺癌及AIS的临床病理特征78例标本经复片审核后仍诊断AIS者37例(47.4%,37/78),41例HPVA(52.6%,41/78)中Silva A型18例(43.9%,18/41,含AIS复片审核后增加的7例)(图2)、B型12例(29.3%,12/41)(图3)、C型11例(26.8%,11/41)(图4)。Silva A、B、C三型组间比较临床分期、淋巴脉管侵犯、淋巴转移、神经侵犯、术后放化疗,差异均有统计学意义(P<0.05);术后并发症组间比较差异无统计学意义(P>0.05,表2)。
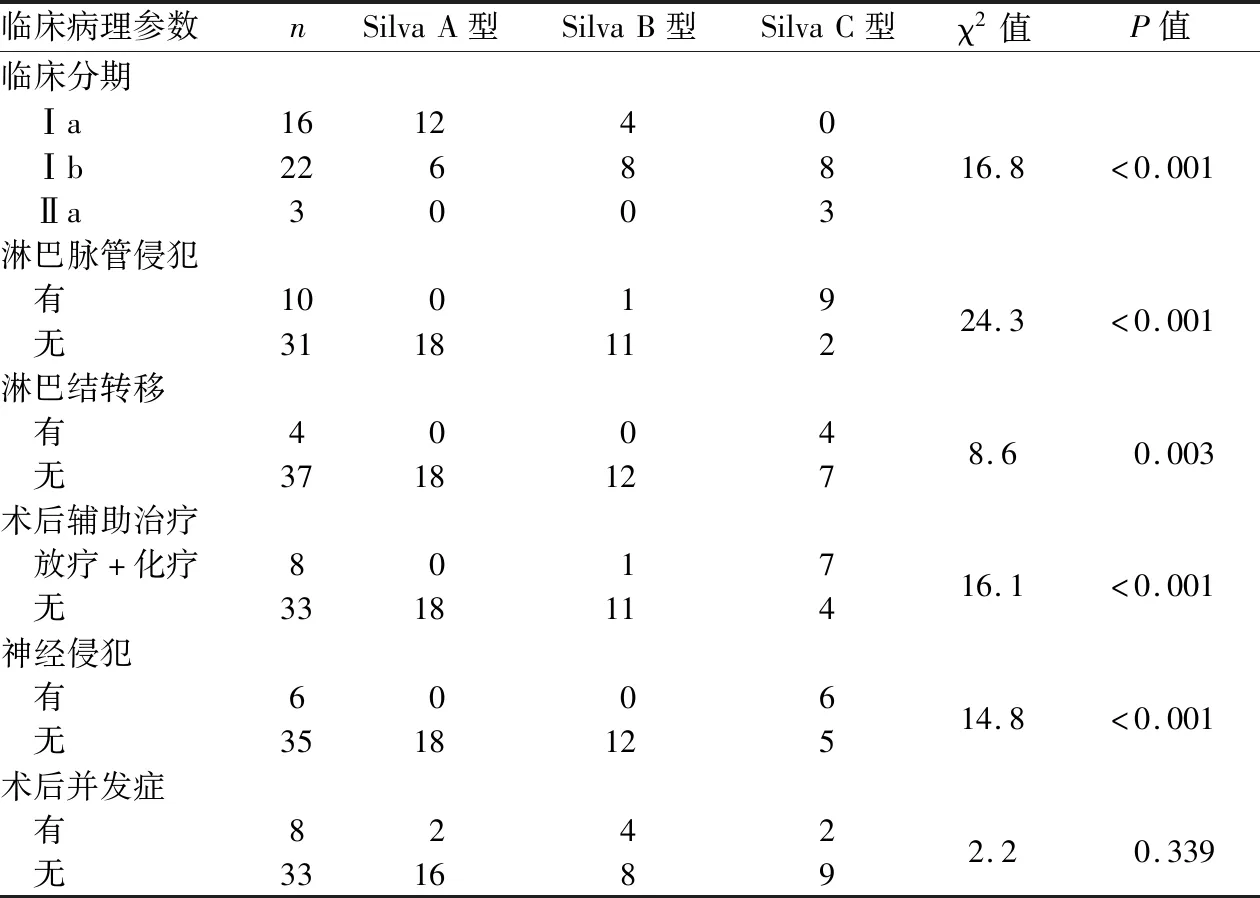
表2 不同Silva型别腺癌患者的临床病理资料
2.3 子宫颈活检、锥切标本与最终诊断的病变符合率活检标本与后续锥切、子宫切除、根治标本的病变总符合率为64.9%(48/74),若活检病理诊断结果为AIS/HSIL、Silva A、Silva B/C,最终诊断符合率分别为68%(34/50)、40%(6/15)、100%(9/9);锥切标本与后续子宫切除、根治标本中病变(包括单纯锥切切缘阴性且随访无复发病例)总符合率为95.1%(58/61),若锥切病理诊断结果为AIS/HSIL、Silva A、Silva B/C,最终诊断符合率分别为97.4%(37/38)、93.3%(14/15)、100%(8/8)(表3)。
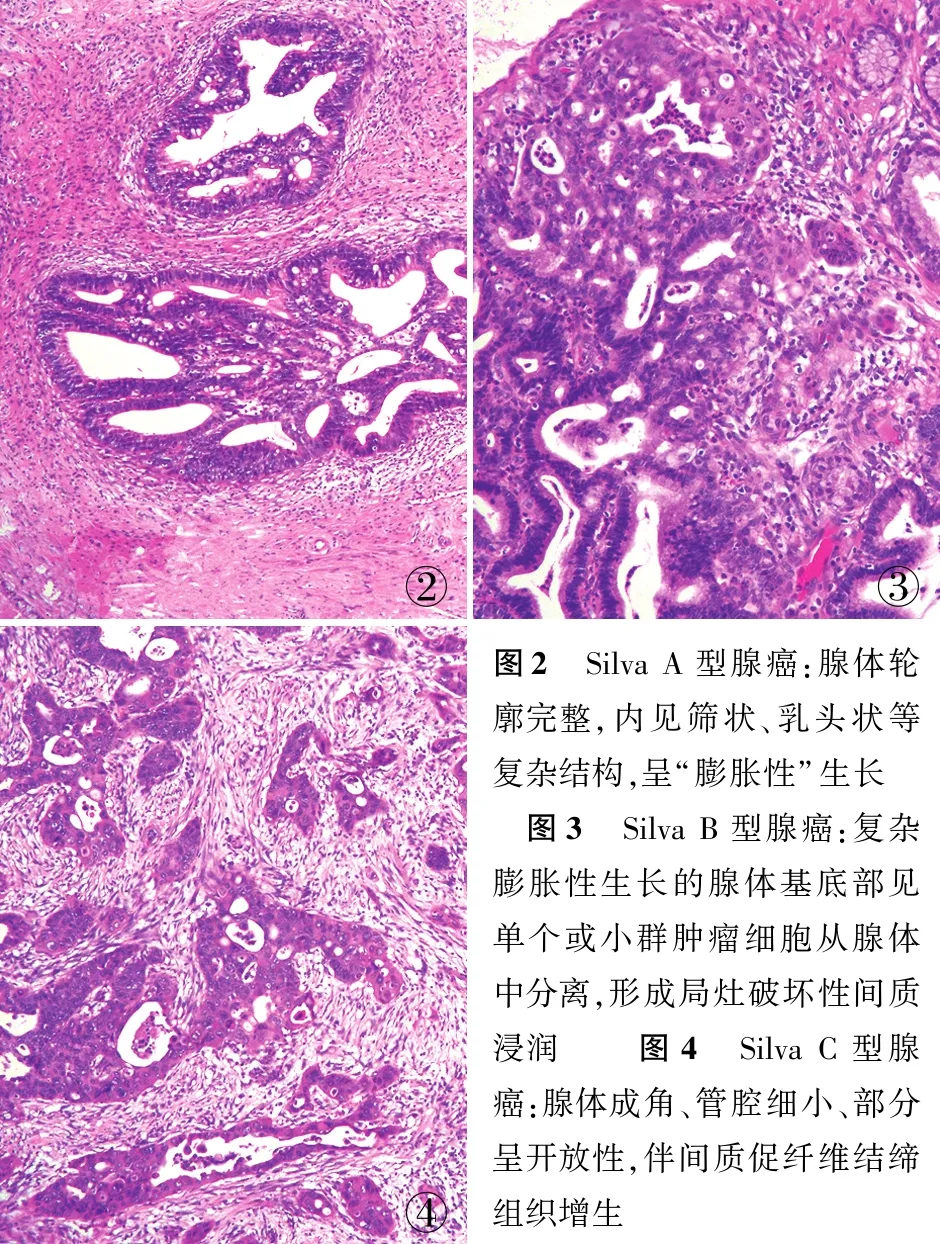

表3 子宫颈活检、锥切标本与最终病理诊断的符合率分析
2.4 不同Silva型别腺癌与病变范围的相关性不同型别腺癌中肿瘤厚度与宽度组间比较[除AIS与Silva A型的肿瘤宽度(H=1.9,P=0.2)、Silva A型与B型的肿瘤厚度和宽度(H=3.2,P=0.07;H=1.59,P=0.21)],差异均有统计学意义(H=41.2、H=23.2,P<0.001);AIS/Silva A与Silva B/C组间肿瘤厚度与宽度比较,差异有统计学意义(H=19.0,H=16.6,P<0.001);不同型别腺癌锥切切缘阴性、阳性组间残留病变数量比较,差异无统计学意义(阴性组:χ2=1.6,P=0.717;阳性组:χ2=1.1,P=0.525,表4、5)。

表4 不同Silva型别腺癌的肿瘤厚度、肿瘤宽度对比分析
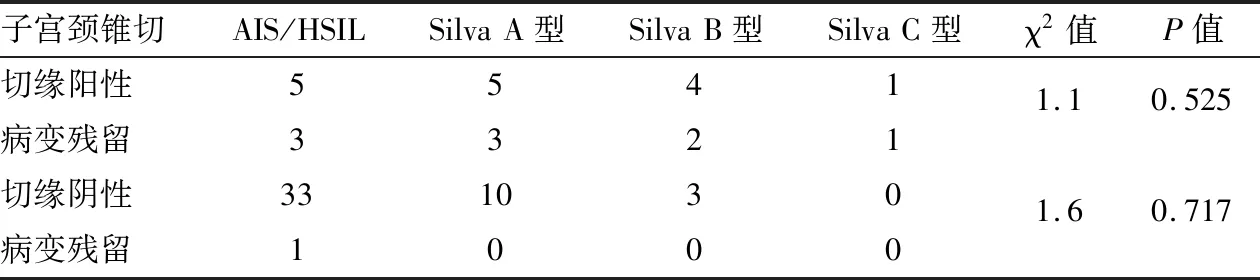
表5 不同Silva型别锥切切缘阴性、阳性组与后续残留病变对比分析
2.5 随访及预后截至2020年12月31日,随访时间2~47个月,中位时间17个月;失访15例(19.2%,15/78)。术后8例伴并发症(10.3%,8/78),6例伴盆腔积液、2例伴排尿困难。AIS、Silva A型、Silva B型、Silva C型随访中位时间分别为16个月(2~47个月)、18.4个月(2~37个月)、16.6个月(2~26个月)、16.6个月(2~26个月),仅1例Silva B型患者术后12个月阴道残端见低级别鳞状上皮病变,余均未见复发。
3 讨论
子宫颈腺癌多与高危型HPV(常见类型为HPV 18、16、45型)持续感染有关。虽然WHO(2014)女性生殖系统肿瘤分类根据生物学特征将其分为10余种组织类型,但是国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)和美国国立综合癌症网络(national comprehensive cancer network, NCCN)指南并未根据病理类型制定不同的治疗方案。特别是早期腺癌,依靠镜下测量浸润深度进行分期,然而腺体结构复杂,常见多级分支和隧道,无法精确定位浸润病灶的起点。不同医师对同一病例可能出现不同的测量数值而影响治疗方案的选择。
WHO(2020)女性生殖系统肿瘤分类根据病因学将子宫颈腺癌分为HPV相关型(HPV-associated)和不相关型(HPV-independent),其中HPVA增加Silva分型模式的描述,其最先由美国M.D.安德森癌症中心Silva教授在2013年提出并于后续几年进一步验证[4-6]。他们将352例普通型腺癌标本根据侵袭特点分为Silva A型73例(20.7%)、Silva B型90例( 25.6%)、Silva C型189例(53.7%);不同型别的患者采取不同的治疗方案:A型患者在子宫颈锥切切缘阴性时可保留子宫体,无需淋巴结清扫及辅助治疗;B型患者采取单纯子宫切除辅以前哨淋巴结活检,协助确定后续治疗方案;C型患者行子宫颈癌根治术及广泛淋巴结清扫,必要时辅助其他治疗。国内外学者根据此分型标准也得出类似结论[7-8],表明Silva分型与临床分期、肿瘤厚度、淋巴脉管侵犯相关,在治疗方面展现出更好的指导价值。我院作为本地区子宫颈癌筛查中转诊阴道镜的承担单位,收集的数据多以AIS/Silva A型(70.5%,55/78)等早期病变为主,发病年龄峰值为30~49岁,AIS多为30~39岁的年轻女性,与国内文献报道[9]一致。随着患者年龄趋于年轻化,患者保留子宫或生育能力的意愿日益增强,鉴于AIS和Silva A型的预后无明显差异[8-10],根据Silva分型的治疗意见,将超过2/3的子宫颈腺癌及AIS患者避免全子宫切除和(或)淋巴结清扫等过度治疗,减轻患者术后并发症,提高患者生活质量。
本组Silva B/C型病例的术前活检、锥切标本诊断与最终诊断病变符合率高达100%;AIS、Silva A型及总病变符合率,锥切标本明显高于活检标本(97.4%和68%、93.3%和40%、95.1%和64.9%),与文献报道相似[11]。因此,Silva分型更适宜于锥切标本中判断腺癌的侵袭模式。
有研究表明[12],Silva A型与Silva B型或C型具有不同的分子机制,B型更易产生KRAS突变,C型更易产生PIK3CA突变,而A型的遗传学异常往往较B、C型轻微,可能代表肿瘤进展的早期阶段。其次,AIS和Silva A型主要通过腺体结构的复杂性来鉴别,但诊断一致性较差,争议病例可达10%~20%,故Parra-Herran等[13]提出将AIS和Silva A型统称为“非破坏性生长的子宫颈腺癌”,而Silva B型和C型归入“浸润性生长的子宫颈腺癌”,形成新的两级分类系统。本组数据支持这一观点,AIS/Silva A组与Silva B/C组间比较肿瘤厚度与宽度,差异均有统计学意义;AIS与Silva A型的肿瘤宽度、Silva A型与B型的肿瘤厚度和宽度相比,差异无统计学意义;提示Silva B/C型组病变范围明显大于AIS/Silva A型组,而早期腺癌的肿瘤大小与侵袭模式之间并不完美契合,其侵袭性与肿瘤厚度存在一定的相关性,而非肿瘤宽度,这符合FIGO(2018)分期剔除对ⅠA期肿瘤宽度(宽度﹤7 mm)的描述。因此,Silva两级分类模式,既体现侵袭程度,又与病变范围呈现较好的关联性,有助于筛选非破坏性生长的子宫颈腺癌(AIS/Silva A型),降低病理医师鉴别AIS与早期腺癌的压力,减少临床治疗的分歧。本组诊断为浸润性生长的子宫颈腺癌(Silva B/C型)标本,虽然最终诊断病变符合率高达100%,但纳入分析的病例数较少,且两者的治疗与预后不同,形态存在争议时,需要寻找更具特异性的辅助检查项目(免疫组化或分子检测)进行区分。
本文行子宫颈锥切术且切缘阴性者46例,33例AIS、10例Silva A型、3例Silva B型,肿瘤残留率为2.2%(1例AIS锥切后全子宫标本中宫颈见小灶不典型增生腺体残留),随访无复发病例。不同Silva型别腺癌锥切切缘阴性、阳性组间残留病变数量相比,差异无统计学意义。因此,子宫颈锥切标本诊断为AIS/Silva A型且切缘阴性时,提示预后良好,可采取保守治疗;而Silva B/C型患者的镜下病变范围明显超过AIS/Silva A型,脉管侵犯、转移复发风险高,建议制定更积极的治疗方案。对希望保留生育能力的Silva B型(伴淋巴脉管侵犯的ⅠA期和ⅠB1期肿瘤)患者,在前哨淋巴结无转移的前提下,WHO(2020)建议重复锥切保证阴性切缘或行根治性子宫颈切除。然而,既往文献曾报道[14],在类似Silva A型子宫颈腺癌病例中发现卵巢转移,提示选择保守治疗者仍需密切随访。
本文属于回顾性分析,根据现有数据结果分析Silva分型模式与HPVA临床分期、淋巴脉管侵犯、淋巴结转移、神经侵犯、术后放化疗密切相关。Silva两级分类模式,可以更好地筛选非破坏性生长的子宫颈腺癌(AIS/Silva A型);若锥切标本切缘阴性,建议随访观察,其他类型也可制定个性化的处理方案,避免过度治疗。

