川续断皂苷Ⅵ对人颌骨骨髓间充质干细胞成骨分化的影响
李燕燕,朱 珠,谢雯静,徐子昂,张紫薇,张 玮
由于外伤、炎症、肿瘤等引起颌面部较大的骨缺损,临床修复困难,从而给患者治疗带来不便[1]。目前有一些药物用于这方面的治疗,比如双膦酸盐、地诺单抗、降钙素、激素类药物。然而,它们会导致严重的不良反应,包括颌骨坏死、癌症、血栓栓塞和中风[2]。寻求一种较为温和的促进骨重塑,修复骨缺损的药物迎合临床需求。
骨重塑包括破骨细胞去除旧骨,成骨细胞形成新骨。这个过程是紧密耦合的,对于维持骨的强度和完整性至关重要。由于破骨细胞是唯一能够进行骨吸收的细胞,治疗骨疾病的药物的开发主要集中在减少破骨细胞的分化、成熟和骨吸收机制,而很少有治疗方法能真正增加骨形成。来自观察性、实验和临床研究的证据表明,天然产生的化合物与骨骼健康指标的改善之间存在正联系。这为促进骨重塑和解决临床骨缺损引起的修复和治疗问题提供了一个解决方案[3-4]。
间充质干细胞(mesenchymal stem cells,MSCs)是指具有自我更新能力并具有进行多向分化能力的基质细胞,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)是一种存在于骨髓中的多能间充质干细胞。它们具有很强的增殖能力和多向分化潜能,长期以来被认为是组织工程应用的宝贵细胞来源[5]。人颌骨骨髓间充质干细胞(human jaw bone marrow mesenchymal stem cells,hjBMSCs)也是其中一种。
续断,是一种草本植物干燥的根,生长在中国潮湿的田野和山区。它在中国长期被用于治疗骨疾病[6-7]。既往研究表明,续断含有三萜皂苷[8]。川续断皂苷Ⅵ(asperosaponinⅥ,ASAⅥ)是一种典型的来自续断的生物活性三萜皂苷。它具有神经保护、预防骨质疏松等功能。但是其对hjBMSCs成骨分化的影响尚未见明确报道[9]。本文试图进行探究ASAⅥ促进hjBMSCs成骨分化的合适浓度,同时验证其促hjBMSCs成骨分化效应。
1 材料与方法
1.1 药品和试剂
川续断皂苷Ⅵ(ASAⅥ)(纯度>99%,中国药品生物制品检定所),二甲基亚砜溶液(DMSO)(索莱宝,中国),细胞计数试剂盒8(CCK-8)(苏州新赛美公司,中国),DMEM培养基(Gibco,美国),4%青霉素和链霉素(碧云天,中国),抗坏血酸磷酸酯、β-甘油磷酸酯、地塞米松和茜素红(Sigma公司,美国),胎牛血清(FBS)(Invigentech,美国),RNAeasy动物RNA抽提试剂盒(离心柱式)(碧云天,中国),Bradford蛋白浓度测定试剂盒(去垢剂兼容型)(碧云天,中国),PVDF膜(Millipore,德国),BCIP/NBT碱性磷酸酯酶显色试剂盒(碧云天,中国),磷酸盐缓冲液(phosphate buffer,PBS)(Gibco,美国),osteocalcin抗体(Affinity,美国),runt-related transcription factor 2抗体(Affinity,美国),collagen-type Ⅰ抗体(Proteintech Group,美国),CD34-PE、CD45-PE、CD90-PE、CD105-PE(Ebioscience,美国)。
1.2 方法
1.2.1 细胞培养和成骨分化 经患者同意后(伦理审批号:PJ2018-069-001),2019年7—8月从江苏省口腔医院口腔颌面外科病房的多生牙拔除手术中取得约5 mm×5 mm×5 mm颌骨骨块(患者年龄7~17岁),无菌环境下剪成大小均匀的骨块,用含4%青霉素和链霉素的PBS缓冲液轻轻冲洗骨块3次,均匀置于培养瓶中,含有10%FBS和1%青霉素和链霉素的高糖DMEM恰好没过骨块,静置于5%CO2、37 ℃的培养箱7 d,其间不换液,保持骨块无剧烈晃动。待细胞孵出后弃骨继续培养,每2 d换一次液,细胞融合度达80%以上时进行胰酶消化传代,P2~P5代用于后续实验[10]。
配制成骨培养基(1 mmol/L地塞米松、1 mol/L β-甘油磷酸和10 mmol/L L-抗坏血酸)用于后期诱导细胞成骨分化。
1.2.2 细胞鉴定 采用流式细胞仪分析来检测细胞表面标记物。造血干细胞(hemopoietic stem cells,HSCs)的表面标记物有CD34、CD45,间充质干细胞(mesenchymal stem cells,MSCs)的表面标记物有CD90、CD105[11]。
hjBMSCs第3代用于流式表型检测。将长满2个细胞培养皿中的细胞胰酶消化后分成5等份,分别放入含0、5 μL抗体(CD34-PE、CD45-PE、CD90-PE、CD105-PE)的100 μL PBS中,冰上避光孵育30 min。用PBS冲洗细胞,离心(1 000 r/min,5 min)3次。使用流式细胞仪定量细胞荧光,并使用FlowJo_v10.6.2软件进行分析。对抗体阴性样本进行自身荧光检测。
1.2.3 细胞活力测定 第5代hjBMSCs接种在96孔板中,密度为3×103个细胞/孔。每孔含100 μL培养基,37 ℃孵育。24 h后,用不同浓度的ASAⅥ(0、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L)处理细胞,每个浓度设置3个复孔,对照组用药物配制液DMSO处理。培养1、3、5 d后分别终止培养,弃去旧培养液,以1∶10的比例将CCK-8试剂与完全培养基混合后孵育细胞,2 h后用分光光度计在450 nm处测定代表细胞活力的吸光度。
1.2.4 BCIP/NBT碱性磷酸酯酶显色 将细胞接种在12孔板中,细胞密度达80%时,用含0、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L ASAⅥ的成骨诱导液培养细胞,每组设置3个复孔。每间隔2 d换一次液,诱导7 d后终止诱导,用多聚甲醛固定30 min,PBS洗涤后,用BCIP/NBT碱性磷酸酯酶显色试剂染色,根据代表碱性磷酸酯酶含量的蓝色深浅观察ASAⅥ促进hjBMSCs成骨分化的情况。
1.2.5 茜素红染色 将细胞接种在6孔板中,细胞密度达80%时,用含不同浓度的ASAⅥ的成骨诱导培养基诱导细胞,前4 d每2 d换一次液。此后只加液不换液。到第14天时,用多聚甲醛固定30 min。然后用PBS洗涤,每孔加入适量茜素红溶液使其均匀覆盖皿底,常温孵育3 min。拍摄记录代表细胞成骨分化程度的红色深浅,显微镜下观察细胞外基质形成的钙结节情况。
1.2.6 免疫印迹分析 用含有一定浓度ASAⅥ的培养液培养细胞7 d后,用RIPA裂解液在冰上裂解细胞,然后在12 000 r/min 4 ℃ 离心10 min。收集上清液,并使用Bradford蛋白浓度测定试剂盒(去垢剂兼容型)测定蛋白质浓度;50 μg蛋白质煮沸10 min,冷却后置于-20 ℃储存。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分离并转移到PVDF膜上。在TBST缓冲液中用5%BSA封闭膜,在4 ℃下与一级抗体孵育过夜。在TBST中洗涤膜3次15 min,并在室温下与二级抗体孵育45 min。用曝光机测定实验带的吸光度值与内参GAPDH吸光度的关系。
1.2.7 实时荧光定量PCR检测 采用实时荧光定量PCR检测显著的成骨分化相关标记基因,包括Runt相关转录因子2(Runx2)、骨钙素(OCN)和Ⅰ型胶原(COL-Ⅰ)的表达水平。将细胞接种于6孔板,用以上筛选浓度的ASAⅥ培养细胞。在7 d后,使用RNAeasy动物RNA抽提试剂盒提取总RNA,对COL-Ⅰ、Runx2和OCN进行cDNA合成。β-actin作为内参。使用比较阈值循环(ΔΔCT)方法分析目的基因的相对表达量,为了降低变异性,所有RT-PCR均重复进行3次。
1.3 统计学方法
使用GraphPad Prism 9统计软件,细胞活力测定实验采用方差分析,组间两两比较采用Dunnett。实时荧光定量PCR实验使用t检验。P<0.01为具有统计学差异。
2 结 果
2.1 hjBMSCs的鉴定
造血干细胞(HSCs)的表面标记物有CD34、CD45;间充质干细胞(MSCs)的表面标记物有CD90、CD105。流式细胞仪定量细胞荧光鉴定显示,抗体阴性样本自身荧光及造血干细胞表面标记物CD34、CD45检测阴性,而间充质干细胞的表面标记物有CD90、CD105呈强阳性(图1),说明提取的细胞属于颌骨骨髓非造血间充质干细胞,可以用于后续实验。
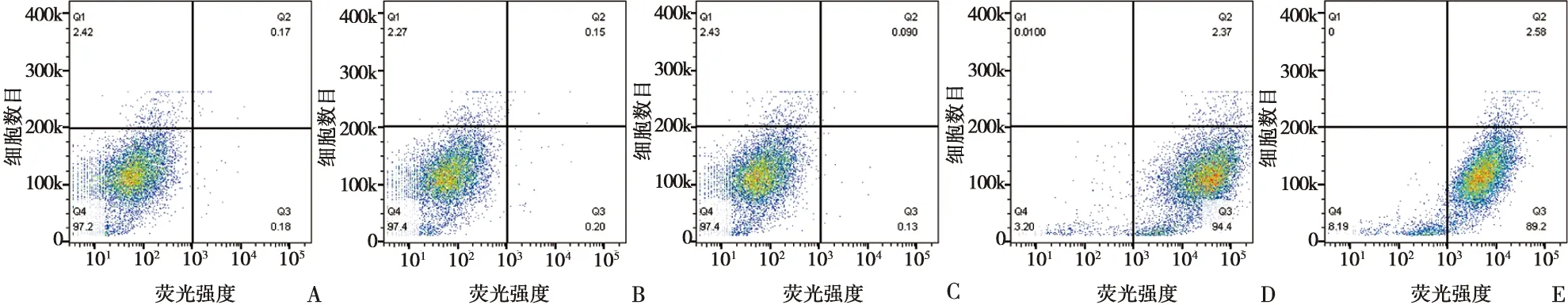
A:细胞自身荧光;B:加入CD34抗体的样品;C:加入CD45抗体的样品;D:加入CD90抗体的样品;E:加入CD105抗体的样品
2.2 ASAⅥ对hjBMSCs增殖的影响
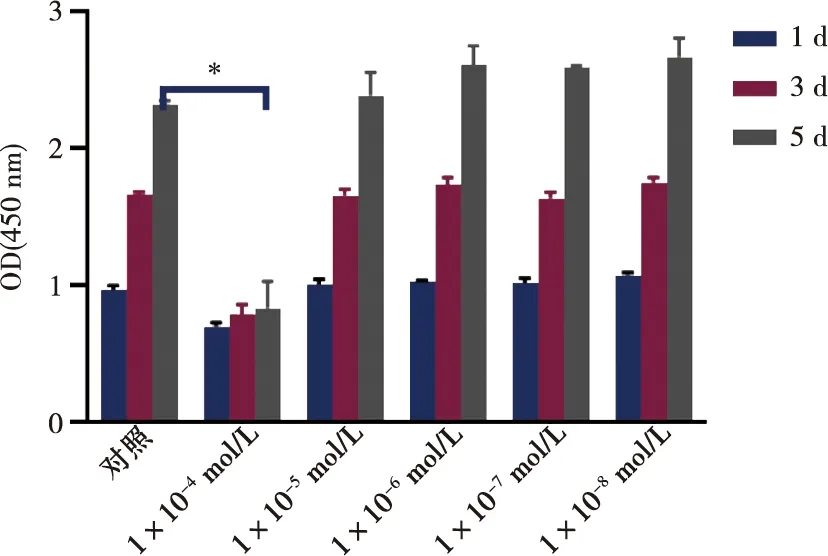
上述方法中设置的浓度梯度的ASAⅥ培养细胞1、3和5 d后用CCK8测定,结果显示1×10-4mol/L组明显抑制细胞增殖,对细胞有一定的毒性(P<0.01),而1×10-8~1×10-5mol/L ASAⅥ组则对细胞增殖均无明显抑制(P>0.05)(图2)。
2.3 ASAⅥ对hjBMSCs 碱性磷酸酯酶活性的影响
用含有0、1×10-8、1×10-7、1×10-6、1×10-5、1×10-4mol/L ASAⅥ的诱导液培养细胞7 d,弃旧培养基后固定,采用BCIP/NBT碱性磷酸酯酶显色试剂对其染色并观察。肉眼观察,与对照组相比,1×10-5、1×10-6、1×10-8mol/L ASAⅥ组蓝色标记的碱性磷酸酯酶染色更深, 说明其对应的碱性磷酸酯酶活性更强,而碱性磷酸酯酶含量的高低能代表成骨分化的水平[12]。1×10-5、1×10-6mol/L染色比1×10-8mol/L更深,意味着其诱导成骨分化能力更强(图3)。镜下观察细胞着色情况与肉眼观察一致(图4)。
*:P<0.01

图3 BCIP/NBT碱性磷酸酯酶显色Fig.3 BCIP/NBT alkaline phosphatase staining
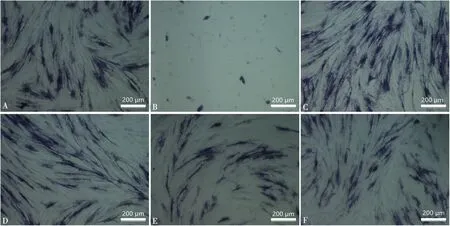
A:对照;B:1×10-4 mol/L;C:1×10-5 mol/L;D:1×10-6 mol/L;E:1×10-7 mol/L;F:1×10-8 mol/L
2.4 ASAⅥ对hjBMSCs细胞外基质矿化的影响
采用茜素红染色法检测1×10-5、1×10-6mol/L ASAⅥ诱导hjBMSCs后细胞外钙结节沉积情况。结果显示,与对照组相比,1×10-5、1×10-6mol/L组中红色标记的矿化结节数量显著增加(图5)。
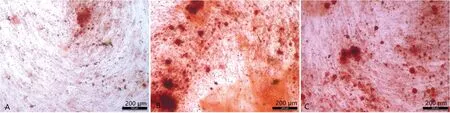
A:对照;B:1×10-5 mol/L;C:1×10-6 mol/L
2.5 ASAⅥ对hjBMSCs成骨影响的蛋白水平检测
用免疫印迹分析对照组、1×10-5、1×10-6mol/L组中成骨相关的蛋白表达水平(图6)。对比GAPDH的吸光度,1×10-5、1×10-6mol/L组中的Runx2、OCN和COL-Ⅰ的表达均高于对照组(图7),其中OCN和COL-Ⅰ表达的升高有显著性差异。
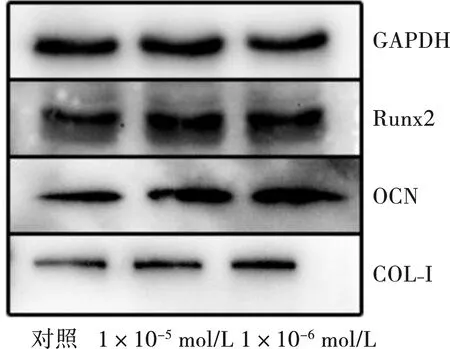
图6 免疫印迹分析成骨相关蛋白的表达Fig.6 Western blot analysis of the expression of osteogenesis-related proteins
2.6 ASAⅥ对hjBMSCs成骨影响的mRNA水平检测
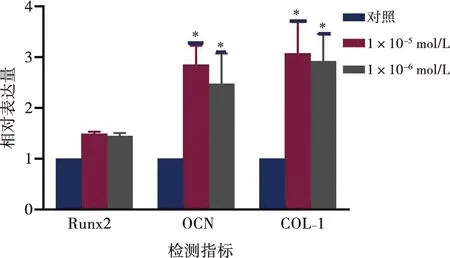
*:P<0.01
用实时定量PCR检测对照组、1×10-5、1×10-6mol/L组成骨相关指标的mRNA水平的表达。1×10-5、1×10-6mol/L组的Runx2、OCN和COL-Ⅰ的表达均高于对照组(P<0.05)(图8),且1×10-5mol/L组略显优势。
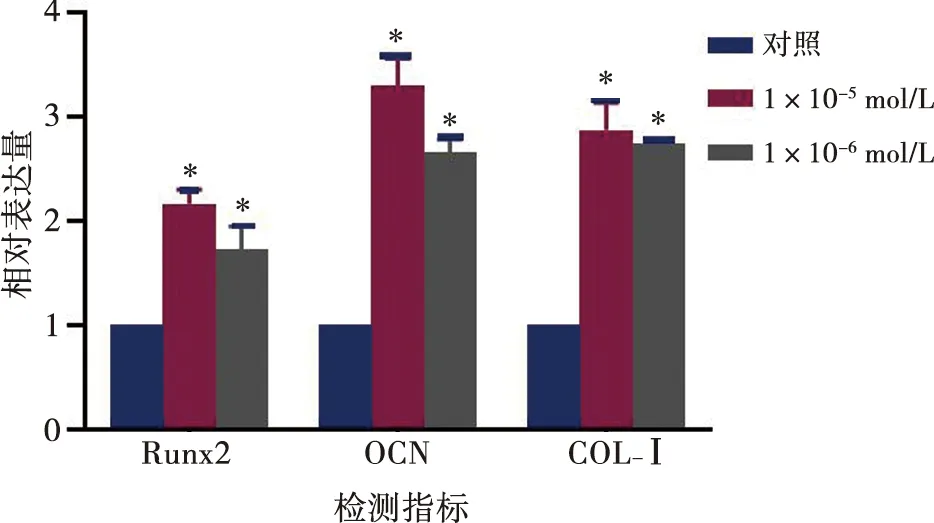
*:P<0.01
3 讨 论
传统中药ASAⅥ具有改善免疫,促进骨损伤愈合、抗菌、抗炎等作用[13]。研究显示,ASAⅥ既可以通过抑制破骨细胞的形成,也可促进成骨细胞分化,提高成骨细胞的活性和数量,促进基质钙化、骨痂生长,从而防止骨质疏松、促进骨折的愈合[14-15]。但是其对hjBMSC的作用及具体影响机制未见明确报道。
MSCs是再生医学中细胞治疗的重要来源。在动物模型和人体临床试验中,MSCs 在修复各种退行性疾病中的受损组织方面显示出优势[16-18]。MSCs在组织修复中的一个关键机制是它们定向分化为受损组织[19]。hjBMSCs是存在于人颌骨骨髓中的非造血间充质干细胞,具有成骨等多向分化的潜能,且取材来源较广,易于培养[20]。研究证实,将hjBMSCs定向分化为受损骨组织的成分对于骨损伤愈合至关重要[21-22]。
本研究中,设置不同浓度组的ASAⅥ对hjBMSCs进行诱导,期望筛选出在不影响细胞增殖的前提下又能定向诱导其成骨分化的浓度,筛选的同时也验证了ASAⅥ能使hjBMSCs定向成骨分化。
碱性磷酸酶(ALP)在矿化组织的细胞中高度表达,并在硬组织的形成中起关键作用,其含量的高低能代表成骨分化的水平[23]。BCIP/NBT碱性磷酸酯酶显色是其含量的检测方式之一[24]。在检测ASAⅥ对hjBMSCs增殖的影响时,只筛选了有无毒性的浓度,并未直接以增殖活性作为唯一标准排除浓度组。而是同时结合代表成骨分化的BCIP/NBT碱性磷酸酯酶显色再次对几个浓度进行筛选。我们发现了高浓度的ASAⅥ(1×10-4mol/L)对hjBMSCs有明显的抑制增殖及分化的毒性作用。而低浓度的ASAⅥ对细胞增殖无毒性,且其增强了hjBMSCs的碱性磷酸酯酶的表达,促进成骨分化。其中效果最为明显的浓度组是1×10-5、1×10-6mol/L。
为进一步验证1×10-5、1×10-6mol/L浓度组的ASAⅥ促进hjBMSCs成骨分化,茜素红染色(ARS)被用于实验。ARS试剂能够与钙融合产生一种红色复合物,可用于识别ASAⅥ诱导hjBMSCs成骨分化产生的矿化结节。颜色深浅代表矿化程度的高低。结果显示,与对照组相比,1×10-5、1×10-6mol/L浓度组的钙结节明显增多,成骨分化水平明显升高。
骨形成是一个高度受限的过程。Runx2是骨祖细胞增殖所必需的,被认为是最早确定成骨细胞谱系的转录因子[25]。OCN被认为与成熟的成骨细胞活性有关,因此被视为晚期成骨细胞发生的标志物[26]。COL-Ⅰ刺激成骨细胞的钙盐和磷在新形成的类骨质中沉淀,以形成骨矿物质或羟基磷灰石[27]。在我们的研究中,1×10-5、1×10-6mol/L的ASAⅥ诱导hjBMSCs一段时间后,发现代表成骨分化的几个指标在蛋白水平均明显高于对照组。这再次说明,一定浓度的ASAⅥ能够让hjBMSCs定向成骨分化。
结合以上结果,用RT-PCR检测1×10-5、1×10-6mol/L的ASAⅥ诱导hjBMSCs后,代表成骨分化的几个指标在mRNA水平的变化。与前面的结果一致,与对照组相比,1×10-5、1×10-6mol/L ASAⅥ组的Runx2、OCN、COL-Ⅰ在RNA水平也明显上升。
综上所述,1×10-5、1×10-6mol/L的中药川续断皂苷Ⅵ均能较好诱导人颌骨骨髓间充质干细胞定向成骨分化,其具体机制有待进一步检测。

