健脾化瘀解毒方调控AKT/p38蛋白磷酸化改善胃癌前病变小鼠脾虚证研究*
李思怡 ,麦伟栅 ,林琨洋 ,林泽龙 ,罗敏怡 ,潘华峰 **
(1.广州中医药大学国际中医药转化医学研究所 广州 510006;2.教育部中医药防治肿瘤转化医学研究国际联合实验室 广州 510006;3.深圳大学体育学院 深圳 518000;4.广州中医药大学科技创新中心 广州 510006;5.南方医科大学中医药学院 广州 510515)
胃癌是常见恶性肿瘤之一[1],在我国,胃癌的发生率和死亡率高居恶性肿瘤第二位[2]。胃癌前病变(Gastric precancerous lesions,GPL)是慢性胃炎演变成胃癌的关键环节,是指胃黏膜萎缩基础上合并异型增生的病理改变[3],该病理阶段包含不同程度的胃黏膜损伤,临床以胃脘疼痛、饱胀、痞闷、嗳气、纳呆等为主要表现,属中医“痞满”、“胃痞”以及“虚痞”等范畴。但研究表明,GPL表现为细胞退化变性和增殖长期共存,但具有一定的可逆性[4-6]。GPL常由慢性萎缩性胃炎发展而来,大量研究证实,脾虚是慢性萎缩性胃炎和GPL的发病基础[7]。中医理论认为GPL的病位在脾胃,基本病机是本虚标实,即“脾虚、血瘀、夹毒”[8]。有研究发现,脾虚证大鼠胃黏膜萎缩变薄,免疫功能低下及黏膜微血管新生等结构改变,病理切片可见胃黏膜固有腺体萎缩,常伴肠上皮化生以及异型增生等[9]。目前西医对GPL主要为对症支持治疗,而中医对于GPL治疗多从“虚”和“瘀”论治[10]。《慢性胃炎中医诊疗专家共识意见》认为GPL以气阴两虚和气滞血瘀多见[11]。中医辨证论治不仅可明显改善GPL临床症状,具有明显的“既病防变”作用,在抑制或逆转肠上皮化生及异型增生方面取得了良好的疗效[9]。
课题组前期通过网络药理学研究表明,健脾化瘀解毒方可能通过白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin-1β,IL-1β)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)等核心治疗靶点,作用于 PI3K-AKT(PI3K:Phosphatidylinositide 3-kinases;AKT:又 称 PKB(protein kinase B))、HIF-1(Hypoxia inducible factor 1)及 MAPK(Mitogen-activated protein kinase)等信号通路,发挥防治胃癌前病变的作用[2]。另外,健脾化瘀解毒方源自于四君子汤,以“健脾益气,化瘀解毒”立法,是课题组长期临床治疗慢性萎缩性胃炎-GPL的经验方,前期研究证实健脾化瘀解毒方能显著改善GPL患者的临床症状、内镜表现以及病理学改变,具有明确的临床疗效[13]。缺少参考文献序号12,请核实并修改。参考文献需按照在正文中出现的顺序依次标号,请全文核实并修改。
课题组前期研究发现,健脾化瘀解毒方可抑制SPF级同窝野生型小鼠和Atp4a-/-小鼠PI3K/AKT/HIF-1α信号通路的激活,抑制细胞恶性增殖与肠上皮化生,进而发挥修复受损胃黏膜的作用[7],但其对于胃癌前病变小鼠脾虚症状的改善作用及潜在机制尚不明确。有研究说明,中医“四季脾旺不受邪”所涵盖的内容包括西医脾脏、胃肠道等器官的免疫功能[8],说明对脾脏、胃肠道等器官的观察可能进一步反映中医“脾”的功能。
因此,本研究基于AKT、p38蛋白磷酸化调控氧化应激理论,通过构建胃癌前病变小鼠脾虚证模型,探索了健脾化瘀解毒方治疗胃癌前病变脾虚证的作用机制,丰富了中医药治疗胃癌前病变的理论依据。
1 材料与方法
1.1 实验动物
SPF级BALB/c小鼠,雄性,体质量(20±2)g,购于广州中医药大学实验动物中心,动物生产许可证号:SCXK(粵)2018-0002,动物生产许可证号SCXK(粤)2018-0034)。饲养环境:广州中医药大学实验动物中心SPF动物实验室,本实验过程中对小鼠的处理已获得广州中医药大学动物伦理委员会同意。
1.2 仪器
JJ3000动物电子秤(公司)、自动真空组织脱水机(Leica公司)、石蜡包埋机(Leica公司)、RM2135石蜡切片机(Leica公司)、正置光学显微镜(日本尼康公司)、3K30离心机(SIGMA公司产品)、垂直电泳仪(美国伯乐公司)以及蛋白凝胶成像仪(美国伯乐公司)。
1.3 药物与试剂
健脾化瘀解毒方(黄芪20 g,太子参15 g,白术10 g,茯苓 12 g,三七粉 3 g,莪术 10 g,白花蛇舌草15 g,猴菇菌提取物15 g);N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N’-nitro-N-nitrosoguanidine,MNNG)(日本东京株氏会社);无水乙醇、甲醇、二甲苯、盐酸及中性树脂(国药集团化学试剂有限公司);石蜡(Leica公司);苏木素、伊红染色试剂盒(南京建成);GAPDH兔单克隆抗体(Cell Signaling Technology,美国);p-p38、P38、p-AKT、AKT兔单克隆抗体(Cell Signaling Technology,美国);HRP标记的抗兔IgG二抗(Cell Signaling Technology,美国);HRP标记的抗鼠IgG二抗(Cell Signaling Technology,美国)。
2 方法
2.1 造模方法
本实验通过使用对致癌因子敏感的C57近交系小鼠BALB/c自由饮用MNNG复制GPL脾虚证小鼠模型。取50只健康SPF级雄性成年BALB/c小鼠,适应性喂养1周后,记录体质量变化,并进行适应性饮用MNNG溶液,将体质量差异较大的小鼠淘汰,留取40只小鼠,通过随机数表法将其分为空白组(n=8)、模型组(n=8)、健脾化瘀解毒方低剂量组(n=8)、健脾化瘀解毒方高剂量组(n=8)、阳性药组(n=8),连续造模14周。
2.2 干预方法
SPF级4周龄,雄性,体质量20-22 g的BALB/c小鼠共40只,分为正常组(8只)及造模组(32只),模型组8只,维生素B12组8只,健脾化瘀解毒方高低剂量组各8只。正常组小鼠予正常饮食,造模组通过MNNG自由饮用复制GPL脾虚证小鼠模型,连续造模14周,造模剂MNNG饮用浓度为150 μg·mL-1。并于造模第6周联合灌胃给药,健脾化瘀解毒方低(MNNG+JPHYJD 3.75 g·kg-1·d-1)、高剂量组(MNNG+JPHYJD 15 g·kg-1·d-1),每日给药1次,持续给药8周。正常对照组和模型组以等量蒸馏水灌胃。并于末次给药前12 h开始禁食(不禁水),取血后取材。
2.3 观察指标
2.3.1 小鼠整体情况观察
定期记录小鼠的体质量及摄食情况,观察各小鼠的体质量及摄食变化。
2.3.2 脏器指数
脏器指数为动物脏器与其体质量的比值,脾脏和胸腺作为重要的免疫器官,脾脏指数和胸腺指数对了解小鼠免疫功能有重要意义。取材时,分离小鼠的脾脏和胸腺,称重并记录。脾脏指数(mg/g)=脾脏重量(mg)/小鼠体质量(g),胸腺指数(mg/g)=胸腺重量(mg)/小鼠体质量(g)。
2.3.3 脾脏的病理形态观察
在脾脏取0.5 cm×0.5 cm组织块,置于4%多聚甲醛溶液中固定24 h,固定后用纯水冲洗、修剪后放入自动脱水机进行脱水透明,脱水的步骤是:80%、90%、95%、100%各种浓度乙醇分别浸泡2 h和二甲苯(2道透明各30 min),石蜡包埋、切片,然后进行染色。按脱蜡、梯度乙醇复水、苏木素和伊红染色、梯度乙醇脱水、透明、封固的顺序完成HE染色后,置于显微镜下观察脾脏组织结构。
2.3.4 小鼠胃黏膜组织AKT信号通路相关蛋白与基因的表达
Western blot法检测小鼠胃黏膜上皮细胞p-p38、p38、AKT以及p-AKT等蛋白的表达水平。
2.4 统计方法
运用SPSS 20.0软件进行统计分析,计量资料用平均数±标准差()表示,多组间比较采用 one-way ANOVA,两组间比较采用LSD-t检验,以P<0.05为差异有统计意义,应用GraphPad 9.0软件作图。
3 实验结果
3.1 体质量增长与摄食变化
每组小鼠体质量在14周后均有明显增长,其中体质量增加最多的是空白组,模型组的小鼠体质量增长明显低于正常组(P<0.001)。通过健脾化瘀解毒方及阳性药干预后,各组小鼠体质量增长出现增多趋势,实验结束时,健脾化瘀解毒方高剂量组及阳性药组小鼠体质量增长显著高于模型组小鼠(P<0.01)。这初步提示健脾化瘀解毒方可改善MNNG所诱导的脾虚证小鼠体质量增长缓慢和摄食功能减弱,发挥改善小鼠脾虚症状的作用。请正文合适的位置补充见图1。
3.2 脏器指数

图1 各组小鼠体质量增长与摄食变化对比

图2 各组小鼠脏器指数对比

图3 空白组脾脏组织

图4 模型组脾脏组织
实验结束时,模型组的脾脏指数明显低于空白组(P<0.05),健脾化瘀解毒方高剂量组和阳性药组的脾脏指数均高于模型组,差异有统计学意义(P<0.05),见图2。在胸腺指数方面,各组之间胸腺指数无统计学差异。这提示MNNG诱导胃癌前病变脾虚证小鼠,对其脾脏功能可能具有影响,进而促进脾虚症状加重,而健脾化瘀解毒方可能对脾脏功能具有保护作用。
3.3 脾脏组织病理形态观察
如图所示,空白组小鼠脾脏组织小梁明显,白髓和红髓的边界清晰,白髓内淋巴细胞丰富,见图3;而模型组小鼠脾脏组织红白髓无明显边界,小梁消失,可见血窦出血明显,淋巴细胞数量显著减少,提示脾脏功能减弱,但未出现不可逆器质性病变,见图4。与模型组相比,健脾化瘀解毒方低剂量组白髓、红髓边界比较清晰,血窦出血较模型组少,淋巴细胞增生,见图5;健脾化瘀解毒方高剂量组和阳性药组边界清晰,淋巴细胞明显增多,血窦出血明显减少,提示健脾化瘀解毒方可能对脾虚证小鼠脾脏组织修复具有促进作用,见图6、7。

图5 健脾化瘀解毒方低剂量组脾脏组织
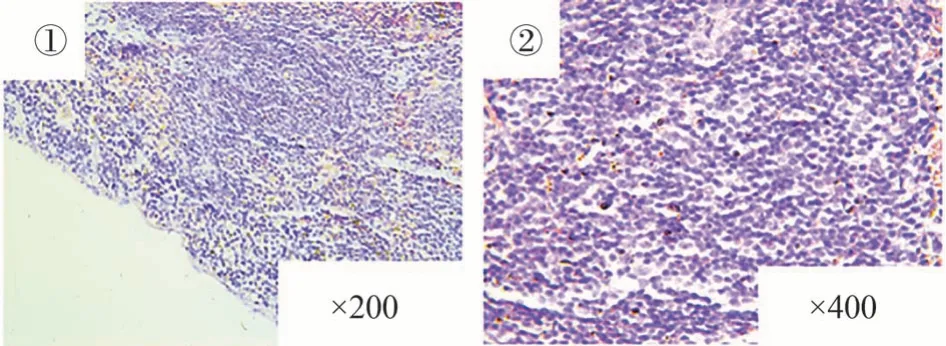
图6 健脾化瘀解毒方高剂量组脾脏组织

图7 阳性药组

图8 胃黏膜p-p38、p38、p-AKT、AKT蛋白表达结果
3.4 胃黏膜p-p38、p38、p-AKT、AKT蛋白表达结果
与空白组相比,模型组的p-p38、p-AKT灰度显著高于空白组,p-p38、p-AKT表达量明显增多,p38及AKT蛋白表达量未见明显变化,模型组p-p38/p38及p-AKT/AKT灰度比值均显著高于空白组,提示p38及AKT发生了磷酸化。与模型组相比,健脾化瘀解毒方高低剂量组及阳性药组p38及AKT蛋白磷酸化程度降低,高剂量组和阳性药组的表达量降低更明显,与空白组的表达量相似。提示健脾化瘀解毒方可能通过抑制p38及AKT发生磷酸化,进而抑制AKT/p38信号通路。
4 讨论
课题组前期运用BALB/c小鼠自由饮用复制GPL小鼠模型,可见小鼠胃黏膜出现萎缩,伴有肠上皮化生及异型增生,而健脾化瘀解毒方可明显改善该动物模型的胃黏膜病理组织恶变[14]。在此基础上,本研究通过对其进行脾虚证评价、以方测证及显效机制探讨,发现该模型伴有脾虚证候表现,同时以脾脏功能变化引起机体免疫功能变化,进一步阐明了健脾化瘀解毒方改善脾虚证GPL的分子生物学机制。
4.1 构建GPL-脾虚证病证结合小鼠模型
本研究通过观察GPL小鼠的体质量及摄食情况,发现该GPL小鼠模型具有体质量增长缓慢、摄食减少表现,符合《中药新药临床研究指导原则(试行)》中对脾气虚证主症为食少纳呆的表现[15]。脾脏与胸腺器官相对质量的变化,取决于其中淋巴细胞增殖的程度,可反应机体免疫功能。研究发现,具有健脾功效的中药可通过增强机体免疫功能,达到治疗脾虚的作用,其显效机制可能通过调节消化系统吸收作用[16]。因此,本研究检测该模型小鼠脾脏及胸腺指数、HE染色结合光镜下观察脾脏病理组织结构,进一步发现该GPL小鼠模型伴有脾脏指数降低、脾脏病理组织结构改变,提示该GPL小鼠模型脾脏功能也出现下降。另一方面,该小鼠模型胸腺指数变化不具有统计学意义,提示该模型变化可能与胸腺引起的免疫功能下降无关,脾脏引起的免疫功能可能参与该GPL小鼠脾虚证发生。通过以上方法,对GPL-脾虚证进行初步评价,构建了GPL-脾虚证的病证结合模型。
4.2 健脾化瘀解毒方对GPL脾气虚证具有显著疗效
在模型构建成功的基础上,通过健脾化瘀解毒方干预,进一步发现健脾化瘀解毒方可明显改善该GPL小鼠模型体质量增长缓慢、摄食减少情况,并在一定程度上,可提高MNNG诱导所引起的脾脏指数下降,改善其诱导的脾脏病理组织结构紊乱。方中君药黄芪为健脾益气代表药,臣以太子参益气生津、健脾滋阴的太子参,同时助长黄芪补中益气,佐以健脾化湿的白术、茯苓,配合行气消食的猴头菇,佐以三七粉、莪术活血化瘀,再益以解毒抑癌的白花蛇舌草,此五药相合,既能补脾气、振脾阳,又能补胃气、养胃阴[3]。全方以胃癌前病变的共同证型基础——脾虚证为核心,发挥健脾益气为主、活血化瘀解毒为辅的作用,从而发挥改善该GPL小鼠模型脾虚证及脾脏指数、病理组织结构的作用。
4.3 健脾化瘀解毒方通过抑制p-38/AKT改善GPL脾虚证
AKT是对调控细胞生长、增殖、存活及代谢有重要作用的丝氨酸/苏氨酸特异性蛋白激酶,PI3K激活后与AKT的PH结构域相互识别,导致AKT发生转移和构象改变,进而通过磷酸化的方式调控下游信号分子,可见AKT是PI3K/AKT/mTOR信号通路的核心蛋白[17]。p38MAPK是MAPK超家族成员的重要组成部分,其可受氧化应激激活,磷酸化成为p-p38MAPK,发挥其生物学活性[18]。p-AKT、p-p38可以通过激活下游细胞受体或效应器来调节细胞的增殖、细胞凋亡、血管生成和细胞周期等[7],AKT和p38的活化都与肿瘤的发生发展密切相关[13],而且与多种肿瘤患者预后差密切相关[19-22]。课题组前期研究发现,健脾化瘀解毒方可抑制Atp4a-/-小鼠PI3K/AKT/HIF-1α信号通路的激活,进而发挥修复受损胃黏膜的作用[7]。本研究发现健脾化瘀解毒方可能通过抑制AKT及p38的磷酸化,调控p38/AKT信号通路。因此,健脾化瘀解毒方调控该通路,发挥对改善消瘦、摄食减少等GPL小鼠脾虚症状及脾脏病理组织结构的作用,进而促进受损胃黏膜的修复,可能与AKT及p38的磷酸化相关。
本研究通过构建GPL小鼠模型,结合脾虚证候分析,初步建立胃癌前病变小鼠的脾虚证病证结合评价体系,为筛选GPL脾虚证特色中药新药提供了载体,并结合以方测证法,明确了健脾化瘀解毒方对脾虚证GPL的疗效,初步探讨了p-38/AKT信号通路激活与脾虚证的关系,丰富了健脾化瘀解毒方治疗GPL的理论依据,从脾虚证角度,以p38/AKT的磷酸化为切入点,为研究GPL病证结合及阐明中药复方显效机制提供了思路。

