两种佐剂制备CIA大鼠模型的效果比较
郭 帅,褚小磊,沈 桐,李 季,王浩淼,朱毛妮,朱盼盼,陈一航,吕樵岚,胡玲莉,田亚兰,王元元,陈传好
类风湿性关节炎(rheumatoid arthritis,RA)是由免疫、内分泌、感染、遗传、环境等多因素参与的全身性自身免疫性疾病,以关节滑膜炎症为特征,具有持久、反复发作的特性,通常引起关节软骨及骨质的破坏,最终导致关节畸形及功能障碍[1-2]。目前对于RA的病因与病理机制尚未确切明了,也无特效治疗手段。在研究RA的过程中,需要有效的RA动物模型[3-4],动物模型是研究该疾病的致病机制且用于药物新疗法测试的研究工具[5-6]。目前,已经建立了关节炎模型,包括CIA、佐剂性关节炎(adjuvant arthritis,AA)、降植烷诱导的关节炎(pristane-induced arthritis,PIA)等[4,7]。但制备RA模型的方法,尚缺乏相对统一的标准。在研究RA时,常选择不完全弗氏佐剂(incomplete Freund′s adjuvant,IFA)和完全弗氏佐剂(complete Freund′s adjuvant,CFA)分别与牛Ⅱ型胶原蛋白(calf Ⅱ collagen,CⅡ)混合乳化,制备胶原诱导性关节炎(CIA)模型[8-10]。两种方案在制备RA模型时,对关节的滑膜层、关节软骨的影响程度是否有差异,目前尚未见报道。本研究采用两种方案制备CIA模型,比较两种造模方案对关节损害的程度。
1 材料与方法
1.1 实验动物 SD大鼠30只[8周龄,雌性,SPF级,体质量(200±30)g]购买于蚌埠医学院实验动物中心。所有大鼠于同一环境(25 ℃)给予自由饮食。
1.2 主要试剂 CⅡ(Chondrex 20022);CFA(Chondrex 7001);IFA(Chondrex 7002);均为10 mg。
1.3 建立RA关节炎模型 将30只大鼠随机分为3组:0.9%氯化钠溶液组(对照组),IFA+CⅡ模型组,CFA+CⅡ模型组,每组10只。将CFA/IFA与CⅡ型胶原,以等体积在4 ℃(冰浴)无菌条件下混匀乳化;配制成质量浓度为1 mg/mL的乳液。从大鼠尾根部开始,在多个位置,分少量多次皮内注射混悬乳液200 μL;于初次免疫后7 d注射100 μL,以加强免疫。对照组在相同时间点注射等量的0.9%氯化钠溶液。
1.4 关节炎评分 在初次免疫后第7、14、21天,参照David D Brand关节炎指数(AI)评价标准[8],对3组大鼠AI进行评价并记录分值(见表1)。对每肢足趾单独评分,将四肢评分相加作为关节炎评分,每只大鼠最高为16分。由3名实验者完成,以平均值作为AI评分。AI总分≥4分判定为造模成功。

表1AI评分标准
1.5 大鼠踝关节获取 在造模后第14天,每组取出5只大鼠麻醉处死,获取踝关节,并使用10%甲醛固定,用于HE染色。
1.6 HE染色 踝关节在甲醛中固定14 d→ HNO3(10%)脱钙48 h→流水冲洗过夜→乙醇逐级脱水→二甲苯透明→石蜡包埋、切片→常规HE染色。在光镜下观测RA模型大鼠踝关节的病理学变化。
1.7 统计学方法 采用方差分析和q检验。
2 结果
2.1 一般情况观察 造模后,大鼠双后肢足爪第9天未见明显改变,第10天出现急性肿胀,呈对称性,第14天明显不能负重,直至实验结束。与对照组相比,模型组大鼠饮食减少;毛发光泽度下降,干枯容易脱落;精神状态欠佳,活动减少且行动迟缓。另外,对照组尾巴注射部位无点状感染,毛发正常。模型组在注射部位有点状感染,尾部略增粗,质地一般或者有一定硬度且注射部位形成小溃疡,多数可以结痂自愈;但IFA+CⅡ组注射部位出现感染的数量较CFA+CⅡ组明显减少。
2.2 AI评分 在造模后第7天,3组AI值均为0。在14 d时,两模型组AI值升高,IFA+CⅡ组和CFA+CⅡ组AI值比较差异有统计学意义(P<0.01);在21 d时,AI值继续升高,IFA+CⅡ组和CFA+CⅡ组AI值比较差异有统计学意义(P<0.01)。在14 d和21 d,两模型组之间AI值差异无统计学意义(P>0.05)。对照组在造模后14 d和21 d 的AI值均为0(见表2)。
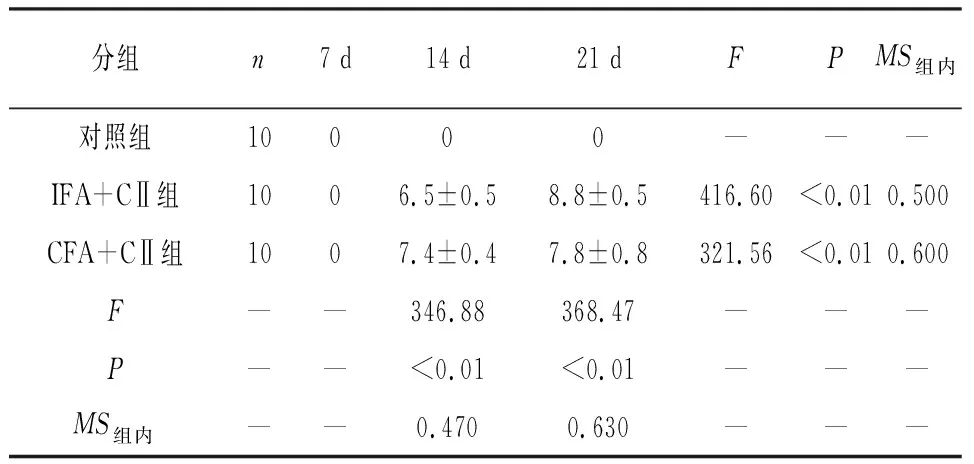
表23组大鼠在不同时间点AI值的变化趋势
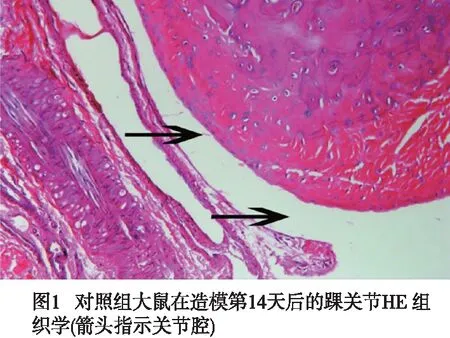
2.3 3组大鼠在造模后第14天踝关节病理学变化 对照组踝关节腔内,关节软骨表面光滑且完整,关节软骨及软骨下骨质无破坏,关节间隙正常;且未见滑膜增生和血管翳形成(见图2)。IFA+CⅡ组踝关节滑膜软骨连续但关节软骨表面粗糙不平(见图3A);踝关节腔内可见少量血管翳、炎性细胞浸润,关节软骨轻微破坏(见图3B)。CFA+CⅡ组关节软骨明显破坏、不连续不完整且呈锯齿状(见图3C);形成明显的血管翳,滑膜细胞增生明显,排列紊乱,见大量的炎性细胞浸润(见图3D)。

3 讨论
CIA模型在临床症状和病理学特点及免疫学方面与RA相似[11],一直是研究RA的经典模型[4,8]。CIA 是一种用同源或异源性Ⅱ型胶原免疫动物而引发的一种慢性、多发性关节炎。通常在尾根部皮内注射佐剂乳化的CⅡ诱导动物,注射后可发生关节炎。许多研究者使用RA模型进行转基因及免疫治疗等研究[10],佐剂的种类可能影响CIA模型的病变情况,导致实验误差加大,从而影响结果的可靠性。
本研究使用IFA和CFA分别与等体积CⅡ乳化制备RA大鼠模型。比较大鼠一般情况、发病情况和病理学改变。从一般情况上看IFA+CⅡ组发病时感染较少,在造模后14 d,2组大鼠AI评分均超过4分,说明RA大鼠模型制备成功。随着时间的延长,在造模后21 d,2组的AI值变化不大。在模型成功率上两模型组均为80%,这与大多数研究者的结果相似[12-13]。在造模后14 d,2组踝关节HE染色结果发现,模型组均可见炎性细胞、血管翳增生等。这一现象的可能机制为CⅡ可以诱导B细胞产生特异性抗体;抗体沉积于关节部位,协同CⅡ激活补体系统,诱发炎症。这一炎症反应不断刺激滑膜组织,形成血管翳[11]。这些血管翳引起关节软骨破坏,最终导致RA的发生[14]。IFA+CⅡ组比CFA+CⅡ组炎症反应稍轻,提示免疫反应较弱。而且IFA+CⅡ组在对关节软骨的破坏程度、炎症细胞的增多程度、血管翳的增生程度和浸润程度明显比CFA+CⅡ组轻。使用IFA+CⅡ制备RA模型有利于减小实验误差,真实反映RA的病变情况,保证RA相关研究结果的可靠性。由于在造模后21 d,模型组的AI值变化不大,为此本课题组仅观察了造模后14 d的病理学变化。为了深入了解IFA+CⅡ造模的优越性,本课题组下一步实验将检测炎性因子肿瘤坏死因子α、白细胞介素1β和白细胞介素17在RA中的表达变化,这将为RA研究提供更为可靠的实验基础。
综上所述,在制备大鼠RA模型过程中,使用IFA+CⅡ和CFA+CⅡ有相似的病理学特点,并且IFA+CⅡ对动物的不良反应明显低于CFA+CⅡ。因此,IFA+CⅡ可作为制备CIA模型的首选方案,以保障实验结果的可靠性。

