大鼠异位心脏移植对心脏减负荷模型制作的价值
刘永辉?孟嘉天?孟自力?蔡会卿?刘何利?周香坦
【摘要】目的 探讨大鼠心脏减负荷模型的制作要点,为心力衰竭患者使用左心室辅助装置恢复机制提供实用模型。方法 同系29只lewis成年大鼠,通过结扎冠状动脉前降支形成缺血性心肌病,用UCG筛选符合心力衰竭条件的大鼠。将24只心力衰竭大鼠随机分为2组:减负荷组(n = 14)与心衰组(n = 10)。心衰组不进行心脏移植。减负荷组对心力衰竭大鼠心脏作为供体异位移植于受体腹部下腔静脉及腹主动脉,形成左心室减负荷模型。另设空白对照组(n = 8),这些大鼠仅仅接受开胸手术,而不实施冠状动脉前降支的结扎,其它处理方式同以上2组。实施心脏移植2周后,分别对3组小鼠进行检测。检测指标包括测量左室舒张末压、最大压力上升速率(+dp/dtmax)及左室收缩压,并作心脏病理切片检测组织学改变。结果 缺血性心肌病心力衰竭动物模型成功率为 82.76 %(24/29),心力衰竭大鼠进行心脏减负荷后的存活率是 71.43%(10/14)。与心衰组相比,减负荷组左心室发展压升高(47.85±0.94 vs. 35.94±0.95,F = 250.993,P < 0.05),左心室+dp/dtmax升高(1177.85±61.03 vs. 841.64±40.26,F = 942.304,P < 0.05)。結论 利用大鼠作为实验动物,通过先制作心肌梗死心力衰竭模型,再对其进行异位心脏移植,可作为经济、可重复的心室减负荷模型。
【关键词】动物模型,大鼠;左心室辅助装置;减负荷;心脏移植
Role of heterotopic heart transplantation in establishment of rat models with unloading the infarcted hearts Liu Yonghui△, Meng Jiatian, Meng Zili, Cai Huiqing, Liu Heli, Zhou Xiangtan. △Hebei Chest Hospital, Shijiazhuang 050041, China
Corresponding author, Meng Zili, E-mail: Dr_zilimeng@yahoo.com
【Abstract】Objective To investigate the highlights of establishing a rat model of mimicking left venticular assist device (LVAD) by unloading rat infarcted hearts. Methods 29 adult Lewis rats were ligated the left anterior discending arteries to shut the blood supply of myocardium to establish the infarcted heart failure rat models. Electrocardiogram (ECG) was performed to screen the rat models with heart failure. 24 heart failure rats were randomly divided into the unloading group (n = 14) and heart failure group (n = 10). Heart transplantation was not performed in the heart failure group. In the unloading group, the hearts of heart failure rats were prepared for heterotopic cardiac transplantation into the inferior vena cava and abdominal aorta of the recipient rats to establish the left ventricular unloading models. In the blank control group (n = 8), the rats were intervened with open surgery alone. The remaining interventions were similar to those in the other two groups. At 2 weeks after cardiac transplantation, the left ventricular end-diastolic pressure (LVEDP), maximum left ventricular pressure rising/falling rate (±dp/dtmax) and left ventricular systolic pressure (LVSP) were measured. Histological changes of the rat hearts were observed. Results The success rate of heart failure rat models after ischemic cardiomyopathy was 82.76% (24/29). The survival rate of heart failure rats after cardiac unloading was 71.43% (10/14). Compared with the heart failure group, the left ventricular developed pressure (LVDP) was significantly elevated (47.85±0.94 vs. 35.94±0.95,F = 250.993, P < 0.05) and the ±dp/dtmax was significantly increased (1177.85±61.03 vs. 841.64±40.26,
F = 942.304,P < 0.05) in the unloading group. Conclusion The rat models with heart failure can be established by myocardial infarction and subsequently receive heterotopic heart transplantation, which offers an economical and reproducible model of ventricular unloading.
【Key words】Animal model,rat; Left venticular assist device; Unloading; Cardiac transplantation
心力衰竭是人类健康的主要杀手之一。终末期心力衰竭药物治疗效果不佳,需要心脏移植或心室辅助装置。心室辅助装置,尤其是左心室辅助装置(LVAD)是用来部分替代心脏的泵血功能、维持良好全身循环状态的机械装置[1-2]。作为一种血泵,LVAD能够降低左室容量及压力负荷,通过增加肺静脉回流,降低右室后负荷,是治疗终末期心力衰竭的重要手段之一,除了具有心脏移植“桥梁”作用 ,还可以通过减少心肌梗死面积、保护心肌成为治疗终末期心脏病“心脏功能恢复的桥梁”,但其机制尚未清楚[1-4]。有关LVAD机制研究,通常通过猪、犬、羊等大动物进行试验,但其实验周期长、成本高昂[5-6]。因此,本试验以成本较低的大鼠为试验动物,先制作心力衰竭模型再进行心脏移植,制作心脏减负荷模型以模拟心室辅助装置,为下一步研究心室辅助装置改善心脏功能的机制创造条件。
材料与方法
一、实验动物
体质量180~220 g、同系lewis成年雄性大鼠29只,购于北京维通利华实验动物技术有限公司。本实验符合动物实验相关伦理规范。
二、实验仪器及器械
小动物麻醉呼吸机(Harvard ventilator model 683,美国Harvard公司)、UCG机(Philips Sonos 5500超声仪,探头频率12 MHz)、压力传感器(model ML110, AD Instruments Pty Ltd, 澳大利亞)、放大器(SP8502, Powerlab/8SP, AD Instuments Pty Ltd,澳大利亚)、手术器械(包括进口笔式持针器、7/0 PROLENE线等)。
三、实验方法
1. 制备大鼠心肌梗死模型
参考文献[7]使用29只180~220 g雄性lewis大鼠,使用683型小动物麻醉呼吸机,以氧气和异氟醚的混合气体进行吸入式麻醉。全身麻醉成功后,经第5肋间逐层切开各层组织,以左心耳下缘平齐位置作为标记,利用8/0 prolene线试结扎前降支,试结扎前降支10 s后松开结扎线以造成缺血预适应,再次彻底结扎前降支,见图1。本模型制作成功标准是心脏前壁局部颜色转为苍白、心电图显示有心肌梗死表现,有的可出现室性心律失常。模型制作成功后逐层缝合,于拔除气管插管前肌内注射0.1 mL(1.2万单位)长效青霉素。
2. 超声评价大鼠心肌梗死模型的制作
通过吸入氧气和异氟醚的混合气体来诱导麻醉大鼠(氧气量2 mL/min,异氟醚2~3 mL/min维持麻醉)。麻醉稳定后使用UCG进行大鼠心脏功能的检测。检测指标包括室腔于收缩及舒张期大小、左室前壁收缩及舒张厚度、对应左室后壁收缩及舒张厚度,计算LVEF、左室短轴缩短率(FS)[7-8]。再取二尖瓣血流入口处二维超声测量多普勒频谱,测量E峰、A峰、计算EA比值。典型大鼠心肌梗死后4周表现为左室短轴切面显示左室前壁、前间壁心肌结构消失,回声增强,运动幅度减低或消失,左室前壁部分室壁明显变薄。评价心肌梗死模型标准:①客观指标,心脏FS值< 30%;②主观指标,超声科医师判断至少有一个层面前壁室壁收缩运动明显异常。只有同时符合2个指标才可入选进行下一步试验。将符合标准的lewis大鼠随机分为2组。
3. 实验分组
将24只心力衰竭大鼠随机分为2组:减负荷组(n = 14)与心衰组(n = 10)。心衰组,对于心肌梗死心力衰竭大鼠不进行心脏移植。减负荷组将心肌梗死心力衰竭大鼠心脏移植于另一大鼠腹主动脉及下腔静脉内,使供体大鼠的升主动脉、肺动脉分别与受体大鼠的腹主动脉、下腔静脉相吻合,保持供体心脏始终跳动,同时,由于供体大鼠的左心室始终保持空跳,几乎不做功,从而心脏可以得到充分休息,达到心脏减负荷目的[7]。如果供体心脏存活良好则表现为心率在170~210次/分、心跳有力,如果腹部不能扪及心跳,则作为实验失败计算。另设空白对照组(n = 8),对于接受实验的大鼠仅仅实施开胸手术,但是对于大鼠的冠状动脉不进行结扎操作。在实施以上操作的2周后,分别对移植减负荷后的心力衰竭心脏、未行移植减负荷的心力衰竭心脏及正常心脏实施取材,进行下一步操作。
4. 大鼠心脏离体灌流心功能测定
在大鼠检测心脏UCG之后,用Langendoff模型行离体心功能测定。用10%乌拉坦(1.5 g/kg)腹腔注射进行全身麻醉后,通过舌下静脉注射肝素 (3 mg/kg),以防止血栓形成。随后,将大鼠置于动物手术台上、仰卧位,用碘伏消毒、铺巾后,行上腹部膈肌下横切口,逐层切开皮肤、皮下组织,注意勿伤及肝脏和脾脏,然后再纵行向上剪开膈肌、胸骨,显露心包及心脏、主动脉。在心包腔内倒入冰屑及冰水混合物。将心脏、主动脉连同肺脏一起取出,立即置于冰水混合物中[9]。仔细修剪心脏、主动脉、肺动脉,保留尽量长的升主动脉以便操作。将升主动脉接上灌流管,将乳胶囊经左心房切口置于大鼠左心室内,连接压力传感器和放大器,然后将左心耳剪开,排气以免气体进入冠状动脉,打开灌流开关,开始灌流。离体灌流液采用37℃ Krebs-Henseleit(KH)缓冲液 (pH 7.4,NaCl 118 mmol/L,KCl 4.7 mmol/L,
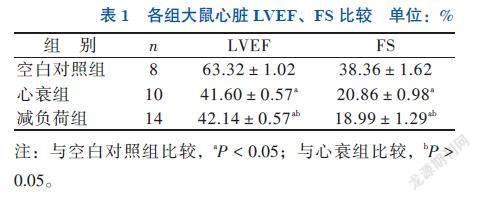
CaCl2 2.5 mmol/L,NaHCO3 25 mmol/L,KH2PO4 1.2 mmol/L,MgSO4 1.2 mmol/L,葡萄糖11 mmol/L)。在离体心脏灌流复跳稳定30 min后,检测心脏的离体功能。开始时将0.04 mL 0.9% NaCl注射液注射于左心室球囊,随后每次逐渐增加0.02 mL NaCl注射液,一直到左心室舒张末压力超过30 mm Hg
(1 mm Hg=0.133 kPa)为止。在每次注射0.9% NaCl注射液之后,等待描记曲线稳定后记录心率曲线、dp/dt曲线及左心室压力曲线,每次记录时间30 s。在实验结束后,使用POWERLAB配套软件Chart 4.0 for Windows计算每个测定点舒张末dp/dt、
舒张末压力、最大壓力上升速率(+dp/dtmax)、收缩末压力以及心率平均值,同时,需要计算左心室发展压(LVDP),LVDP =收缩末压力-舒张末压力。
5. 病理学检测
提前准备好10% KCl注射液10 mL,在心脏离体灌流实验后,立即经主动脉注入使心脏停搏,然后用0.9% Nacl注射液250 mL将心脏冲洗干净,最后将心脏放置于冰屑湿纱布上。每只大鼠的心脏部分用免疫组织化学染色、部分以10%中性甲醛固定准备用于石蜡切片检测。
四、统计学处理
应用 SPSS 22.0对数据进行统计分析。计量资料以 表示,多组间样本均数的比较用方差分析,两两比较用LSD-t检验,2组间定性资料进行χ2检验,以P < 0.05为差异有统计学意义。
结果
一、动物存活率
共取29只 lewis 大鼠做心肌梗死后心力衰竭模型,其成功率是 82.76% (24/29),死亡大多数发生于心肌梗死后 48 h;用心肌梗死后心力衰竭模型再次进行心脏异位移植制作心力衰竭后减负荷模型,其存活率是 71.43% (10/14) , 后者的死亡大多发生于术后 10 h,与国外文献相似[10]。
二、心功能的超声评价
与空白对照组相比,移植前减负荷组与心衰组LVEF下降,差异有统计学意义(P < 0.05),但减负荷组与心衰组间的LVEF比较差异无统计学意义(P > 0.05)。与空白对照组相比,移植前心衰组与减负荷组的FS下降,差异有统计学意义(F = 11.104,P < 0.05),但减负荷组与心衰组的FS比较差异无统计学意义(P > 0.05),见表1。
三、离体心脏灌注评价心功能
Langendorff 模型心功能评价结果显示,缺血性心脏病心力衰竭的心脏功能在减负荷2周后可以得到改善。与心衰组相比,在左心室球囊容积为0.04 mL时,减负荷组LVDP升高,差异有统计学意义(47.85±0.94 vs. 35.94±0.95,F = 250.993,P < 0.05), +dp/dtmax升高,差异有统计学意义(1177.85±61.03 vs. 841.64±40.26,F = 942.304,P < 0.05),见图2。
四、各组大鼠心脏组织学检查
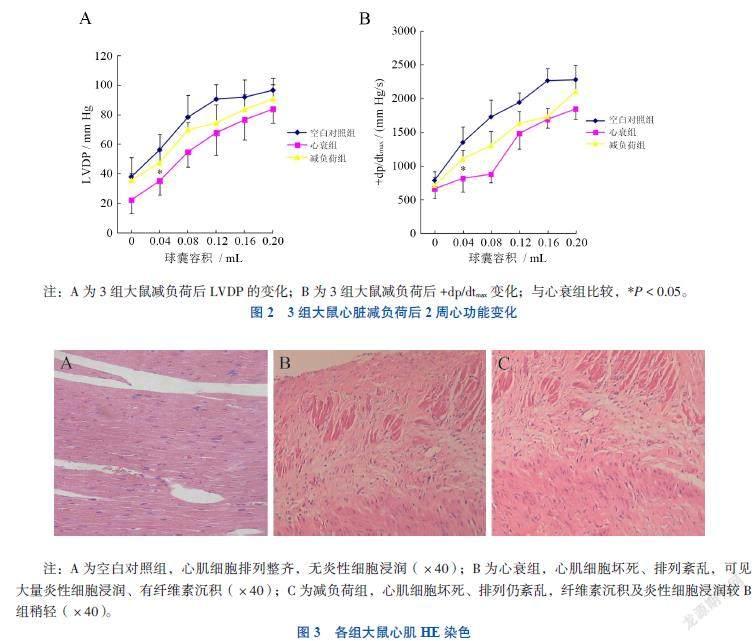
大鼠心肌HE染色显示各组心肌细胞排列及炎性细胞浸润情况:空白对照组心肌细胞排列整齐,无炎性细胞浸润;心衰组可见心肌细胞坏死、排列紊乱,有大量炎性细胞浸润及纤维素沉积;减负荷组心肌细胞坏死、排列仍紊乱,纤维素沉积及炎性细胞浸润较心衰组稍轻(图3)。
五、各组大鼠心肌天狼星红染色
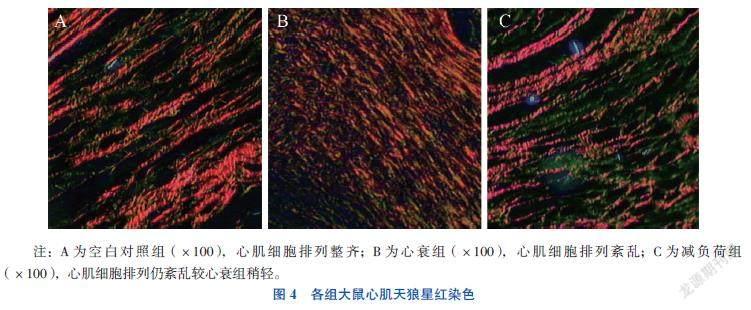
天狼星红染色将肌细胞染成黄色,胶原纤维染成红色。空白对照组心肌细胞排列整齐;心衰组心肌细胞排列紊乱;减负荷组心肌细胞排列仍紊乱较心衰组稍轻(图4)。
讨论
终末期心力衰竭单纯药物治疗效果不佳,往往需要心脏辅助装置、心脏泵或心脏移植[11-12]。其中,心室辅助尤其是LVAD可以部分替代心脏泵血功能,从而减轻心脏负荷,有力于心脏功能恢复,或可以使患者等到供体,也可促进干细胞的成活率。对于LVAD撤机的时机需要进一步了解,因为有的病种通过LVAD恢复快,而有的恢复差[13-14]。
在本试验中,血液循环的方向为:血液从(受体大鼠)腹主动脉流至(供体大鼠)升主动脉,然后 流到(供体大鼠)冠状动静脉,之后从(供体大鼠)右心房到(供体大鼠)右心室再流至(供体大鼠)肺动脉,最后到达(受体大鼠)下腔静脉,由于(供体大鼠)左心室不参与循环,处于半休息状态无负荷异位心,从而使(供体大鼠)左心负荷减轻,这一点与临床上左心辅助装置有一定相似之处。
本试验创新点在于先制作缺血性心力衰竭模型,在此基础上,对缺血性心力衰竭大鼠再进行心脏减负荷的模型制作,因此,更能模拟临床上缺血性心肌病的临床实践[12, 14]。2005年Mizuno等[15]进行了大鼠心脏减负荷和再负荷试验,但做实验使用的是正常大鼠的心脏,其心脏减负荷不能等同于心肌梗死心力衰竭心脏减负荷模型。因此,不能很好地模拟临床上缺血性心肌病的心脏减负荷,以至于使用这种模型进行减负荷的机理探讨有一定局限性。
在试验中尤其需要注意以下几点:①要有良好的供心保护,a.提前准备好冰屑,在打开供体的胸腔后立即将冰屑置于心脏周围以便使供心迅速降温停跳,从而减少供心在无氧代谢下的能量损耗;b.在整个心脏移植手术过程中始终在供心周围放置冰屑从而使之持续降温,达到低温保护[9]。②供体肝素化的问题,为了防止损伤心肌,在经下腔静脉注射肝素盐水时不能注射太快[9, 16]。③减少术中出血,a.吻合口出血是开放血管后出血的主要原因[7]。在检测动脉吻合口、准备开放近端血管夹时,可采取多次间断放松血管夹的方式,通过这种方式,动脉内的血液压力可以使得吻合口的缝线排列更趋于均匀分布,从而使得针眼处有凝血机会,达到止血目的。在这些操作基础上,如果动脉出血仍较多,则需要在出血部位增加缝合1~2针以便止血,同时适量补液以补充丢失的液体;b.防止损伤心耳,在手术中不要用器械尖端直接钳夹心耳,可以防止损伤心耳,从而减少出血;c.在分离下腔静脉和腹主动脉时,应使用显微镊轻轻牵开静脉与动脉之间的疏松组织,然后稍加分离至足够的长度。如果吻合段内腹主动脉的后壁有小血管分支,可以在无血管区穿线进行结扎。④缩短供体心冷缺血时间,先显露并游离好受体血管的吻合段,之后再获取供心,这样可以缩短供体心脏的冷缺血时间[9]。⑤预防血栓形成,将供心迅速取下之后立即放入冰的生理盐水中,并轻轻挤压心脏使心腔内残余血液尽快流出来,从而避免血栓形成[14]。
综上所述,以大鼠为实验动物,先制作缺血性心力衰竭模型,在此基础上再通过心脏异位移植的方式,可以构建心室辅助减负荷的动物模型,该模型费用相对低、可重复性好、操作相对简单,易于推广及进行进一步研究。
参 考 文 献
[1] Monteagudo Vela M, Rial Bastón V, Panoulas V, et al. A detailed explantation assessment protocol for patients with left ventricular assist devices with myocardial recovery. Interact Cardiovasc Thorac Surg, 2021, 32(2): 298-305.
[2] Brice?o D F, Fernando R R, Nathan S, et al. TandemHeart as a bridge to recovery in legionella myocarditis. Tex Heart Inst J, 2015, 42(4): 357-361.
[3] Kapur N K, Reyelt L, Swain L, et al. Mechanical left ventricular unloading to reduce infarct size during acute myocardial infarction: insight from preclinical and clinical studies. J Cardiovasc Transl Res, 2019, 12(2): 87-94.
[4] Uriel N, Sayer G, Annamalai S, et al. Mechanical unloading in heart failure. J Am Coll Cardiol, 2018, 72(5): 569-580.
[5] Udesen N L J, Helgestad O K L, Banke A B S, et al. Impact of concomitant vasoactive treatment and mechanical left ventricular unloading in a porcine model of profound cardiogenic shock. Crit Care, 2020, 24(1): 95.
[6] Josiassen J, Helgestad O K L, Udesen N L J, et al. Unloading using Impella CP during profound cardiogenic shock caused by left ventricular failure in a large animal model: impact on the right ventricle. Intensive Care Med Exp, 2020, 8(1): 41.
[7] Benke K, Sayour A A, Mátyás C, et al. Heterotopic abdominal rat heart transplantation as a model to investigate volume dependency of myocardial remodeling. Transplantation, 2017, 101(3): 498-505.
[8] 金丹丹, 林晖, 唐关敏. 三七总皂苷治疗大鼠心肌梗死的作用及其机制研究. 新医学, 2019, 50(7): 519-526.
[9] Ibrahim M, Navaratnarajah M, Kukadia P, et al. Heterotopic abdominal heart transplantation in rats for functional studies of ventricular unloading. J Surg Res, 2013, 179(1): e31-e39.
[10] Tsuneyoshi H, Oriyanhan W, Kanemitsu H, et al. Heterotopic transplantation of the failing rat heart as a model of left ventricular mechanical unloading toward recovery. Asaio J, 2005, 51(1):116-120.
[11] Saku K, Kakino T, Arimura T, et al. Left ventricular mechanical unloading by total support of impella in myocardial infarction reduces infarct size, preserves left ventricular function, and prevents subsequent heart failure in dogs. Circ Heart Fail, 2018, 11(5): e004397.
[12] Tomasoni D, Adamo M, Anker M S, et al. Heart failure in the last year: progress and perspective. ESC Heart Fail, 2020, 7(6): 3505-3530.
[13] Rossing K, Gustafsson F. Medical and mechanical unloading in advanced heart failure: hope for cardiac recovery? Eur J Heart Fail, 2018, 20(1): 175-177.
[14] Shahinian J H, Rog-Zielinska E A, Schlimpert M, et al. Impact of left ventricular assist device therapy on the cardiac proteome and metabolome composition in ischemic cardiomyopathy. Artif Organs, 2020, 44(3): 257-267.
[15] Mizuno T, Weisel R D, Li R K. Reloading the heart: a new animal model of left ventricular assist device removal. J Thorac Cardiovasc Surg, 2005, 130(1): 99-106.
[16] Chien C Y, Hsu R B, Ko W J, et al. Ventricular remodeling of the native heart after heterotopic heart transplantation. J Formos Med Assoc, 2000, 99(11): 854-856.
(收稿日期:2021-09-13)
(本文編辑:杨江瑜)

