三种阿魏不同极性部位的抗炎活性谱效关系研究
孙佳楠,马若婷,赵生俊,张海英,3*
(1.新疆医科大学第四临床医学院,新疆 乌鲁木齐830000;2.新疆医科大学附属中医医院,新疆 乌鲁木齐830000;3.新疆中药炮制研究重点实验室,新疆 乌鲁木齐830000)
阿魏系伞形科(Umbelliferae)阿魏属(FerulaL.)植物,我国目前有26种,主产于新疆地区[1]。《中华人民共和国药典》收录的阿魏品种为伞形科植物新疆阿魏(FerulasinkiangensisK.M.Shen)和阜康阿魏(FerulafukanensisK.M.Shen),其药用部位是树脂[2]。阿魏始载于《新修本草》,被列为中品[3],载有消积、杀虫等功效。阿魏属植物含有多种活性化学成分,主要包括香豆素类、倍半萜类、含硫化合物等。现代药理研究发现,阿魏具有抗炎、抗过敏、抗菌、抗肿瘤、抗溃疡及解痉镇痛等药理作用[4]。
国内外学者[5-7]研究发现,阿魏有明确的抗炎作用,但其抗炎作用药效物质基础尚不明晰。中药谱效关系是指以中药指纹图谱为基础,以中药药效学为主要内容,应用生物信息学的方法进行分析和整合,建立指纹图谱与疗效之间的关系[8-9]。通过对“谱”与“效”相互作用关系的研究,揭示不同种中药药效的物质基础。作者所在课题组前期已完成小鼠耳肿胀抗炎实验,发现新疆阿魏、阜康阿魏、多伞阿魏等3种阿魏乙醇提取物均对小鼠耳肿胀造成的急性炎症有一定的抑制作用。在此基础上,作者建立脂多糖(LPS)诱导的小鼠巨噬细胞RAW264.7炎症模型,以LPS诱导的小鼠巨噬细胞RAW264.7产生的NO含量为主要药效指标[10-11],通过双变量Pearson相关分析法进行谱效关系研究,拟筛选出3种阿魏的抗炎活性部位。
1 实验
1.1 材料、试剂与仪器
新疆阿魏(FerulasinkiangensisK.M.Shen)(2018年4月采集于伊宁县拜石墩)、阜康阿魏(FerulafukanensisK.M.Shen)(2018年4月采集于阜康市紫泥泉镇)、多伞阿魏(Ferulaferulaeoides)(2018年4月采集于石河子南山),经新疆医科大学附属中医医院李永和主任中药师鉴定符合《中国植物志》[12]的记载;小鼠巨噬细胞RAW264.7,中国科学院上海细胞研究所。
石油醚(60~90 ℃,批号20170518),分析纯,百世化工有限公司;二氯甲烷(批号20150817)、正丁醇(批号20160216),分析纯,河东区红岩试剂厂;乙酸乙酯(批号2018032014),分析纯,天津致远化学试剂厂;水饱和正丁醇;脂多糖(LPS,批号L-2880)、二甲基亚砜(DMSO,批号67685TT)、MTT(批号EZ2811D347),美国 Sigma 公司;磷酸盐缓冲溶液(PBS,批号AC10257442)、青霉素/链霉素溶液(批号J170016)、胎牛血清(FBS,批号F160123),美国 Hyclone 公司;改良型RPMI-1640完全培养基(批号AD16192263),美国 Gibco公司;NO检测试剂盒(S0021-Griess试剂,批号052218180906),碧云天生物技术有限公司;实验用水为蒸馏水。
AL 204型电子天平,梅特勒-托利多仪器有限公司;超声波清洗机,上海科导超声仪器有限公司;TGL-16B型台式离心机,上海安亭科学仪器厂;Waters2695型高效液相色谱仪,美国Waters;ZHJH-C1112B型超净工作台,上海智诚;IX71-12FL/PH型倒置荧光显微镜,Olympus公司;S-79943型全波长扫描式多功能读数仪(Multiskan酶标仪)、二氧化碳培养箱,美国 Thermo 公司。
1.2 3种阿魏不同极性部位提取物的制备
将阿魏根切碎晾干,用5 倍体积的95%乙醇回流提取3次,每次2 h;过滤,合并滤液,于70~85 ℃水浴锅蒸干,待无醇味即得乙醇提取物稠浸膏。将乙醇提取物稠浸膏用硅藻土拌样,按极性从小到大依次加入5倍体积的石油醚、二氯甲烷、乙酸乙酯、水饱和正丁醇、蒸馏水,超声提取30 min(频率53 kHz、功率250 W,下同),每个极性部位提取5次;将滤液减压浓缩,蒸干,即得不同极性部位干浸膏。除石油醚部位采用70 ℃水浴蒸干外,其它各部位均采用100 ℃快速水浴蒸干除溶剂。
1.3 3种阿魏不同极性部位对小鼠巨噬细胞RAW264.7的抗炎实验
1.3.1 细胞培养
将小鼠巨噬细胞RAW264.7加入RPMI-1640完全培养基(含10%胎牛血清及1%青链霉素双抗)中,于37 ℃、5%CO2培养箱中传代培养,次日换液。
1.3.2 小鼠巨噬细胞RAW264.7炎症模型的建立
取对数生长期的小鼠巨噬细胞RAW264.7,调整细胞密度为2×106个·mL-1,接种于96孔板中,每孔 100 μL,置于37 ℃、5%CO2培养箱中培养24 h;每孔加入浓度梯度为25 μg·mL-1、12.5 μg·mL-1、6.25 μg·mL-1的阳性对照药物地塞米松溶液100 μL;作用4 h后加入100 μL 5 μg·mL-1LPS,与细胞共同孵育24 h。每种浓度设6个平行对照孔。
1.3.3 MTT比色法检测细胞活性
取对数生长期的小鼠巨噬细胞RAW264.7,调整细胞密度为2×106个·mL-1,接种于96孔板中,每孔 100 μL,置于37 ℃、5%CO2培养箱中培养24 h。空白组(无细胞,仅加RPMI-1640完全培养基)、正常对照组吸取上清液后每孔加入RPMI-1640完全培养基100 μL;各处理组吸弃上清液后分别加入含3种阿魏不同极性部位提取物的RPMI-1640完全培养基100 μL,浓度(μg·mL-1)分别为200、100、50、25、12.5、6.25。每组6个复孔,给药后培养24 h,每孔加入100 μL稀释好的MTT检测液,继续培养4 h,弃上清液,每孔加入150 μL DMSO,置于摇床上低速振荡15 min,用酶标仪检测490 nm处吸光度(OD)。按下式计算细胞存活率:

1.3.4 Griess试剂法检测细胞上清液NO含量
取对数生长期的小鼠巨噬细胞RAW 264.7,调整细胞密度为2×106个·mL-1,接种于96孔板中,每孔100 μL,于37 ℃、5%CO2培养箱中培养24 h;细胞贴壁后,弃上清液,分为正常对照组、LPS对照组、样品处理组。正常对照组加入RPMI-1640完全培养基200 μL;LPS对照组加入含5 μg·mL-1LPS的RPMI-1640完全培养基200 μL;样品处理组:经前期MTT比色法筛选浓度,每孔加入3种阿魏不同极性部位提取物药液100 μL,每种药液稀释成3个浓度,作用4 h后每孔加入5 μg·mL-1LPS 100 μL。每组6个复孔,孵育24 h,收集上清液,采用Griess试剂法检测细胞上清液NO含量。
1.4 3种阿魏的HPLC分析
1.4.1 色谱条件
流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱程序为:0~25 min,25%~40%A;25~35 min,40%A;35~55 min,50%A;55~100 min,45%~80%A。流速1.0 mL·min-1;检测波长323 nm;柱温30 ℃;进样量10 μL。
1.4.2 供试溶液的制备
精密称取3种阿魏不同极性部位提取物各0.2 g,置于50 mL具塞锥形瓶中,加入25 mL甲醇,精密称定其质量,超声30 min,待冷却后,用甲醇补充减失的质量,过0.45 μm滤膜,即得供试溶液。
1.4.3 谱效关系分析
对3种阿魏不同极性部位提取物的HPLC主要色谱峰峰面积分析数据与同一浓度下NO含量进行分析,研究两者的相关性。另外,将具有显著相关性的色谱峰与标准品的HPLC图谱、紫外光谱、氢谱、碳谱进行对照,进行化合物初步鉴定。
1.5 相关性分析

2 结果与讨论
2.1 小鼠巨噬细胞RAW264.7炎症模型的建立
地塞米松溶液对细胞活力和NO浓度的影响见表1。

表1 地塞米松溶液对细胞活力和NO浓度的影响(n=6)Tab.1 Effect of Dexamethasone solution on cell viability and NO concentration(n=6)
由表1可知,与LPS对照组比较,地塞米松各浓度处理组的NO浓度均非常显著降低(P<0.01),并具有剂量依赖性;LPS对照组的NO浓度远高于正常对照组,表明小鼠巨噬细胞RAW264.7炎症模型成功建立,且稳定性较好。
2.2 MTT比色法检测细胞活性结果
采用MTT比色法测定细胞活性,计算3种阿魏不同极性部位的细胞存活率(表2~4),各筛选出3个浓度:95%乙醇提取物浓度梯度为50 μg·mL-1、25 μg·mL-1、12.5 μg·mL-1;石油醚部位浓度梯度为25 μg·mL-1、12.5 μg·mL-1、6.25 μg·mL-1;二氯甲烷部位浓度梯度为12.5 μg·mL-1、6.25 μg·mL-1、3.125 μg·mL-1;乙酸乙酯部位浓度梯度为50 μg·mL-1、25 μg·mL-1、12.5 μg·mL-1;水饱和正丁醇部位浓度梯度为25 μg·mL-1、12.5 μg·mL-1、6.25 μg·mL-1;水部位浓度梯度为50 μg·mL-1、25 μg·mL-1、12.5 μg·mL-1。

表2 新疆阿魏不同极性部位的细胞存活率Tab.2 Cell survival rate of different polar extracts of Ferula sinkiangensis K.M.Shen

表3 阜康阿魏不同极性部位的细胞存活率Tab.3 Cell survival rate of different polar extracts of Ferula fukanensis K.M.Shen
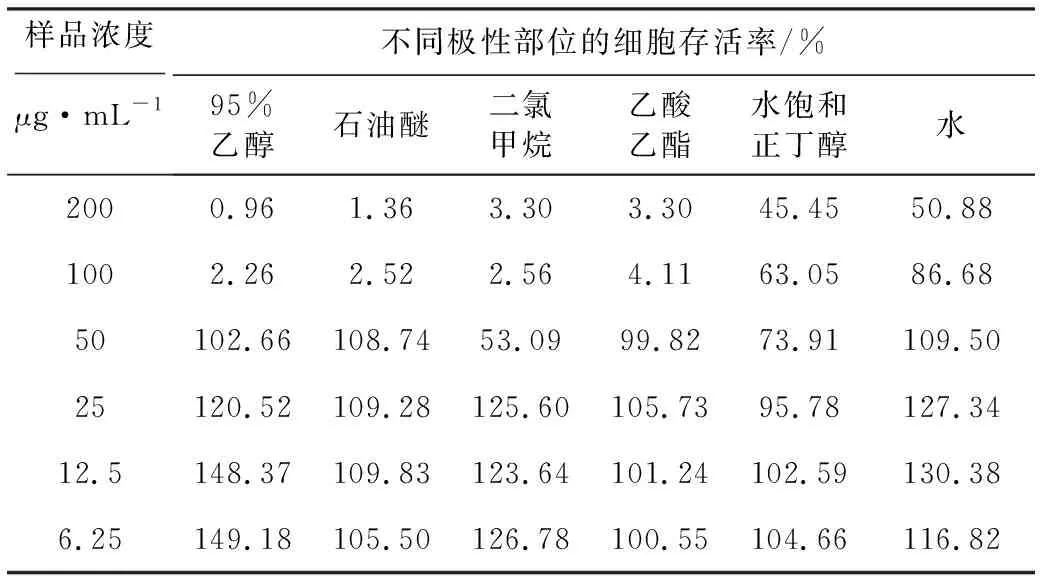
表4 多伞阿魏不同极性部位的细胞存活率Tab.4 Cell survival rate of different polar extracts of Ferula ferulaeoides
2.3 3种阿魏不同极性部位提取物的抗炎活性
2.3.1 3种阿魏95%乙醇提取物对NO浓度的影响(表5)
由表5可知,小鼠巨噬细胞RAW264.7经3种阿魏95%乙醇提取物作用24 h后,经5 μg·mL-1LPS刺激,能够释放出大量NO,与正常对照组比较有非常显著性差异(P<0.01);与LPS对照组比较,3种阿魏各浓度95%乙醇提取物处理组的NO浓度均非常显著降低(P<0.01),表明3种阿魏95%乙醇提取物均有一定的抗炎活性。
2.3.2 3种阿魏石油醚部位对NO浓度的影响(表6)
由表6可知,小鼠巨噬细胞RAW264.7经3种阿魏石油醚部位作用24 h后,经5 μg·mL-1LPS刺激,能够释放出大量NO,与正常对照组比较有非常显著性差异(P<0.01);与LPS对照组比较,阜康阿魏石油醚部位高浓度(25 μg·mL-1)处理组的NO浓度显著降低(P<0.05),其余浓度均无明显变化。表明,阜康阿魏石油醚部位有一定的抗炎活性,新疆阿魏、多伞阿魏石油醚部位可能无抗炎活性。
2.3.3 3种阿魏二氯甲烷部位对NO浓度的影响(表7)

表7 3种阿魏二氯甲烷部位对NO浓度的影响(n=6)Tab.7 Effect of methylene chloride extract of three kinds of Ferula on NO concentration(n=6)
由表7可知,小鼠巨噬细胞RAW264.7经3种阿魏二氯甲烷部位作用24 h后,经5 μg·mL-1LPS刺激,能够释放出大量NO,与正常对照组比较有非常显著性差异(P<0.01);与LPS对照组比较,新疆阿魏二氯甲烷部位高浓度(12.5 μg·mL-1)处理组的NO浓度非常显著降低(P<0.01),阜康阿魏、多伞阿魏二氯甲烷部位高浓度(12.5 μg·mL-1)、中浓度(6.25 μg·mL-1)处理组的NO浓度均非常显著降低(P<0.01)。表明,3种阿魏二氯甲烷部位均有一定的抗炎活性。
2.3.4 3种阿魏乙酸乙酯部位对NO浓度的影响(表8)
由表8可知,小鼠巨噬细胞RAW264.7经3种阿魏乙酸乙酯部位作用24 h后,经5 μg·mL-1LPS刺激,能够释放出大量NO,与正常对照组比较有非常显著性差异(P<0.01);与LPS对照组比较,新疆阿魏乙酸乙酯部位高浓度(50 μg·mL-1)、中浓度(25 μg·mL-1)处理组的NO浓度均非常显著降低(P<0.01),阜康阿魏乙酸乙酯部位各浓度处理组的NO浓度均非常显著降低(P<0.01),多伞阿魏乙酸乙酯部位高浓度(50 μg·mL-1)、中浓度(25 μg·mL-1)处理组的NO浓度均非常显著降低(P<0.01)。表明,3种阿魏乙酸乙酯部位均有一定的抗炎活性。

表8 3种阿魏乙酸乙酯部位对NO浓度的影响(n=6)Tab.8 Effect of ethyl acetate extract of three kinds of Ferula on NO concentration(n=6)
2.3.5 3种阿魏水饱和正丁醇部位对NO浓度的影响(表9)
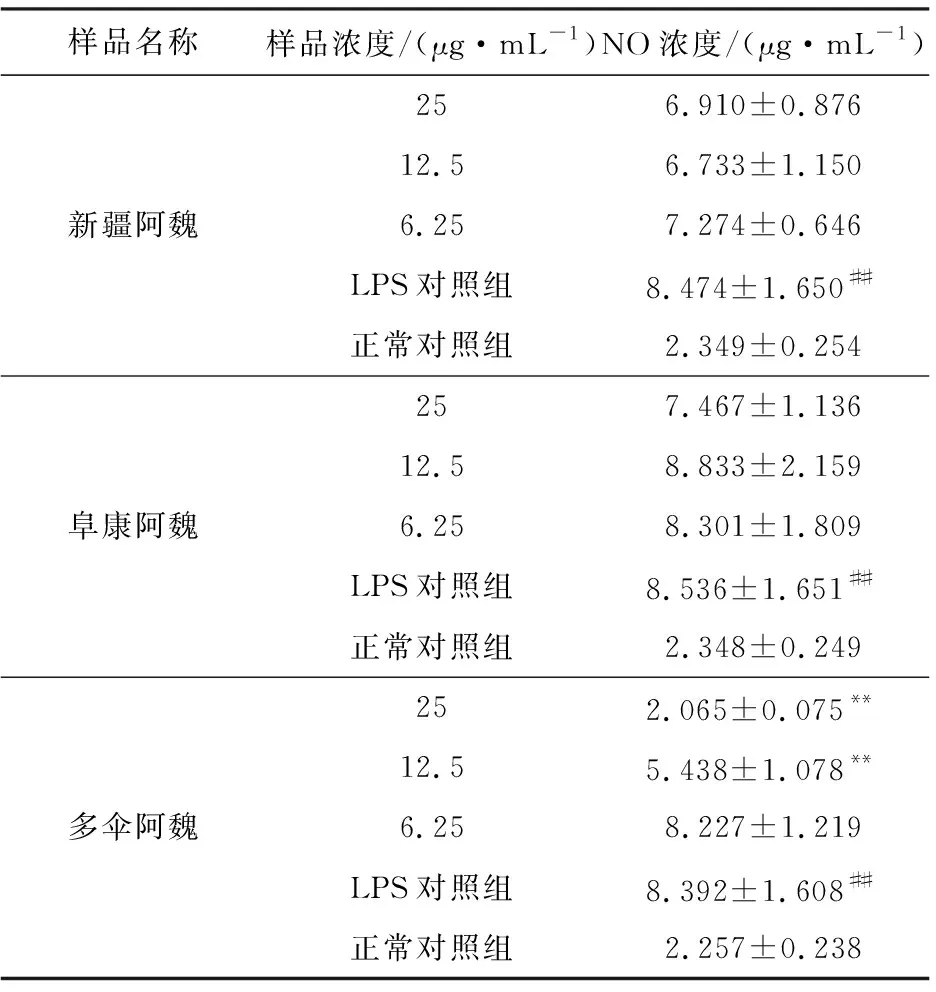
表9 3种阿魏水饱和正丁醇部位对NO浓度的影响(n=6)Tab.9 Effect of water-saturated butanol extract of three kinds of Ferula on NO concentration(n=6)
由表9可知,小鼠巨噬细胞RAW264.7经3种阿魏水饱和正丁醇部位作用24 h后,经5 μg·mL-1LPS刺激,能够释放出大量NO,与正常对照组比较有显著性差异(P<0.01);与LPS对照组比较,多伞阿魏水饱和正丁醇部位高浓度(25 μg·mL-1)、中浓度(12.5 μg·mL-1)处理组的NO浓度均非常显著降低(P<0.01),其它处理组无明显变化。表明,新疆阿魏、阜康阿魏水饱和正丁醇部位无明显抗炎活性,多伞阿魏水饱和正丁醇部位有一定的抗炎活性。
2.3.6 3种阿魏水部位对NO浓度的影响(表10)

表10 3种阿魏水部位对NO浓度的影响(n=6)Tab.10 Effect of water extract of three kinds of Ferula on NO concentration(n=6)
由表10可知,小鼠巨噬细胞RAW264.7经3种阿魏水部位作用24 h后,经5 μg·mL-1LPS刺激后,能够释放出大量NO,与正常对照组比较有非常显著性差异(P<0.01);与LPS对照组比较,3种阿魏水部位处理组的NO浓度无明显变化。表明,3种阿魏水部位没有抗炎活性。
2.4 3种阿魏不同极性部位的HPLC分析(图1)
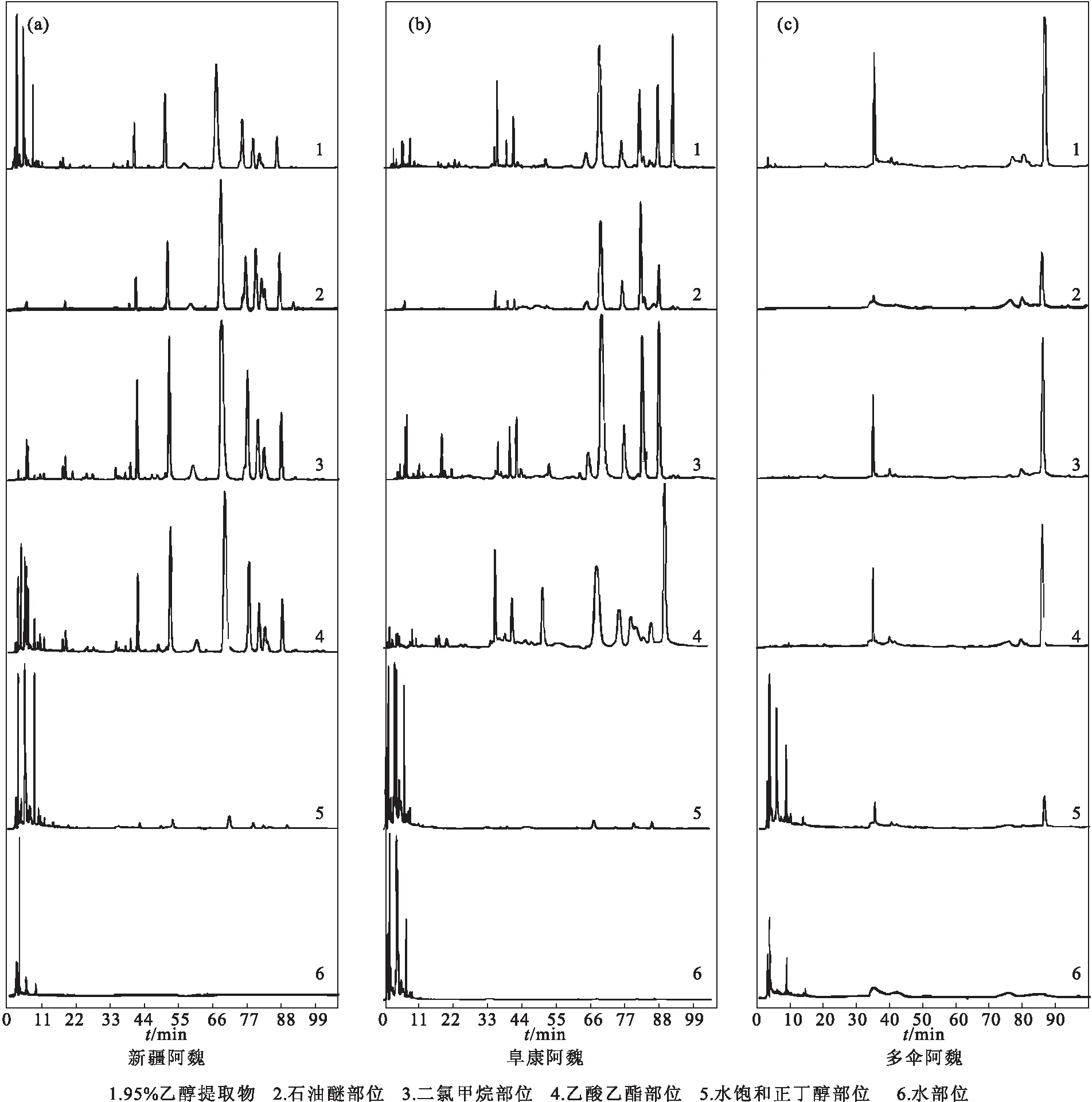
图1 新疆阿魏(a)、阜康阿魏(b)、多伞阿魏(c)的HPLC图谱Fig.1 HPLC spectra of Ferula sinkiangensis K.M.Shen(a),Ferula fukanensis K.M.Shen(b),and Ferula ferulaeoides(c)
3种阿魏不同极性部位各色谱峰所代表的化学成分的种类及含量有明显的差异性。为了进行直观的观察,列举出每种阿魏主要色谱峰的峰面积,结果见表11~13。
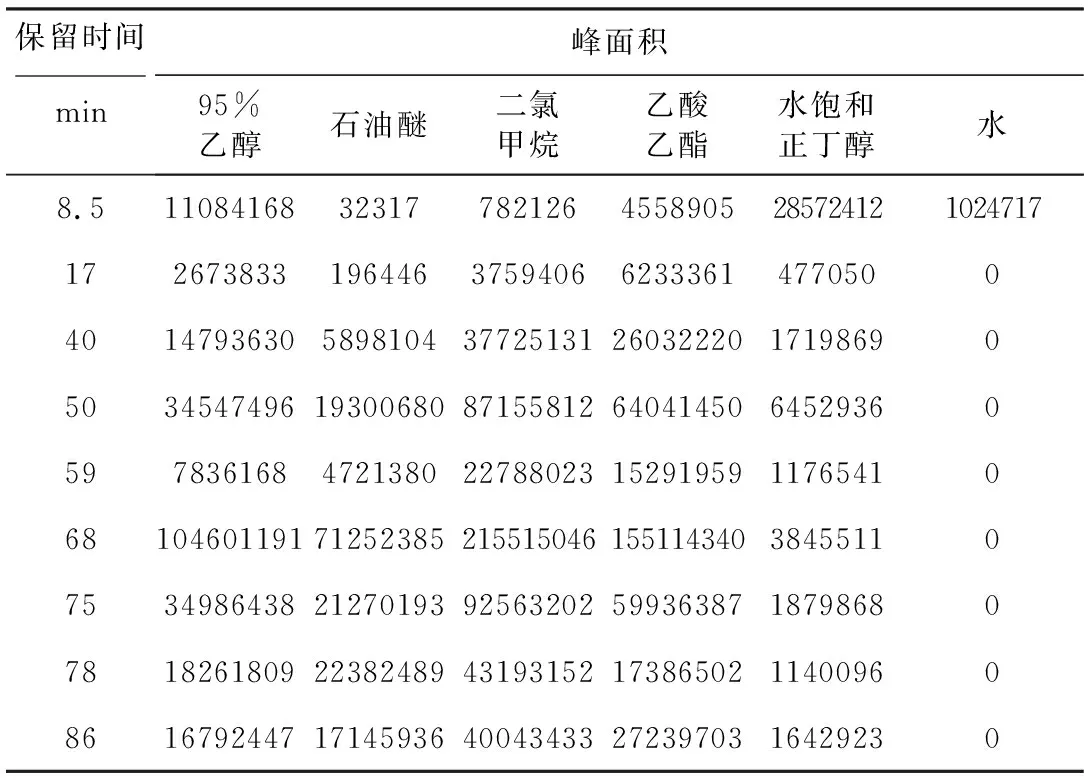
表11 新疆阿魏HPLC图谱中主要色谱峰的峰面积Tab.11 Peak areas of main chromatographic peaks in HPLC spectrum of Ferula sinkiangensis K.M.Shen
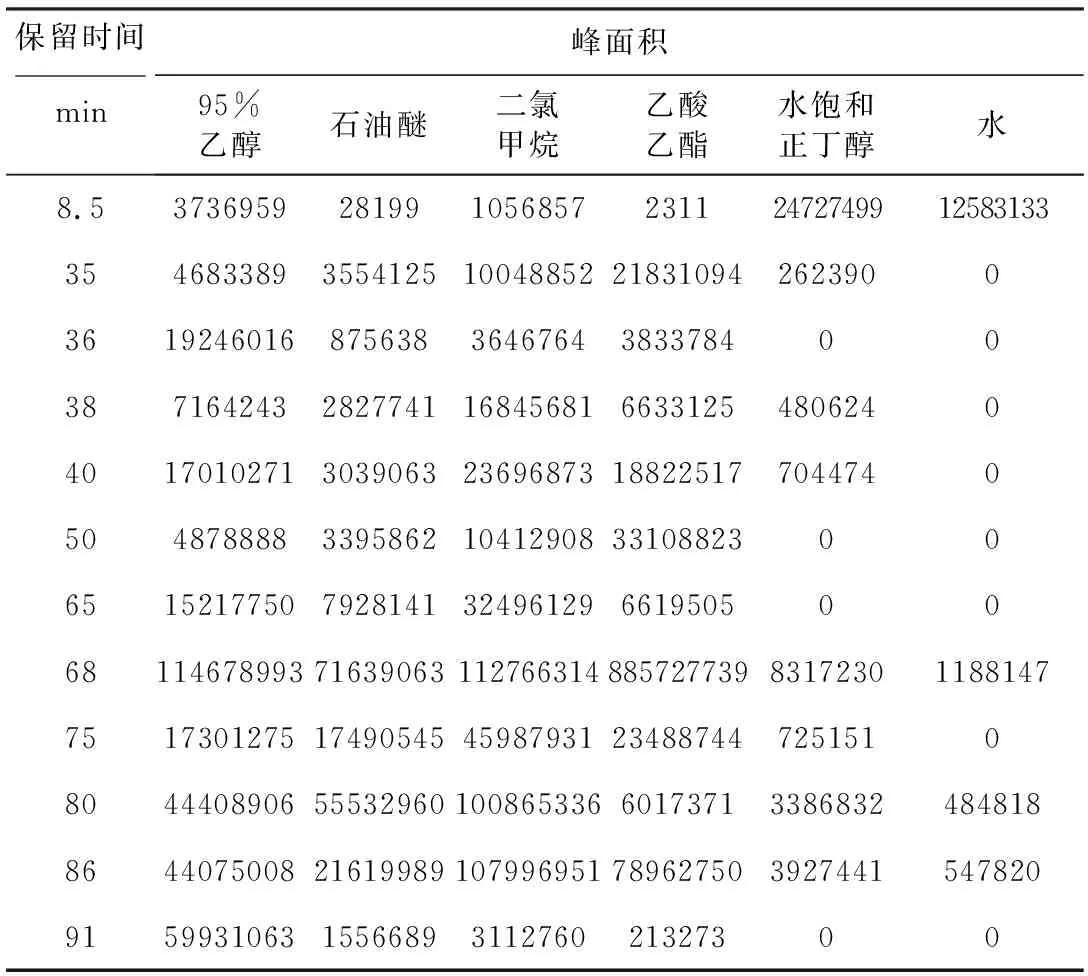
表12 阜康阿魏HPLC图谱中主要色谱峰的峰面积Tab.12 Peak areas of main chromatographic peaks in HPLC spectrum of Ferula fukanensis K.M.Shen
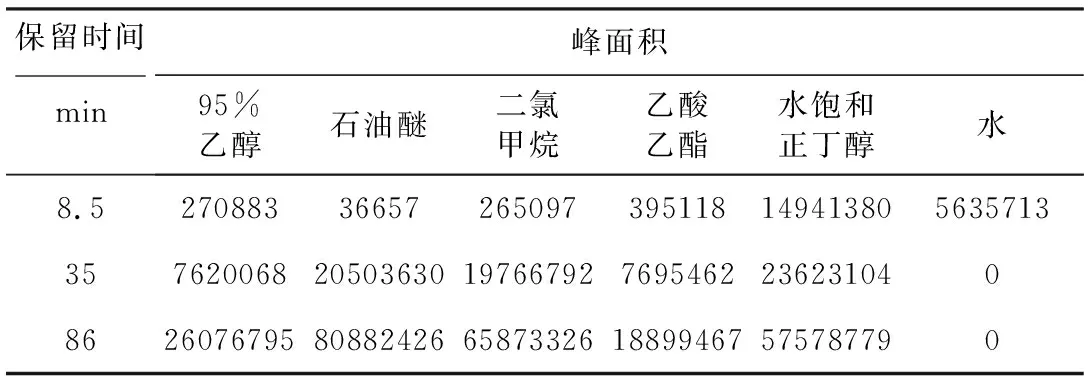
表13 多伞阿魏HPLC图谱中主要色谱峰的峰面积Tab.13 Peak areas of main chromatographic peaks in HPLC spectrum of Ferula ferulaeoides
2.5 3种阿魏不同极性部位的HPLC图谱与NO含 量的相关分析结果(表14~16)

表14 新疆阿魏HPLC图谱中主要色谱峰变量与NO含量的相关分析Tab.14 Correlation analysis between main chromatographic peak variables in HPLC spectrum of Ferula sinkiangensis K.M.Shen and NO content
由表14~16可知,3种阿魏除在保留时间8.5 min处的色谱峰外,其余主要色谱峰变量与NO含量之间呈负相关。新疆阿魏在保留时间40 min、68 min、75 min、78 min处的色谱峰变量与NO含量具有显著负相关性;阜康阿魏在保留时间38 min、40 min、65 min、68 min、75 min、86 min处的色谱峰变量与NO含量具有显著负相关性,其中68 min处具有非常显著相关性;多伞阿魏在保留时间35 min、86 min处的色谱峰变量与NO含量具有显著负相关性。具有显著负相关性的色谱峰代表的化学成分可能是3种阿魏的主要抗炎活性成分。

表15 阜康阿魏HPLC图谱中主要色谱峰变量与NO含量的相关分析Tab.15 Correlation analysis between main chromatographic peak variables in HPLC spectrum of Ferula fukanensis

表16 多伞阿魏HPLC图谱中主要色谱峰变量与NO含量的相关分析Tab.16 Correlation analysis between main chromatographic peak variables in HPLC spectrum of Ferula ferulaeoides and NO content
2.6 化合物结构的初步鉴定
基于课题组前期对新疆阿魏树脂进行化合物单体的分离和结构解析,经单体HPLC图谱、紫外光谱、氢谱、碳谱进行对照,将新疆阿魏和阜康阿魏在保留时间68 min、75 min处及阜康阿魏和多伞阿魏在保留时间86 min处具有显著抗炎活性的共有色谱峰分别鉴定为化合物fekrynol(托里阿魏诺醇)、lehmannolol(大果阿魏醇)和lehmannolone(大果阿魏酮),其氢谱及碳谱数据如下:
化合物fekrynol:1HNMR(CDCl3,400 MHz),δ:1.17(2H,m,H-1′),1.53(1H,m,H-2′a),1.84(1H,m,H-2′b),3.61(2H,t,J=5.6 Hz,H-3′),1.88(1H,m,H-6′a),2.47(1H,d,J=12.8 Hz,H-6′b),1.39(2H,m,H-7′),1.23(1H,m,H-8′),2.89(1H,dd,J=10.8 Hz、4.4 Hz,H-10′),3.67(1H,d,J=8.4 Hz,H-11′a),3.86(1H,d,J=8.4 Hz,H-11′b),0.87(3H,d,J=6.8 Hz,H-12′),1.43(3H,s,H-13′),1.59(3H,s,H-14′),1.10(3H,s,H-15′),6.20(1H,d,J=9.2 Hz,H-3),7.60(1H,d,J=9.6 Hz,H-4),7.31(1H,d,J=8.8 Hz,H-5),6.78(1H,d,J=8.8 Hz,H-6),6.73(1H,brs,H-8);13CNMR(CDCl3,100 MHz),δ:161.2(C-2),112.8(C-3),143.4(C-4),128.4(C-5),113.0(C-6),162.8(C-7),101.1(C-8),155.8(C-9),112.1(C-10),22.4(C-1′),30.7(C-2′),63.4(C-3′),124.8(C-4′),130.3(C-5′),24.4(C-6′),32.0(C-7′),34.7(C-8′),40.7(C-9′),43.0(C-10′),71.7(C-11′),16.0(C-12′),20.1(C-13′),20.2(C-14′),22.4(C-15′)。
化合物lehmannolol:1HNMR(CDCl3,400 MHz),δ:1.51(1H,ov,H-1′a),2.03(1H,m,H-1′b),1.29(1H,ov,H-2′a),2.08(1H,m,H-2′b),3.37(1H,td,J=10.4 Hz、5.6 Hz,H-3′),1.11(1H,m,H-4′),1.29(1H,ov,H-6′a),1.45(1H,ov,H-6′b),1.93(1H,m,H-7′a),1.29(1H,m,H-7′b),1.79(1H,m,H-8′),3.71(1H,d,J=8.8 Hz,H-11′a),3.64(1H,d,J=8.8 Hz,H-11′b),0.92(3H,d,J=7.0 Hz,H-12′),0.93(3H,d,J=7.0 Hz,H-13′),0.85(3H,s,H-14′),1.05(3H,s,H-15′),6.21(1H,d,J=9.6 Hz,H-3),7.60(1H,d,J=9.2 Hz,H-4),7.33(1H,d,J=8.4 Hz,H-5),6.81(1H,d,J=8.4 Hz,H-6),6.78(1H,brs,H-8);13CNMR(CDCl3,100 MHz),δ:161.1(C-2),112.9(C-3),143.3(C-4),128.6(C-5),112.9(C-6),162.4(C-7),101.4(C-8),155.8(C-9),112.3(C-10),20.9(C-1′),36.3(C-2′),71.6(C-3′),52.8(C-4′),37.8(C-5′),32.4(C-6′),25.1(C-7′),35.3(C-8′),39.0(C-9′),44.5(C-10′),76.0(C-11′),14.7(C-12′),9.8(C-13′),14.1(C-14′),19.9(C-15′)。
化合物lehmannolone:1HNMR(CDCl3,400 MHz),δ:1.75~1.88(2H,m,H-1′),2.26~2.38(2H,m,H-2′),2.27(1H,ov,H-4′),1.48(1H,m,H-6′a),1.39(1H,m,H-6′b),1.92(1H,m,H-7′a),1.37(1H,m,H-7′b),1.85(1H,m,H-8′),2.04(1H,dd,J=11.5 Hz、4.4 Hz,H-10′),3.73(2H,m,H-11′),0.98(3H,d,J=6.8 Hz,H-12′),0.88(3H,d,J=6.4 Hz,H-13′),0.77(3H,s,H-14′),1.07(3H,s,H-15′),6.20(1H,d,J=9.6 Hz,H-3),7.59(1H,d,J=9.2 Hz,H-4),7.31(1H,d,J=8.8 Hz,H-5),6.78(1H,d,J=8.8 Hz,H-6),6.73(1H,brs,H-8);13CNMR(CDCl3,100 MHz),δ:161.0(C-2),113.0(C-3),143.2(C-4),128.6(C-5),112.8(C-6),162.1(C-7),101.3(C-8),155.8(C-9),112.5(C-10),23.5(C-1′),41.3(C-2′),212.0(C-3′),58.0(C-4′),41.6(C-5′),32.2(C-6′),25.3(C-7′),35.6(C-8′),39.4(C-9′),43.9(C-10′),75.8(C-11′),14.7(C-12′),6.7(C-13′),14.4(C-14′),19.9(C-15′)。
化合物fekrynol、lehmannolol和lehmannolone的结构式、HPLC图谱和紫外光谱分别见图2~4。
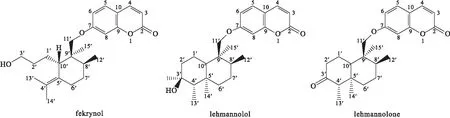
图2 化合物fekrynol、lehmannolol、lehmannolone的结构式Fig.2 Structural formulas of compounds fekrynol,lehmannolol,and lehmannolone
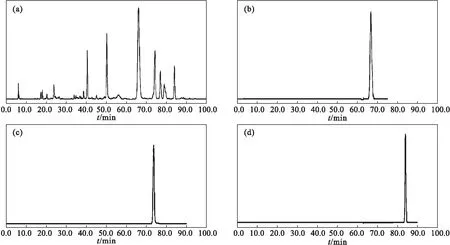
图3 新疆阿魏95%乙醇提取物(a)、fekrynol(b)、lehmannolol(c)、lehmannolone(d)的HPLC图谱Fig.3 HPLC spectra of 95% ethanol extract of Ferula sinkiangensis K.M.Shen(a),fekrynol(b),lehmannolol(c),and lehmannolone(d)
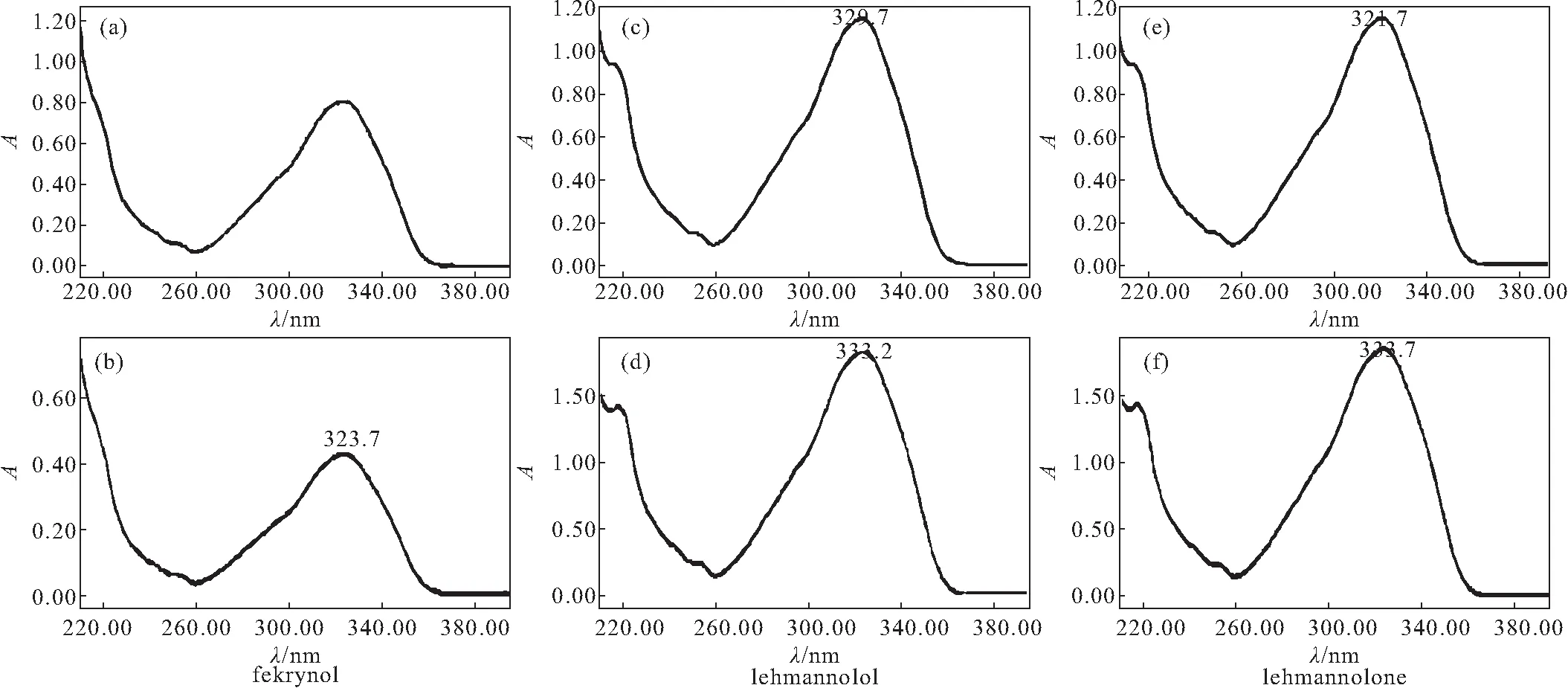
a、c、e为对照品 b、d、f为样品
2.7 讨论
巨噬细胞为机体重要的免疫细胞,巨噬细胞的激活能够造成炎症反应。当LPS作用于巨噬细胞时可通过激活TLR4受体来激活NF-κB和MAPK炎性信号通路,进而激活机体的免疫系统,诱导NO合成酶分泌出大量的NO,从而发生免疫应答反应[13]。因此,本实验通过LPS诱导的小鼠巨噬细胞RAW264.7作为体外炎症模型来筛选3种阿魏的抗炎活性部位。

3种阿魏不同极性部位提取物的化学成分尚不明确,通过建立相应的HPLC图谱,将其主要色谱峰变量与NO含量经过双变量Pearson相关分析,筛选出阿魏提取物中与NO含量指标相关的变量。在3种阿魏不同极性部位提取物中仅有阜康阿魏在保留时间8.5 min处的色谱峰与NO含量之间呈显著正相关,其具体成分是否具有致炎性,需要进一步探究。其余主要色谱峰变量与NO含量之间呈负相关,即表现为峰面积值越大,其对应NO含量值越小,推测其化学成分的含量差异性直接影响其抗炎药理指标;新疆阿魏和阜康阿魏在保留时间68 min、75 min处的色谱峰及阜康阿魏和多伞阿魏在保留时间86 min处的色谱峰均具有显著负相关性(P<0.05),初步判断相关成分分别为fekrynol、lehmannolol及lehmannolone;其它同样具有显著负相关的色谱峰,由于未找到对应的标准品,目前没有鉴定出其化学成分,待后期进一步研究。
本研究中,3种阿魏95%乙醇提取物、二氯甲烷部位、乙酸乙酯部位均有显著抗炎活性,3种阿魏水部位均无明显抗炎活性,其中阜康阿魏的石油醚部位和多伞阿魏的水饱和正丁醇部位也有一定抗炎活性。阿魏的抗炎活性成分多为香豆素类成分,国内学者[14-15]研究发现,新疆阿魏树脂的三氯甲烷提取物能明显抑制神经炎症,多伞阿魏中提取的倍半萜-香豆素杂合化合物对诱导性NO合成酶活性具有抑制作用。国外学者[16-17]研究发现,从阿魏属植物根部提取的umbelliprenin(伞形戊烯内酯,UMB)成分通过体外抑制脂氧合酶从而控制炎症反应,在体内则具有抗炎活性。在炎性巨噬细胞中,UMB能抑制NO的产生和诱导性NO合成酶的生成。
综上,本研究鉴定的单体化合物fekrynol是单环倍半萜香豆素类,lehmannolol及lehmannolone是双环倍半萜香豆素类,对阿魏的抗炎活性与以往报道的阿魏属植物及其衍生物的抗炎活性一致。
3 结论
建立LPS诱导的小鼠巨噬细胞RAW264.7炎症模型,采用Griess 试剂法检测NO含量,通过双变量Pearson相关分析法,将新疆阿魏、阜康阿魏、多伞阿魏不同极性部位的HPLC图谱与NO含量进行相关性分析,筛选出3种阿魏的抗炎活性部位。结果表明,3种阿魏95%乙醇提取物、二氯甲烷部位、乙酸乙酯部位均有显著抗炎活性(P<0.01或P<0.05),3种阿魏水部位均无明显抗炎活性;新疆阿魏和阜康阿魏在保留时间68 min、75 min处及阜康阿魏和多伞阿魏在保留时间86 min处具有显著抗炎活性的共有色谱峰分别为化合物fekrynol(托里阿魏诺醇)、lehmannolol(大果阿魏醇)和lehmannolone(大果阿魏酮),其可能是阿魏的抗炎活性成分。

