栎树秋季叶色多样性及相关生理特性的变化
安 然,王树凤,陈益泰,汪阳东,傅火勇,张永志,施 翔*
(1.中国林业科学研究院亚热带林业研究所,浙江省林木育种技术研究重点实验室,浙江 杭州 311400;2.浙江省安吉县龙山林场,浙江 安吉 313306)
植物叶片秋季衰老会导致叶色变化,暖温带落叶林最显著的特征是秋季叶色丰富[1-2]。目前植物叶片呈色机制仍不完全清楚[3]。研究发现叶色与叶片色素种类、含量和分布有关[4-5],叶片呈色的直接原因是叶片中色素种类和比例的变化[6]。大多数植物叶片叶绿素含量秋季开始时缓慢下降,然后迅速下降,同时叶片组织中开始积累花青素[7-9],秋季叶色变红主要与叶片中花青素积累有关[7,10-11]。研究表明叶片色素含量与色差参数间具有一定相关性,如花色素苷和叶绿素含量的多少决定着a*值大小[12]。叶片花色苷的主要功能是使叶片免受光合抑制影响[13],同时有利于叶片营养元素的吸收再利用[14]。与N 含量较高的叶片相比,N 含量较低的叶片更早且更完全变红[4],表明色素与营养元素在叶片中的变化高度相关[15]。N 和P 是植物生长发育的限制性元素[16],同时也是各种蛋白质和遗传物质的重要组成元素[17]。因此,利用色差参数对主要色素含量进行预测,了解营养元素动态和叶色在叶片衰老期的变化关系,有助于了解植物变色期的适应策略,进一步揭示植物叶片秋冬季呈色规律[18]。
北美栎树(Quercusspp.)引种至我国已有20多年,其中有些树种引种点较多,种植广泛,生长良好[19]。作为观赏树种,北美栎树特别是红栎组(Sect.Lobatae)栎树秋冬季叶色丰富。研究表明平均气温是引起纳塔栎(Q.texanaBuckley)秋季叶片变色的主要因素,其次是最高气温[20]。姜琳等探讨了纳塔栎、舒玛栎(Q.shumardiiBuckland)等树种在秋冬转色期叶色变化的生理机制[21],但较少涉及关于秋季色素含量,特别是营养元素与叶色量化参数间变化关系方面的研究。由于栎树资源丰富,不同树种之间秋季叶色差异显著,这一现象可能与其秋季花青素积累差异显著有关[11,22]。同时,不同栎树叶片营养元素变化的差异可能也间接导致其叶色显著不同。因此,本研究选择从北美引种的7 种栎树以及乡土树种白栎(Q.fabriHance)为研究对象,通过研究8 种栎树叶片变色期有关生理指标变化,进而揭示栎树叶片营养元素生态化学计量特征、色素和叶色参数间的关系,以期为栎树园林绿化应用和彩叶新品系选育提供科学依据。
1 材料与方法
1.1 试验地点
试验点位于浙江省安吉县龙山林场的一处坡地(30°01′34″ N,119°11′47″ E,坡度30 °)。该地区属于亚热带季风气候,年降水量约945.5 mm,年平均温度约15.1℃。土壤中N、P 和K 含量分别为0.61、0.15 和6.60 g·kg-1,有机质含量5.85%,pH 值4.51。
1.2 试验材料
参试树种为从北美引种的纳塔栎、舒玛栎、柳叶栎(Q.phellosL.)、月桂叶栎(Q.laurifoliaMichx.)、樱皮栎(Q.pagodaRaf.)、琴叶栎(Q.lyrataWalter)、牛栎(Q.michauxiiNutt.)以及乡土树种白栎。根据近期的分子分类系统,其中纳塔栎、舒玛栎、柳叶栎、月桂叶栎和樱皮栎属于红栎组。红栎组主要分布在北美洲、中美洲和南美洲,花柱长,大多数树种橡子在18 个月内成熟,橡子壳内有毛;琴叶栎、牛栎和白栎属于白栎组(Sect.Quercus)。白栎组主要分布在欧洲、亚洲、北非、北美,花柱短,橡子在6 个月内成熟,橡子壳内部无毛[23]。北美栎树种子均来自于美国路易斯安那州。白栎种子采集自上海松江。
1.3 试验方法
1.3.1 样品观察、采集参试树种种子于2015 年春进行播种。2016 年3 月选择生长一致的各树种容器苗在试验点造林。试验林按随机区组设计排列:参试树种(包括种源)构成一个区组,每个区组每个树种10 棵幼苗。试验重复3 次,株行距为2 m × 2 m。据长期观察,试验区域栎树秋季叶片变色的高峰期出现在11 月下旬至12 月上旬,落叶高峰期出现在12 月中旬和下旬,分别于2018年10 月22 日、11 月6 日、11 月22 日 和12 月8 日共4 次收集叶片样本。采集树冠层南面中部枝条上健康、完整的功能叶片10~20 片。所采集叶片放入自封袋用冰盒带回实验室,放入冰箱中保存。所有样品均用蒸馏水仔细洗涤。对采集的叶片进行拍照、色差参数及光合色素含量测定。其余样品一部分先105 ℃杀青半小时,然后70 ℃下烘至恒质量,用于测定C、N 和P 等指标;另一部分样品自然阴干,用于可溶性糖的测定。除色差参数外,每项指标重复测定3 次。由于12 月8 日采样时牛栎叶片已经落叶,本研究中缺乏12 月8 日牛栎数据。
1.3.2 样品测定 色差参数测定:使用分光测色计(CM-2300d,柯尼卡美能达,日本)进行色差参数测定,每个重复选取10 片叶子,避开叶脉,每片叶子测定5 点,将获取的5 点平均值作为该片叶子叶色参数L*、a*和b*的值。L*值表示光泽明亮度,+表示偏亮,-表示偏暗;a*值表示红绿,+表示偏红,-表示偏绿;b*值表示黄蓝,+表示偏黄,-表示偏蓝[12]。
色素含量测定:称取0.2 g 新鲜样品,液氮研磨后转入装有10 mL 80%丙酮溶液的试管中,室温避光处浸泡提取24 h。然后测定470、645 和663 nm 波长处的吸光值。根据Lichtenthal 等的方法计算叶绿素(Chl)和类胡萝卜素(Car)含量[24]。称取0.2 g 新鲜样品,参照Pietrini 等的方法,在10 mL 酸化(1% HCl)甲醇中提取叶片花青素(Ant)[25]。根据Zhang 等的方法测定花青素含量[26]。
元素含量测定:植物样品烘干至恒质量粉碎后,采用朱亮等的方法测定C 含量[27];采用冷华妮等的方法测定栎树叶片N 和P 含量[28]。
可溶性糖含量测定:根据Li 等的方法测定可溶性糖(SS)含量[29]。
1.4 数据分析
采用Shapiro 检验评估方差同质性。使用SPSS 26 软件对各指标进行统计学分析。采用双因素以及Tukey 法进行方差分析和多重比较。用Pearson法对叶片色差参数和其它参数进行相关分析。将数据标准化后进行主成分分析(PCA),使用R 语言中的prcomp 命令(软件包“ FactoMineR”和“factoextra)”进行计算。利用OriginPro 2019 或R软件作图。图中数据为平均值±标准误。
2 结果与分析
2.1 栎树秋季叶色的变化
据观察,10 月22 日,参试栎树叶片基本为绿色。红栎组栎树特别是纳塔栎少量叶片开始变红。11 月6 日,纳塔栎变红叶片数量最多。其它红栎组栎树叶色也开始变化,但数量较纳塔栎少。此时白栎组栎树叶色依然以绿色为主。牛栎部分叶片叶缘出现枯黄或红色。11 月22 日,红栎组栎树以及琴叶栎叶片进入变色高峰期。牛栎大量叶片落叶,且叶色以枯黄为主。白栎大部分叶片以绿色为主。12 月8 日,各种栎树叶色从绿色变为黄红色、深红色、鲜红色或棕色(图1)。其中纳塔栎和舒玛栎叶色偏鲜红,柳叶栎、月桂叶栎、琴叶栎和白栎叶色偏黄红,樱皮栎叶色则为深红,颜色偏暗。

图1 栎树叶色变化特征Fig.1 The leaf colour traits in Quercus spp.leaves
2.1.1 叶片色差参数变化 各树种叶片色差参数值见图2。通常白栎组L*值较红栎组高(11 月22 日除外),但方差分析表明L*值在红栎组和白栎组间无显著差异。试验结果也表明树种、不同采样时间均对叶片L*值产生显著影响,同时树种和采样时间的交互效应显著(p<0.001)。不同采样时间L*平均值分别为37.77、36.05、34.79 和35.16,表明L*值有随时间推移而减少的趋势。但各树种L*值变化趋势不同,其中舒玛栎、柳叶栎、月桂叶栎和白栎L*值在叶片变色期前后变化幅度较小。通常白栎平均L*值最高,为38.49;樱皮栎平均L*值最低,仅为33.95。栎树叶片不同采样时间a*的平均值为-4.29、0.32、3.12 和5.85,且各树种a*值变化趋势一致,即随着时间推移,a*值逐渐增加(月桂叶栎除外)。方差分析表明a*值在红栎组和白栎组间差异显著(p<0.001),其中红栎组叶片较早变红色,且红栎组平均a*值较白栎组栎高(12 月8 日除外)。方差分析也表明树种、不同采样时间均对叶片a*值产生显著影响,同时树种和采样时间的交互效应显著(p<0.001)。纳塔栎变色最早,其叶片a*值在10 月22 日已接近于0,并于11 月6 日转为正值,且显著高于其它参试树种;其它红栎组a*值于11 月6 日变为正值或接近于0。白栎组叶片变色较晚,特别是白栎。12 月8 日,舒玛栎a*值最高,为7.83;月桂叶栎a*值低于其它树种,仅为3.52,这导致红栎组平均a*值偏低。白栎组的琴叶栎和白栎a*值较叶片变色前显著增加,分别为5.03 和6.97。各树种叶片b*的平均值在不同采样时间分别为18.80、17.55、13.82 和13.95,整体表现为秋季叶片变色后b*值减少(月桂叶栎除外)。方差分析也表明:红栎组和白栎组b*值无显著差异。但各树种叶片b*值差异显著(p<0.001)。12 月8 日,白栎b*值为20.02,高于其它树种;琴叶栎和樱皮栎b*值最低,仅为14.29 和14.37。
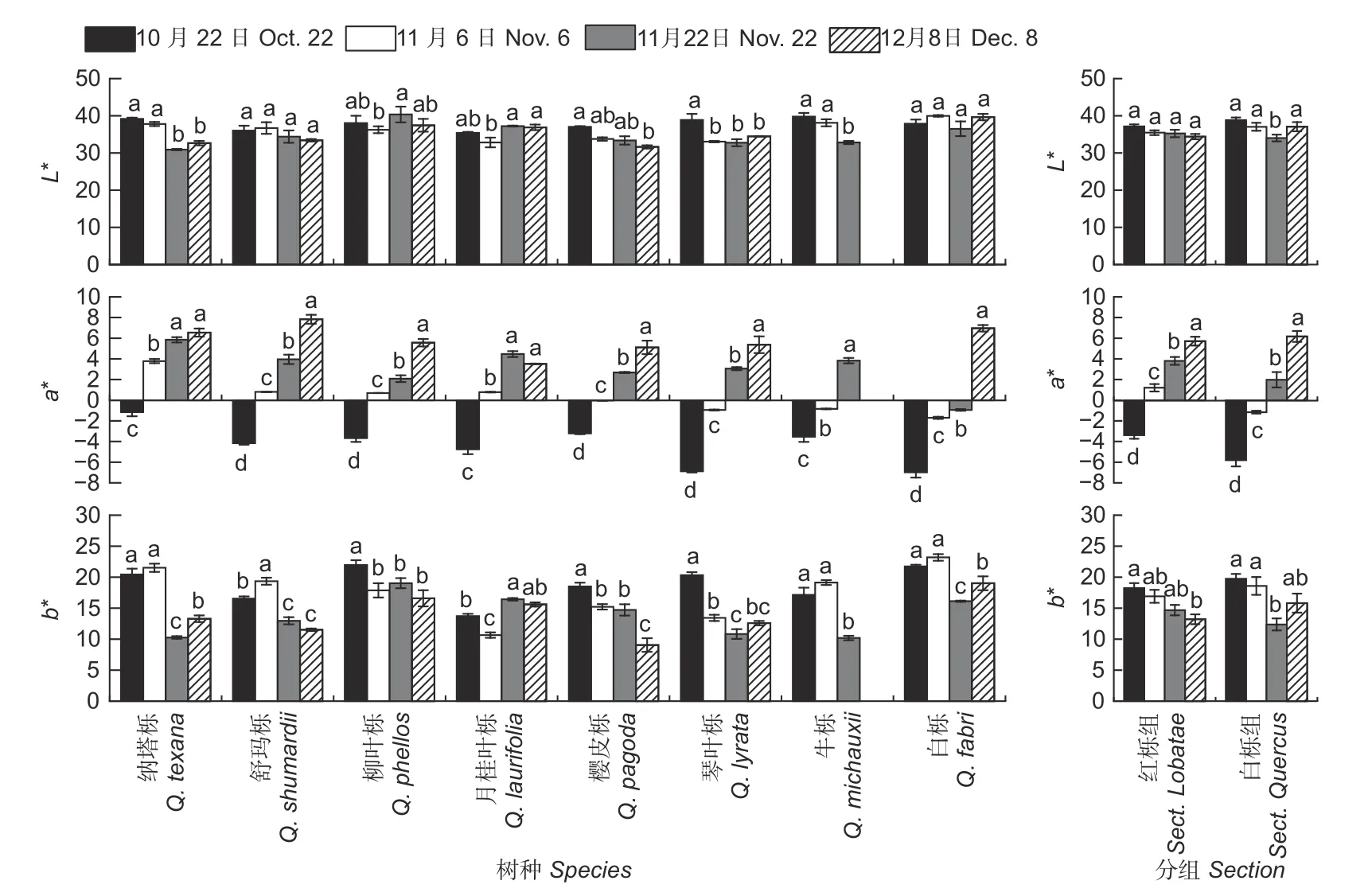
图2 秋季不同时间栎树色差参数的变化Fig.2 Changes of chromatic aberration parameters of Quercus spp.at the different stages in autumn
2.1.2 叶片色素含量变化 在秋季,各树种叶片叶绿素a 含量在变色前期变化幅度不大,在变色中后期随着时间推移显著下降(图3)。通常白栎组叶片叶绿素a 含量低于红栎组(10 月24 日除外),但在分组间无显著差异。方差分析表明叶绿素a 含量在树种和不同采样时间差异显著,同时树种和采样时间的交互效应显著(p<0.001)。其中舒玛栎、樱皮栎、琴叶栎和白栎叶绿素a 含量下降幅度较大,均超过70%。11 月22 日采样时牛栎已经大量落叶,因此叶绿素大量分解,下降幅度达93.9%。柳叶栎叶绿素下降幅度显著低于其余树种,仅为53.9%。叶绿素b 含量和叶绿素总含量变化趋势与叶绿素a 含量基本一致。各树种叶片类胡萝卜素含量随时间推移先增加后下降(柳叶栎和白栎除外,图3)。通常白栎组叶片类胡萝卜素含量高于红栎组(12 月8 日除外),但类胡萝卜素含量在分组间同样无显著差异。方差分析表明类胡萝卜素含量在树种和不同采样时间差异显著(p<0.001)。其中白栎类胡萝卜素含量在12 月8 日仅为0.07 mg·g-1,低于其它树种。各树种叶片花青素含量随时间推移逐渐增加(樱皮栎除外,图3)。整体而言,红栎组叶片花青素含量显著高于白栎组(p<0.01)。方差分析表明叶片花青素含量在不同采样时间和树种间均差异显著,且其交互效应显著(p<0.001)。纳塔栎花青素含量在整个变色期迅速上升;月桂叶栎花青素含量在变色期间则一直保持缓慢上升趋势。其它栎树花青素含量在10 月下旬到11 月上旬间上升缓慢,11 月6 日后迅速增加(白栎为11 月22 日),11 月下旬后花青素含量变化幅度较小。12 月8 日,除柳叶栎和月桂叶栎外,红栎组栎树花青素含量均高于0.04 mg·g-1,以纳塔栎花青素含量最高;白栎组花青素含量较10 月24 日显著增加,其中琴叶栎和牛栎花青素含量分别达到0.040 和0.037 mg·g-1。
通常叶片类胡萝卜素/叶绿素比值呈逐渐增加的趋势(柳叶栎和白栎除外,图3)。方差分析表明类胡萝卜素/叶绿素比值在不同采样时间和树种/分组间差异显著,且其交互效应显著(p<0.01)。随着时间推移,叶片花青素/叶绿素比值逐渐增加(图3)。方差分析表明分组和采样时间的交互效应显著影响花青素/叶绿素比值(p<0.05),通常红栎组栎树花青素/叶绿素比值较白栎组栎树高,但11 月22 日除外。在叶片变色前期各树种花青素/叶绿素比值无显著差异;11 月22 日牛栎花青素/叶绿素比值为0.256,显著高于其它树种;12月8 日,舒玛栎和纳塔栎花青素/叶绿素比值较高,月桂叶栎比值则显著低于其它树种,仅为0.048。
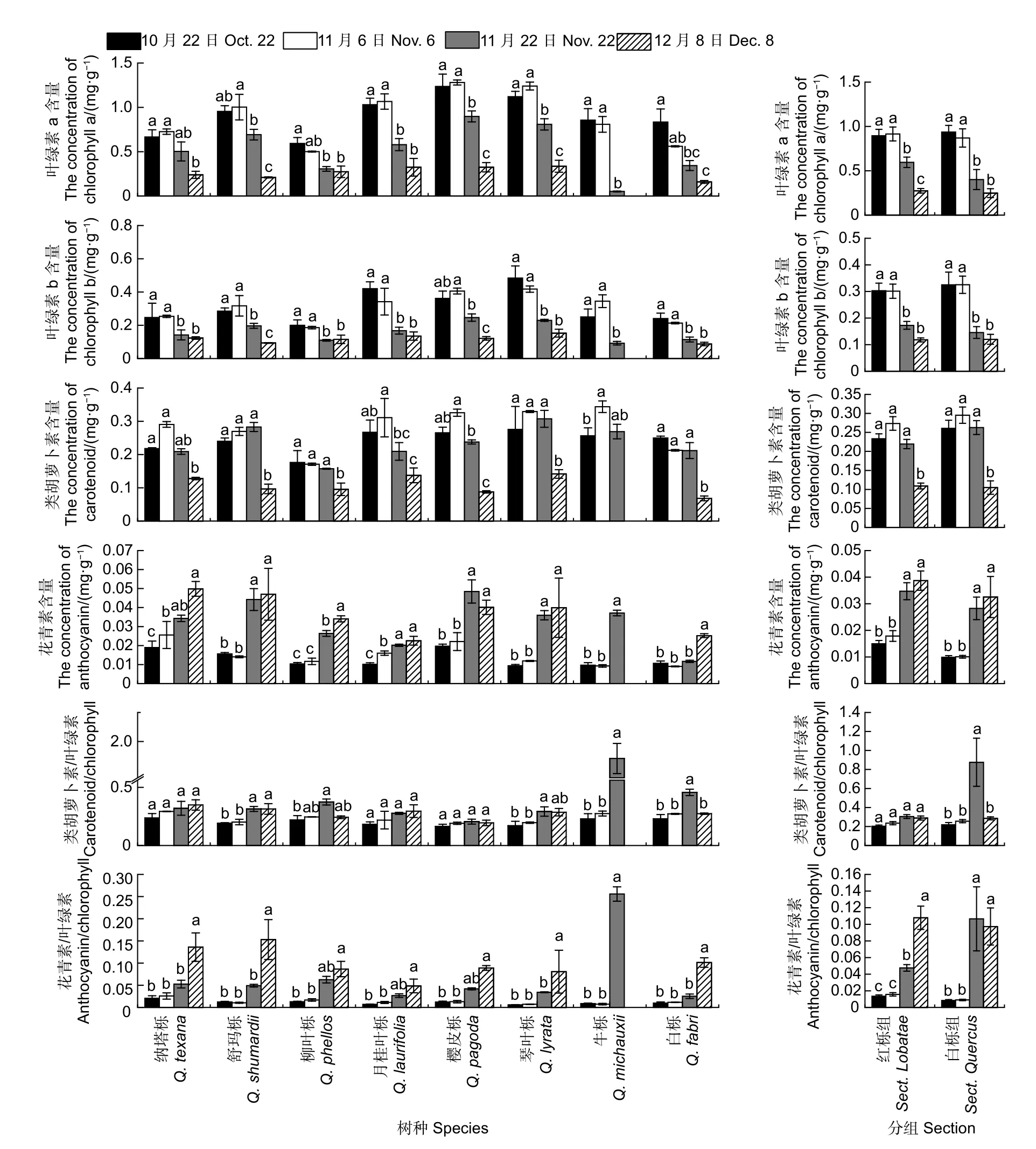
图3 秋季不同时间栎树色素含量的变化Fig.3 Changes of pigment contents of Quercus spp.at the different stages in autumn
2.2 叶片可溶性糖含量变化
方差分析表明:栎树叶片可溶性糖含量在不同采样时间和分组间/种间差异显著(p<0.001),且其交互效应显著(p<0.01)。通常红栎组叶片可溶性糖含量高于白栎组。试验期间各树种叶片可溶性糖含量随时间推移逐渐增加,但牛栎叶片可溶性糖含量在不同采样时间无显著差异(图4)。试验期间牛栎可溶性糖含量显著低于其它树种;乡土树种白栎可溶性糖含量低于引种栎树(牛栎除外)。
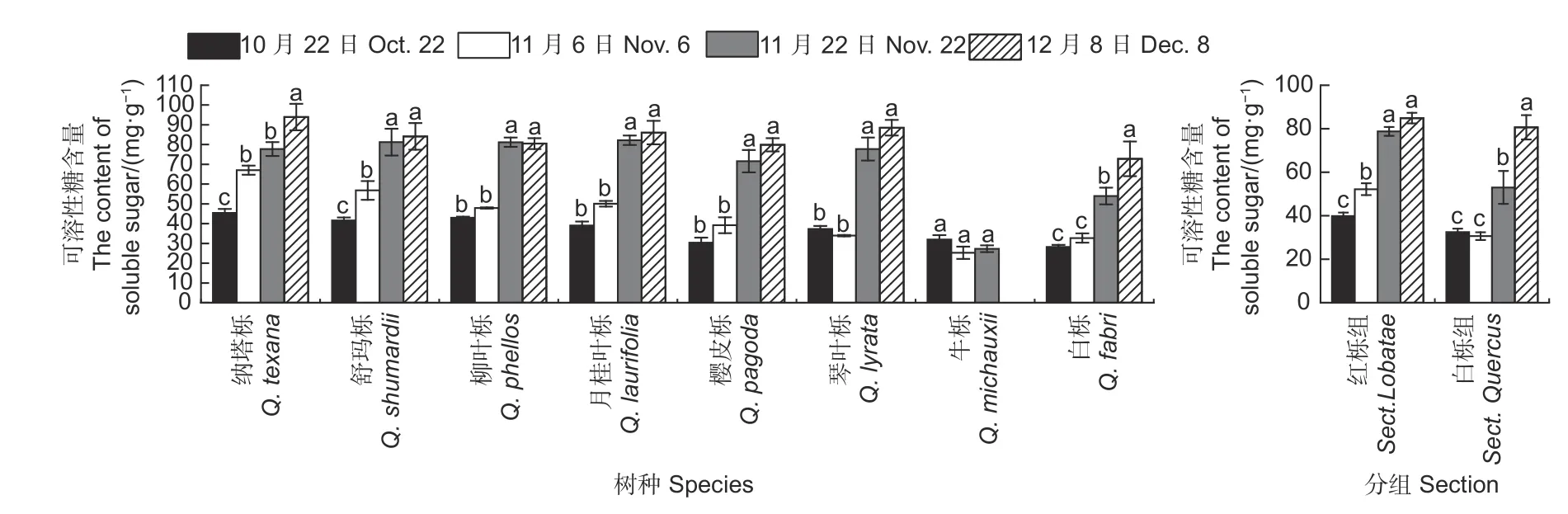
图4 秋季不同时间栎树可溶性糖含量的变化Fig.4 Changes of soluble sugar contents of Quercus spp.at the different stages in autumn
2.3 叶片C、N 和P 化学计量学特征
不同采样时间栎树叶片平均C 含量为479~452 mg·g-1(图5)。各树种C 含量变化幅度较小(431~494 g·kg-1),且C 含量在树种和分组间无显著差异。不同采样时间栎树叶片平均N 含量分别为18.78、18.10、15.42 和13.83 mg·g-1。通常红栎组叶片N 含量较白栎组低(11 月22 日除外),但N 含量在分组间无显著差异。方差分析表明:不同采样时间、树种以及其交互效应显著影响树种叶片N 含量(p<0.001)。各树种N 含量随时间推移呈下降趋势(图5)。但柳叶栎、月桂叶栎、樱皮栎和琴叶栎N 含量从10 月底到11 月22日下降缓慢,之后开始快速下降;牛栎和白栎N 含量在11 月6 日前变化幅度不大,此后叶片N 含量显著下降。纳塔栎和舒玛栎N 含量则在秋季一直保持迅速下降的趋势。其中白栎N 含量平均值最高,为18.25 mg·g-1,其次为樱皮栎、柳叶栎和琴叶栎。牛栎由于落叶较早,因此其N 含量显著低于其它树种。试验期间栎树叶片P 含量变化范围为0.59~1.20 mg·g-1,不同采样时间平均值分别为1.14、1.18、1.02 和0.82 mg·g-1(图5)。与N 含量表现相似,叶片P 含量在分组间无显著差异,且红栎组叶片P 含量较白栎组低(11 月22 日除外)。方差分析表明:不同采样时间、树种叶片P 含量差异显著,且其交互效应显著(p<0.001)。秋季栎树叶片P 含量呈下降趋势,但琴叶栎P 含量在秋季一直保持缓慢上升趋势。
方差分析表明采样时间和分组的交互效应显著影响叶片C∶N(p<0.01)。通常红栎组栎树C∶N 较白栎组栎树高(11 月22 日除外)。方差分析表明树种、不同采样时间均对叶片C∶N 产生显著影响,同时其交互效应显著(p<0.001)。各树种叶片C∶N 变化范围为21.71~51.68,且随时间推移逐渐增加(图5)。12 月8 日,纳塔栎、舒玛栎和月桂叶栎C∶N 显著高于其它树种,白栎C∶N 则低于其它树种,为28.54。牛栎由于叶片衰老,N 含量显著下降,因此其C∶N 在11 月22 日达到51.68。通常红栎组栎树C∶P 较白栎组栎树高(11 月22 日除外),但分组间无显著差异。各树种叶片C∶P 变化范围为374~792。除舒玛栎、月桂叶栎和琴叶栎外,多数树种C∶P 随时间推移逐渐增加(图5)。12 月8 日,纳塔栎和月桂叶栎C∶P 显著高于其它树种。与C∶N 变化趋势相似,牛栎C∶P 在11 月22 日达到最高值,为792。方差分析表明不同采样时间、分组及其交互效应均对叶片N∶P 无显著影响。各树种叶片N∶P 变化范围为12.11~20.33,且其变化趋势不一致(图5)。方差分析表明各树种叶片N∶P差异显著(p<0.001),其中舒玛栎N∶P 显著低于其它树种。
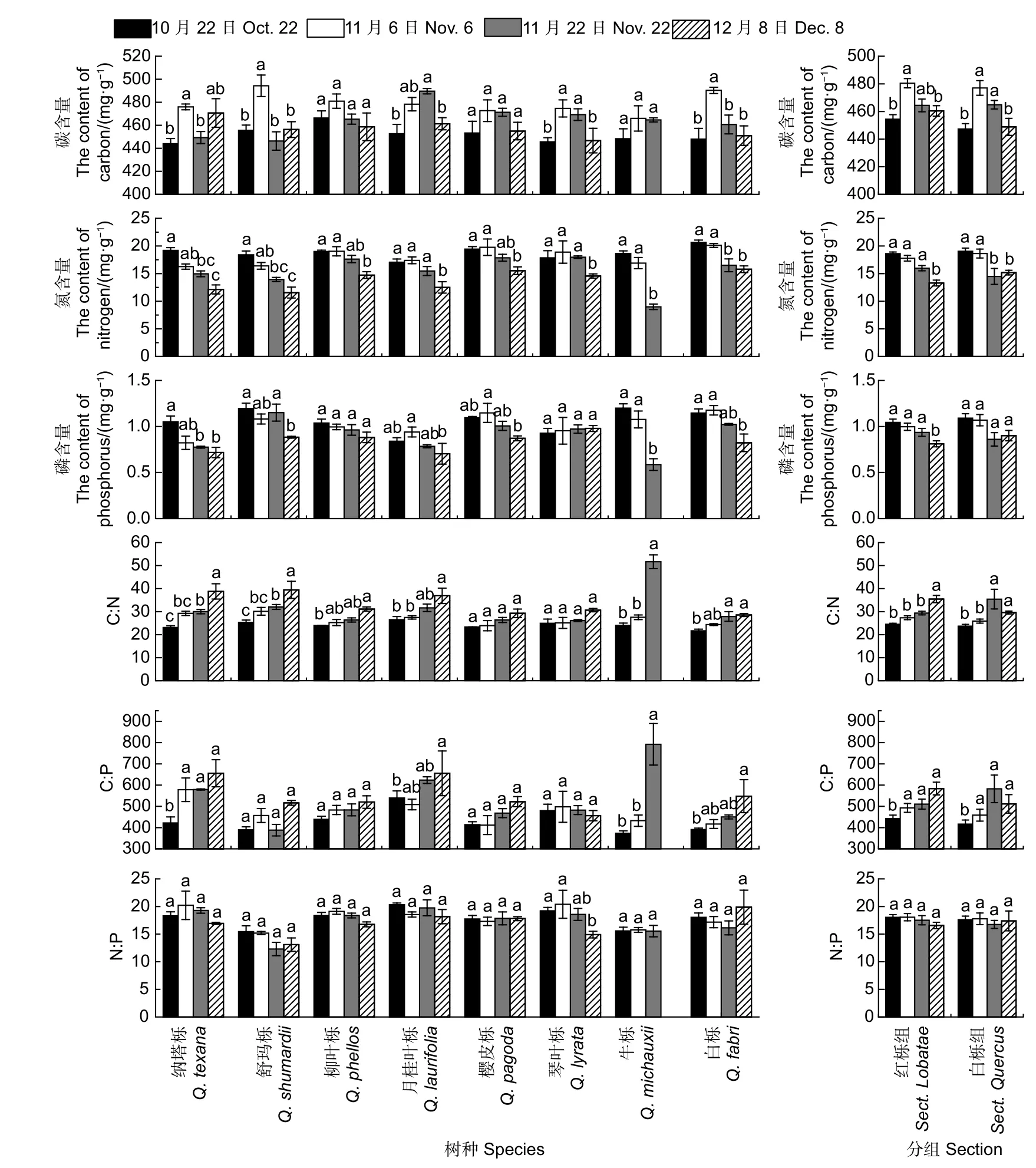
图5 秋季不同时间栎树C、N、P 含量的变化Fig.5 Changes of C, N and P contents of Quercus spp.at the different stages in autumn
2.4 栎树色差参数与各指标的相关性
相关分析可知:栎树色差参数L*值仅分别与b* 值和N 含量呈极显著和显著正相关,与a*值、花青素含量和花青素/叶绿素呈显著负相关。色差参数a*值与b*值、叶绿素、类胡萝卜素、N 和P 含量均呈极显著负相关,与花青素、可溶性糖含量、花青素/叶绿素、C∶N 和C∶P 为极显著正相关;同时b* 值分别与N 和P 含量呈极显著和显著正相关,与花青素、花青素/叶绿素和C∶N 呈极显著负相关,与可溶性糖含量及C∶P 呈显著负相关(图6)。
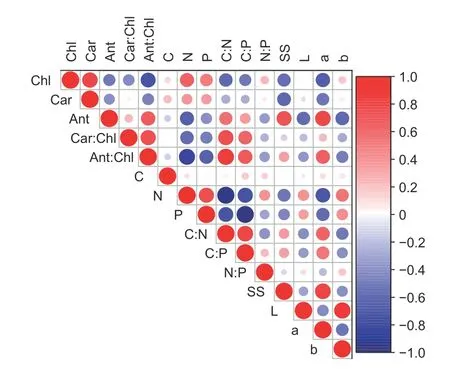
图6 栎树色素、可溶性糖及C、N、P 含量与叶色参数间的相关系数Fig.6 The correlation coefficient between pigment,soluble sugar, C, N, P content and chromatic aberration parameters of Quercus spp.
2.5 栎树叶色变化的主成分分析
选择光合色素及其比值、化学计量学特征和可溶性糖含量等12 个指标进行主成分分析(图7)。由主成分分析可知,前3 轴解释率为80.83%,第1 主成分占51.57%,其中高载荷且为正值的指标有叶绿素、N 和P 含量;为负值的指标为花青素、光合色素比值、C∶N 和C∶P。第1 主成分主要反映了光合色素和N、P 变异特征。第2 主成分占15.90%,其中高载荷且为正值的指标有可溶性糖含量,为负值的指标有类胡萝卜素和C 含量。第3 主成分占13.36%,其中高载荷且为正值的指标有N∶P。通过对栎树叶色变化各指标进行主成分分析可知,第1 主成分、第2 主成分基本能反映秋季栎树叶色变化的绝大部分信息。
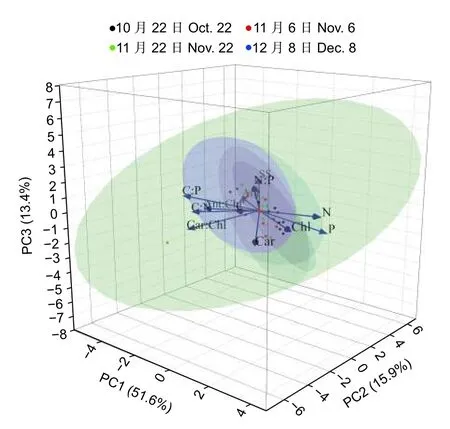
图7 栎树叶色变化特性的主成分分析Fig.7 Results of Principal Component Analysis(PCA) summarizing the information of the leaf colour traits in Quercus spp.Leaves
3 讨论
3.1 秋季栎树叶色变化的生理特征
色素含量的变化和比例会直接影响叶色的表达[18,30],如本研究中不同栎树叶绿素含量显著下降,且叶绿素b 的降解速度小于叶绿素a,使得叶色有变黄的趋势[31]。同时花青素的含量以及花青素/叶绿素的比值显着增加,类胡萝卜素/叶绿素的比值在试验前后则无显著差异。因此叶绿素、花青素和类胡萝卜素的组合增加了叶色的多样性[5]。许多研究表明,色差参数可定量表征叶片颜色[32]。本研究中,随着时间逐渐增加各栎树叶色由绿色变为红色或者叶片红色越深,其a*值也由负值转变为正值。由于后期大部分栎树叶色偏深红色,而该光谱离蓝色较近,因此大部分栎树b*值在试验期间逐渐降低。相关分析同时也表明,3 种色素决定a*值大小;b*值和L*值大小受花青素含量显著影响。整体而言,在栎树叶片变色期花青素含量是影响栎树叶色和光泽的最主要色素,这与杨淑红的结论一致[18]。
本研究中可溶性糖与花青素含量呈极显著正相关,表明可溶性糖积累有利于栎树叶片花青素合成[33],这与叶片中某些碳水化合物与所有类黄酮物质间呈显著正相关的结论一致[34-35]。由于花青素大量合成对可溶性糖的消耗较多,因而导致试验后期栎树叶片大面积变红时可溶性糖含量变化趋于平稳。N 和P 作为植物体中许多重要化合物的主要成分,其组成是适应环境变化的一种表征,也反映植物的生态适应策略[27]。本研究中各种栎树叶片N 和P 含量在秋季逐渐降低,这与叶绿素分解[15]、花青素积累和光合作用降低有关[36-37]。N、P 含量均与叶绿素、类胡萝卜素含量和b*值呈极显著或显著正相关,与花青素含量和a*值呈极显著或显著负相关,这与低氮、缺磷促进花色素苷含量的结论相似[38]。与N 和P 含量变化趋势相反,叶片变色期C∶N 和C∶P 逐渐增加,变色后期其C∶N和C∶P 值分别高于全球植物C∶N 平均值(22.5)和C∶P 平均值(201.43),表明N 和P 利用效率提高,有利于其抵御秋冬季不利环境[15,39],对其生存演替具有重要意义[15]。在秋季栎树叶片变色过程中,叶色、色素含量、营养元素和碳水化合物间存在耦合关联,且其变化趋势是协同的。导致栎树叶片秋季叶色变红的最重要物质是其衰老过程中花青素的大量合成。然而,除花青素外,叶片中的营养元素、碳水化合物等可能不会直接影响叶片颜色[40],但可能会通过影响花色苷的合成进而影响叶色变化[7]。也有研究表明叶片色素变化是为了其营养元素顺利吸收再利用[15]。因此叶片秋季颜色、色素、营养元素和碳水化合物等物质含量的变化是植物存活、演替和缓解不利条件的重要途径。
3.2 栎树叶色变异特征分析
尽管不同栎树各指标在秋季叶片变色期具有一定的一致性,但各指标变化起始时间及变化幅度不同,导致各树种进入变色期以及达到变色高峰期的时间、观色期时长和叶色表现出显著差异。如本研究中纳塔栎叶片较早进入变色期且呈现红色时间长,这与目前其在我国长江三角洲平原地区的种植表现一致[19]。白栎组栎树如琴叶栎和白栎在秋季叶片衰老初期叶色变化幅度较小,但在衰老末期叶色有较大幅度变化,其中琴叶栎大部分叶片颜色转变为黄红色,白栎部分叶片颜色也转变为黄红色,甚至少量转变为鲜红色,且色泽亮丽。这些结果说明,在相同环境条件下,即使在同一属植物间叶色种间变异性也较高,因而可进一步丰富秋季色彩。属内部遗传多样性高以及对营养元素利用效率的差异可能是决定栎属种间秋季叶片颜色多样性的重要因素。研究也显示不同组间栎树叶片花青素、可溶性糖以及营养元素含量在叶片变色初期差异显著,但在叶片变色高峰期各指标在组间无显著差异,这也表明不同组栎树在秋季适应环境以及在叶片衰老期间维持其内部生理活动正常运行的机制有所不同[41-42],作者将在后续研究中进一步探讨。
4 结论
本研究探讨了8 种栎树秋季叶色变化过程。通常叶绿素和类胡萝卜素含量表现出不同程度下降,花青素含量则显著增加。N 和P 在叶片变色期进行转移,其含量显著下降。各栎树叶色也由绿色转变不同类型红色或棕色。其中纳塔栎秋季叶色最红,且叶片呈现红色的时间最长。在整个变色期,红栎组栎树叶片变色较白栎组早,且较白栎组叶片更红。色差参数值L*、a*、b*可量化分析叶色和各色素含量以及营养元素间的关系。

