双金属有机骨架的合成及其在食源性致病菌荧光检测中的应用*
陈诗韵,苏丹萍,蔡奕全,袁 萍,颜戊利,贺锦灿
(广东药科大学公共卫生学院,广东 广州 510310)
随着食品安全事件频发,研究者们愈加重视发展低成本、高灵敏、易操作的现场快速检测技术[1]。传统的细菌检测包括细菌培养[2]、PCR(聚合酶链式反应)及其衍生技术[3-4]、酶免疫检测技术[5]等,这些方法具有一定的优点,但同时也存在耗时长、成本高、操作繁琐[6]等缺点。金属有机骨架(Metal-Organic Frameworks,MOFs)是由有机配体和金属离子通过自组装合成的一类新型有机-无机杂化多孔材料[7],具有比表面积大,吸附性能强等优点,在分离、传感领域具有重要的应用。核酸适配体(Aptamer)是一段包含15~40个碱基寡核苷酸的片段,能特异性识别并且结合特定的靶分子[8]。本文以一锅法合成Fe/Cu双金属MOFs(Fe/Cu-MOFs),并以其作为荧光猝灭平台,荧光素FAM标记的核酸适配体为探针,建立一种快速检测食源性致病菌新的检测方法,并运用于实际样品中食源性致病菌的检测。
1 实验部分
1.1 材料与试剂
金黄色葡萄球菌(ATCC6538)、副溶血性弧菌(ATCC17802)、沙门氏菌(ATCC14028)、单核增生李斯特菌(ATCC19115)、大肠杆菌(ATCC25922)购自广东环凯微生物科技有限公司;三氯化铁、一水乙酸铜、均苯三甲酸购自上海阿拉丁生化科技股份有限公司;FAM标记单增李斯特菌适配体(序列5’-AAAATACCAGCTTATTCAATTCCAAAAGCGCACCCATA TATGTTCTATGTCCCCCACCTCGAGATTGCACTTACTATCT-3’[9])、FAM标记副溶血性弧菌适配体(序列5’-TCTAAAAATGGGCAAAGAAACAGTGACTCGTTGAGATACTAAA-3’[10])购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
LRH-250生化培养箱,上海一恒科技有限公司;VM-03RU迷你涡旋混匀器,苏州捷美电子有限公司;F-7000荧光分光光度计,日本日立公司;DF-101S磁力搅拌器,巩义市予华仪器有限责任公司;H3-18K 台式高速离心机,湖南可成仪器设备有限公司;S-4800 SEM扫描电镜仪,日本日立公司;Rigaku智能多功能X射线衍射仪 Smartlab,日本Rigaku 公司。
1.3 实验方法
1.3.1 Fe/Cu-MOFs的合成
先配制铁-铜(1:4)双金属溶液(20 mmol/L):取100 mL六水三氯化铁溶液(4 mmol/L)和100 mL一水乙酸铜溶液 (16 mmol/L)混合,用玻璃棒充分搅拌混匀5 min。取均苯三甲酸(20 mmol,100 mL)于三颈烧瓶中,再取100 mL铁-铜双金属溶液,缓慢注入,于磁力搅拌器中搅拌反应30 min,所得材料分装于15 mL离心管(10 mL/只),于离心机中离心(6000 rd,10 min),同时用乙醇水洗涤并离心2次,得到Fe/Cu-MOFs,最后倒去液体,留下固体材料。将离心管置于冰箱冷冻层冷冻12 h 后,再转移至冻干机冻干24 h,得到Fe/Cu-MOFs冻干粉。
1.3.2 细菌培养
在超净工作台中,用接种环取一环副溶血性弧菌、单增李斯特菌悬液分别接种于TCBS斜面和TSAYE斜面,并恒温培养24 h。
1.3.3 分析方法
副溶血性弧菌:依次加入400 μL 20 nmol/L的FAM标记的副溶血性弧菌Apt溶液以及120 μL浓度为3 mg/mL的Fe/Cu-MOFs溶液,置于涡旋器中涡旋混匀,严格避光,待核酸适配体上的荧光素荧光猝灭20 min。最后加入100 μL副溶血性弧菌菌液。
单增李斯特菌:依次加入400 μL 20 nmol/L的FAM标记的单增李斯特菌Apt溶液以及80 μL浓度为0.83 mg/mL的Fe/Cu-MOFs溶液,置于涡旋器中涡旋混匀,严格避光,待核酸适配体上的荧光素荧光猝灭40 min。最后加入100 μL单增李斯特菌菌液。
避光孵育30 min。实验平行三次,同时设置空白对照和标准对照。在F-7000型荧光分光光度计上以λex=494 nm的模式同步扫描得到荧光发射图谱,分别记录空白组和标准组在λ=517 nm处的荧光值F,计算ΔF=F-F0。
2 结果与讨论
2.1 分析原理
本方法的分析原理如图1所示,当FAM标记的核酸适配体与Fe/Cu-MOFs混合后,核酸适配体被吸附到材料表面,本身所携带的荧光被猝灭。加入目标细菌时,核酸适配体与细菌特异性结合,脱离金属材料表面,荧光达到一定程度的恢复。在一定的范围内,荧光强度的恢复值与加入的菌液量成正比。

图1 本方法的分析原理示意图Fig.1 Schematic diagram of the proposed method
2.2 Fe/Cu-MOFs的表征
采用扫描电镜(SEM)对Fe/Cu-MOFs的外观形貌的尺寸进行表征分析。如图2可知,Fe/Cu-MOFs呈现长条棒状晶体形貌,棱角分明,晶体长度约为800 nm,宽度约为150 nm,高为50 nm。如图3可知,Fe/Cu-MOFs在18°[11]、26°[12]的具有MOFs的特征衍射峰,且峰形尖锐,说明合成的金属有机骨架的结晶度较好。

图2 Fe/Cu-MOFs的扫描电镜图Fig.2 Scanning electron microscopy of Fe/Cu-MOFs

图3 Fe/Cu-MOFs的XRD图谱Fig.3 XRD spectrum of Fe/Cu-MOFs
2.3 分析条件的考察
以革兰氏阳性菌—单增李斯特菌和革兰氏阴性菌—副溶血性弧菌为例,考察 Fe/Cu-MOFs的用量、猝灭时间和恢复时间对荧光恢复值的影响。通过实验优化,最佳分析条件于表1所示。因此,后续实验以表1作为实验条件。

表1 分析条件考察结果Table 1 The results of analysis conditions
2.4 线性范围及检出限
革兰氏阳性菌单增李斯特菌,在最佳实验条件下,设置空白组及标准组,每组实验平行三次。结果如图4所示,单增李斯特菌在9.69×106~1.94×109CFU/mL浓度范围内时,荧光恢复强度(ΔF)与浓度对数(lgc,CFU/mL)呈线性相关(ΔF=65.763lgc-449.28,R2=0.9851,r=0.9925),检出限为1.00×106CFU/mL。

图4 单增李斯特菌标准曲线Fig.4 Linear curve of fluorescence recovery value and concentration of Listeria monocytogenes
革兰氏阴性菌副溶血性弧菌,在最佳实验条件下,设置空白组及标准组,每组实验平行三次。结果如图5所示,副溶血性弧菌在4.12×104~8.23×106CFU/mL浓度范围内时,荧光恢复强度(ΔF)与浓度对数(lgc,CFU/mL)呈线性相关(ΔF=98.479lgc-417.14,R2=0.9905,r=0.9952),检出限为1.00×104CFU/mL。

图5 副溶血性弧菌标准曲线Fig.5 Linear curve of fluorescence recovery value and concentration of Vibrio parahaemolyticus
该结果表明,本方法既适用于革兰氏阳性菌的分析,也适用于革兰氏阴性菌的分析,具有一定的普适性。
2.5 选择性实验
在单增李斯特菌实验中选用细菌浓度为单增李斯特菌的10倍以上的四种菌(副溶血性弧菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌),副溶血性弧菌实验中选用细菌浓度为副溶血性弧菌的10倍以上的四种菌(单增李斯特菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌),分别考察这四种菌加入后,对FAM标记的副溶血性弧菌Apt及单增李斯特菌适配体的荧光恢复情况,并且与加入副溶血性弧菌、单增李斯特菌的实验结果作对比。
单增李斯特菌实验得出结果:即使加入其他菌,因为该菌对单增李斯特菌适配体没有特异性,在该菌细菌浓度为副溶血性弧菌的10倍以上的情况下,其对荧光恢复信号的响应程度远不如单增李斯特菌菌作用的十分之一或者更低。副溶血性弧菌实验得出结果:即使加入其他菌,因为该菌对FAM标记的副溶血性弧菌Apt没有特异性,在该菌细菌浓度为副溶血性弧菌的10倍以上的情况下,其对荧光恢复的程度远不如副溶血性弧菌作用的十分之一或者更低。
由此可知,该实验方法对食源性致病菌的检测具有较高的特异性,方法的选择性主要来源于核酸适配体对食源性致病菌的特异性结合能力。
2.6 实际样品分析
将从菜市场购买的新鲜基围虾去壳及八爪鱼切块后,将虾肉及八爪鱼用绞肉机搅碎后,称量25 g肉糜,放入装有225 mL缓冲蛋白胨水的均质器中,在均质器中均质3 min或5 min。得到虾肉、八爪鱼均质液后,再将样品均质液分装于15 mL离心管中(10 mL/支),离心机中以6000 r/min离心10 min。选用上清液作为单增李斯特菌和副溶血性弧菌实验中实际实验样品,各平行三份。将得到的虾肉、八爪鱼上清液按照1.3.3中的步骤进行实验,并进行价表回收实验,测定结果如表2、表3所示。

表2 虾肉和八爪鱼样品中单增李斯特菌的测定结果(n=3)Table 2 The detection results of Listeria monocytogenes in shrimp and octopus(n=3)
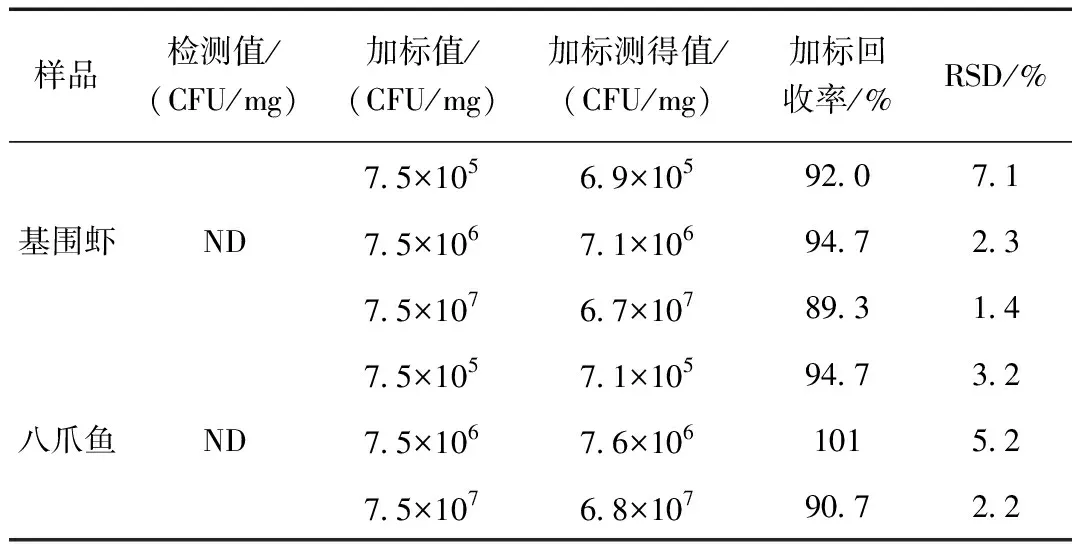
表3 虾肉和八爪鱼样品中副溶血性弧菌的测定结果(n=3)Table 3 The detection results of Vibrio parahaemolyticus in shrimp and octopus(n=3)
其中单增李斯特菌实验中虾肉的加标实验的相对标准偏差(relative standard division, RSD)为1.5%~2.2%。其回收率为94.4%~100%,八爪鱼的加标实验的相对标准偏差(RSD)为3.3%~4.8%。其回收率为94.4%~111%。
副溶血性弧菌实验中虾肉的加标实验的相对标准偏差(RSD)为1.4%~7.1%。其回收率为89.3%~94.7%,八爪鱼的加标实验的相对标准偏差(RSD)为2.2%~5.2%。其回收率为90.7%~101%。
3 结 论
Fe/Cu-MOFs合成过程简单,条件温和,形貌规则,具有良好的荧光猝灭性能。以Fe/Cu-MOFs作为荧光猝灭平台,建立检测食源性致病菌的方法。该方法操作简单,避免了平皿计数法法检测前的增菌步骤,检测速度快,检测时长平均一小时,可通过一些酶放大信号的技术进一步提高方法的灵敏度,适合革兰氏阳性菌和阴性菌的分析,具有一定的普适性,在实际样品的分析中具有一定的应用潜力。

