3D腹腔镜胃癌根治术治疗胃癌的效果分析
陈金才(江苏大学附属医院,江苏 镇江 212002)
胃癌是临床比较常见的一种消化道恶性肿瘤疾病,严重危害患者的健康乃至生命安全。据临床统计显示,2018年我国新增胃癌患者数量超过41万例,占到所有癌症患病率的11%以上,且男性患胃癌的概率高于女性[1]。随着目前人们饮食结构、生活习惯的改变,胃癌患病率呈升高趋势发展。由于早期胃癌疾病症状较为隐匿,多数患者确诊时疾病已发展至中晚期,因此错失最佳治疗时机。目前临床治疗胃癌多采取腹腔镜胃癌根治术,其优势是对患者伤害小、术后恢复快。但是2D腹腔镜所展示的图像为平面结构,医生在操作时难以对空间、病灶结构等进行明确辨认。而随着3D腹腔镜技术的广泛应用,弥补了这一不足,提高了医生对空间的定位能力及纵深视觉,进而有效提高了手术疗效及安全性[2]。本文针对2018年5月-2021年5月我院收治130例胃癌患者进行研究,简述3D腹腔镜胃癌根治术治疗的应用价值,内容如下。
1 资料与方法
1.1 一般资料 研究时间为2018年5月-2021年5月,研究对象选择于我院接受根治术治疗的胃癌患者130例,根据抛硬币结果分组,对照组共65例,男性41例,女性24例,年龄范围35-74岁,平均年龄(56.14±2.31)岁,TNM分期结果:24例患者诊断为I期,21例患者诊断为II期,20例患者诊断为III期。观察组共65例,男性40例,女性25例,年龄范围36-75岁,平均年龄(55.41±2.30)岁,TNM分期结果:23例患者诊断为I期,22例患者诊断为II期,20例患者诊断为III期。纳入标准:①确诊为胃癌疾病,符合《胃癌诊治难点中国专家共识(2020版)》[3]相关规定;②患者均符合胃癌根治术手术指征要求;③患者均同意参与且配合治疗研究。排除标准:①排除手术禁忌患者;②排除凝血功能障碍患者;③排除合并其他恶性肿瘤疾病患者;④排除抵触配合研究患者。两组患者一般资料比较,无统计学差异(P>0.05)。研究通过我院医学伦理委员会批准。
1.2 方法 给两组胃癌患者实施手术治疗的为同一医疗团队成员,均需依据胃癌根治手术标准,对胃部实施远端完整切除操作,并根据实际情况适当切除周围组织,以便病理检查时评估恶性肿瘤细胞是否发生转移,还需对淋巴结给予充分的清扫。
对照组患者采用2D腹腔镜下胃癌根治手术方案,观察组患者则采用3D高清腹腔镜下的胃癌根治手术方案,两组患者除内镜器械外的手术操作流程完全一致。手术开始后指导患者取平卧或仰卧位,采取全身麻醉诱导方案,待麻醉生效后于腹部手术区域使用碘伏消毒,并以干燥棉球擦拭多余制剂。放置镂空方巾后将手术台顶部位置抬高约15°,下肢稍微分开,在脐下1cm位置做观察孔。切口完成放置气腹针,建立人工二氧化碳气腹,在手术过程中保持腹内压强维持在12mmHg左右。气腹建立完毕拔出气腹针,将穿刺套管置入腹腔,并经由套管置入相应腹腔镜器械。在腹腔镜镜头下观察腹部脏器情况,确认恶性肿瘤组织的具体位置。确认肿瘤位置后,在脐部两侧麦氏点各做1个切口,分别置入腹腔镜配套医疗器械。主刀医生需站在患者左侧,助理医生或护士站在右侧,内镜扶持人员站在患者两腿间空位保持内镜的稳定。如发现肿瘤病灶周围存在组织粘连情况,需先给予松解,再对贲门远端予以离断,对整个胃部进行切除。胃部和肿瘤组织被取出腹腔后,清扫周围淋巴结至D2,镜下确认淋巴结清扫完毕后对手术切口进行吻合。术后在腹部正中做长度为6cm的切口,与肠道建立消化瘘口,与十二指肠切口进行吻合,如单纯实施全胃切除则需与食管、空肠切口进行吻合。
1.3 观察指标 记录对比两组患者临床手术指标(手术时间、术中出血量)及术后恢复(排气时间、恢复饮食时间、住院总时间)情况,比较各组患者淋巴结清扫数量、术中错抓次数及淋巴结清扫用时差异。统计两组患者术后并发症总发生率。
1.4 统计学分析 SPSS19.0用于对结果数据进行统计学分析,用n(%)表示计数资料,卡方值检验,用(±s)表示计量资料,t值检验,P<0.05表示结果存在统计学差异。
2 结果
2.1 两组患者临床手术指标及术后恢复情况比较 两组患者术后恢复用时比较,均无统计学差异(P>0.05),观察组患者手术时长短于对照组,患者术中出血量少于对照组(P<0.05)。见表1。
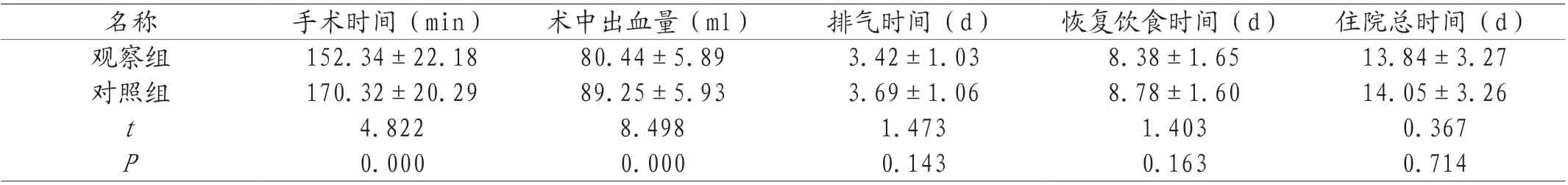
表1 两组患者临床手术指标及术后恢复情况比较
2.2 两组患者淋巴结清扫数量、术中错抓次数及淋巴结清扫用时比较 观察组患者淋巴结清扫数量多于对照组,术中错抓次数少于对照组,同时淋巴结清扫用时短于对照组(P<0.05)。见表2。
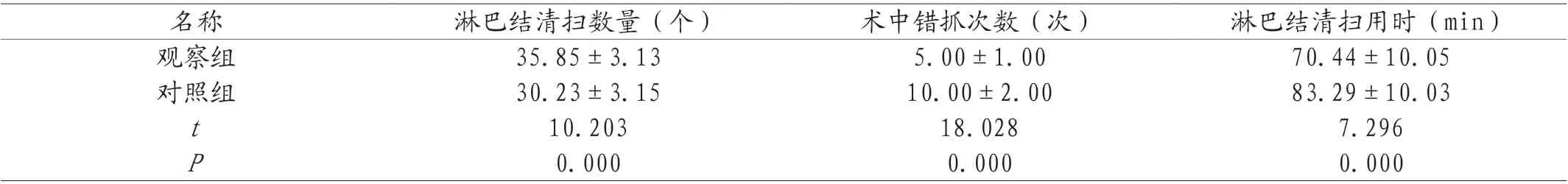
表2 两组患者淋巴结清扫数量、术中错抓次数及淋巴结清扫用时比较
2.3 两组患者并发症总发生率比较 观察组患者术后并发症总发生率明显低于对照组(P<0.05)。见表3。

表3 两组患者并发症总发生率比较
3 讨论
胃癌通常指的是起源于胃内黏膜上皮组织的恶性肿瘤类病变,目前我国胃癌发病率相对较高,且呈现地域性特征,在西北、东部沿海城市等地区的发病率高于东北、南方内陆等地区。胃癌通常多见于50岁及以上的中老年群体,且男性患者数量为女性的2倍左右。临床虽然尚无法准确解释胃癌发病的核心机制,但家族遗传病史、饮食习惯、工作压力、环境因素、幽门螺杆菌感染、慢性胃病等均与该病症有关,其中以家族遗传病史的影响最为明显[4]。胃癌可以起源于任何位置的黏膜上皮组织,其中50%以上者见于胃窦部,而其余如胃大弯、胃小弯等位置也具有一定发病几率。大多数胃癌属于腺癌,在早期阶段无明显症状,即便出现临床症状也多与慢性胃炎、胃溃疡等重叠,因而绝大多数患者会忽略自身病情。我国在应对胃癌时多推荐使用外科手术方式,以切除大部或完全切除胃部的方式,彻底根除病灶组织,也能够有效控制癌细胞的转移。但传统开腹式外科手术会对患者机体造成明显损伤,不利于术后恢复,还会增加术后感染几率。腹腔镜下胃癌根治手术的微创优势使得其临床应用范围逐渐扩大,且随着腹腔镜技术的不断革新和完善,手术视野和分辨率也得到了进一步提升[5]。
既往腹腔镜手术所使用的电镜为2D技术,所获得的影像为二维平面图像,对于病灶状态的清晰度虽然有所保障,但相关细节则无法进一步确保。3D技术则利用了人体双眼视物不同的特点,利用两个镜头同时捕捉两张不同的二维影像,再借助3D眼镜分别展示在主刀医生双眼前,经由大脑处理后进而形成立体的视觉影像。这种影像即时模拟人眼自然状态下采集影像的基本原理,所收集的信号通过两个独立的处理器进行识别,处理器间无任何干涉性,因而使获得的影像更加客观,更符合裸眼状态下观察的影像[6-7]。相比于2D影像,3D影像不仅更加具有层次感,且可以观察到影像的纵深感,因而可以更好地掌握病灶的具体深度和相对位置,为切除操作提供准确的参考。
实际应用3D腹腔镜时可以提升影像的放大倍数,可达到10-15倍,其中高倍数观察可以确认主血管的位置,在切割过程中予以相应的保护。清扫淋巴结时也可以高倍数观察确认效果,减少遗漏导致的术后复发问题。手术操作时有利于高难度精密操作的实施,例如系膜孔关闭、血管高位结扎等。加之3D镜头可以获得更好的纵深感,使切割胃部时可以降低对周围血管、神经等组织的损伤程度,控制术中和术后并发症。相比于2D腹腔镜,3D腹腔镜的学习曲线相对缩短,单位时间内可熟练掌握的实习生数量更多,有利于临床主刀医生人力资源的培养[8]。立体的解剖环境更有利于对软组织相对空间位置进行记忆,可克服二维影像学习时的部分劣势。且3D腹腔镜并不会增加额外的手术成本,其实际操作流程与2D腹腔镜手术完全相同,无需另外单独购置配套器械,使其更加符合大多数患者的实际需求,也更有利于在基层医院中进行推广[9]。
本次研究结果显示,观察组患者采用3D腹腔镜胃癌根治术治疗后,术后并发症总发生率3.08%明显低于对照组(P<0.05),该研究结果与郑宇[10]发表文章的结果“3D组患者并发症总发生率7.78%低于2D组17.78%”相一致,由此证实3D腹腔镜胃癌根治术用于临床治疗胃癌效果更佳,且安全性更高。
总之,胃癌患者实施3D腹腔镜胃癌根治术治疗具有确切的效果,能够有效缩短手术用时,提高治疗效果,减少患者术后并发症,安全性更理想,值得临床推广。

