中国南海软珊瑚共附生真菌Emericellopsis sp. SCSIO41202的次级代谢产物研究
,杨 斌,李慧敏,付春钰,刘永宏,李云秋
(桂林医学院,广西 桂林 541199)
地球表面积占比最多的是海洋,拥有丰富的生物资源。近年来,海洋微生物作为候选药物新来源备受关注[1]。海洋真菌作为最为典型的海洋微生物,是产生具有独特结构的次级代谢产物的丰富来源之一,同时也被公认为药物候选开发的前沿资源。海洋环境的独特特征(如高盐、高压、缺氧和光照条件),导致海洋真菌能够产生不同于陆地微生物的次级代谢产物[2]。因此,来源于海洋的真菌被研究人员认为是寻找新药最重要的资源[3]。
珊瑚组成的生态系统中生活着丰富多样的真菌,其产生的次级代谢产物具有广泛的生物活性, 如抗菌、抗真菌、抗肿瘤、抗病毒和抗污损等[4-5]。Zubair等[6]从珊瑚sarcophytontrocheliophorum中分离得到sarcotrocheliol acetate和sarcotrocheliol对金葡菌、鲍曼不动杆菌属和耐甲氧西林金葡菌抗菌活性较强。Zheng等[7]从软珊瑚Alternariasp. ZJ-2008003中分离得到的Tetrahydroaltersolanol C和alterporriol Q能够抑制猪繁殖与呼吸综合征病毒(PRRSV),alterporriol P对PC-3和HCT-116细胞系具有抑制作用。
本论文通过对来源于南海海洋软珊瑚中分离得到的一株翅孢壳属真菌Emericellopsissp. SCSIO41202进行次级代谢产物的研究。经鉴定该株真菌与Emericellopsissp. GYJ3(1)(KM268654)有99%的同源性。从获得浸膏中获得大豆苷元(1)、5-甲氧基大豆苷元(2)、染料木素(3)、(3R,4S)-6,8-二羟基-3,4-二氢-3,4,5,7-四甲基异香豆素(4)、(3R,4R)-4-乙酰基-3,4-二氢-6,8-二羟基-3-甲氧基-5-甲基异香豆素(5)、(3S,4S)-4-乙酰基-3,4-二氢-6,8-二羟基-3-甲氧基-5-甲基异香豆素(6)、烟曲霉酸(7)、1H-吲哚-3-甲醛(8),共8个化合物。这些化合物均为从真菌Emericellopsissp. SCSIO41202中首次分离得到。
1 材料与方法
1.1 仪器与试剂
仪器:微生物生物安全柜(ESCO型),C615/605型中压色谱,半制备HPLC(Hitachi Primade型),EYELAN-1100V-W型旋转蒸发仪,核磁共振(AV-700型)。试剂:TLC硅胶板(青岛化工厂),硅胶(Merck公司),乙酸乙酯,丙酮等分析纯(广州大茂化学试剂有限公司)等。
1.2 菌株发酵与培养
菌株通过DNA扩增和ITS区序列与GenBank数据库比较鉴定为翅孢壳属(Emericellopsissp.)编号SCSIO41202,与Emericellopsissp. GYJ3(1)(KM268654)有99%的同源性。
将该菌株接种到马铃薯粉固体培养基上,在培养箱中活化1周,温度为28 ℃。将活化成功的菌株接种到150 ml三角烧瓶中,瓶中含有35 ml MB培养液(麦芽粉30 g,海盐5.0 g,蒸馏水2 000 ml,pH=7.4~7.8),摇床(180 r/min,25 ℃)培养3/d。将所得的种子液依次接种至液体培养基(麦芽粉20 g/L,葡萄糖10 g/L,酵母粉1 g/L,硫酸铵5 g/L,pH 6.0)中,共30瓶,同样摇床条件下培养2周。
1.3 提取分离纯化
菌株发酵结束后,每瓶发酵产物各加入两倍体积的乙酸乙酯浸泡、破碎机破碎、超声40 min,共萃取3次,浓缩后得到乙酸乙酯粗浸膏。将获得的浸膏用硅胶拌样,选择正相中压柱,按梯度进行洗脱(石油醚/乙酸乙酯:100∶0 ~ 1∶1,流速为50 ml/min;石油醚/乙酸乙酯/甲醇:9∶9∶1 ~ 0∶0∶100,流速为50 ml/min)。通过TLC检识以及液相紫外吸收图合并得3个馏分。其中Frs.1经ODS反相色谱梯度洗脱(VMeOH∶VH2O=3∶97 ~ 100∶0)得到21个子馏分,Frs.1-12经HPLC(VMeOH∶VH2O=45∶55)分别得化合物1(5.04 mg)和化合物2(2.59 mg),Frs.1-13经HPLC(VMeOH∶VH2O=46∶54)分离出化合物3(2.28 mg),Frs.1-8经HPLC(VMeOH∶VH2O=45∶55)分离出化合物4(6.43 mg),Frs.1-16经HPLC(VMeOH∶VH2O=60∶40)分离出化合物7(3.46 mg),Frs.1-9经HPLC(VMeOH∶VH2O=35∶65)分离出化合物8(5.11 mg);其中Frs.2经ODS反相色谱梯度洗脱(VMeOH∶VH2O=3∶97 ~ 100∶0)得到16个子馏分,Frs.2-10经HPLC(VMeOH∶VH2O=40∶60)分别得到两种对映异构体,为化合物5(4.82 mg)和化合物6(3.64 mg)。化合物1~8结构如图1所示。
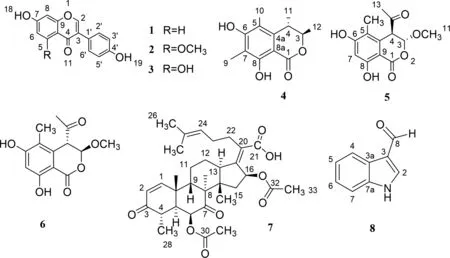
图1 化合物1~8结构
2 结构鉴定
2.1 化合物1的结构鉴定
淡黄色油状物,1H-NMR(700 MHz, MEOD)δH: 8.09(1H, s, H-2), 8.00(1H, d, J=8.8 Hz, H-5), 7.36(2H, m, H-2′, 6′), 6.88(1H, dd,J=8.8HZ, 2.2Hz, H-6), 6.84(2H, m, H-3′, 5′), 6.76(1H, t,J=1.7 Hz, H-8);13C-NMR(700 MHz, MEOD)δC: 154.4(CH, C-2),125.7(C, C-3), 178.2(C, C-4), 128.2(CH, C-5), 117.81(CH, C-6), 167.7(C, C-7), 103.5(CH, C-8), 160.2(C, C-9), 117.0(C, C-10), 124.5(C, C-1′),131.4(CH, C-2′,6′), 116.2(CH, C-3′,5′), 158.6(C, C-4′)。本研究数据和文献核磁数据[8]比对基本相同,所以鉴定为大豆苷元(daidzein)。
2.2 化合物2的结构鉴定
淡黄色油状物,1H-NMR(700 MHz, MEOD)δH: 7.98(1H, s, H-2), 7.36(1H, s, H-6), 7.36(2H,m,H-2′, 6′), 6.83(2H, d,J=8.6HZ, H-3′, 5′), 6.56(1H, s, H-8), 3.87(3H, s, OCH3);13C-NMR(700 MHz, MEOD)δC: 153.1(CH, C-2),125.4(C, C-3), 177.6(C, C-4), 152.6(C, C-5), 103.2(CH, C-6), 166.3(C, C-7), 103.8(CH, C-8), 157.0(C, C-9), 113.1(C, C-10), 124.9(C, C-1′),131.5(CH, C-2′,6′), 116.1(CH, C-3′,5′), 158.4(C, C-4′)。本研究数据和文献核磁数据[9]比对基本相同,所以鉴定为5-甲氧基大豆苷元(methoxydaidzein)。
2.3 化合物3的结构鉴定
淡黄色油状物,1H-NMR(700 MHz, MEOD)δH: 8.01(1H, s, H-2), 6.17(1H, d,J=2.1 Hz, H-6), 7.36(2H, m, H-2′, 6′), 6.84(2H, m, H-3′, 5′), 6.27(1H, t,J=1.1 Hz, H-8);13C-NMR(700 MHz, MEOD)δC: 154.5(CH, C-2),123.5(C, C-3), 182.0(C, C-4), 163.7(C, C-5), 100.9(CH, C-6), 168.4(C, C-7), 95.4(CH, C-8), 159.9(C, C-9), 105.6(C, C-10), 124.6(C, C-1′),131.4(CH, C-2′,6′), 114.6(CH, C-3′,5′), 158.8(C, C-4′)。本研究核磁数据和文献数据[8]比对基本相同,所以判断为染料木素。
2.4 化合物4的结构鉴定
淡黄色油状物;1H-NMR(700 MHz, MEOD)δH: 11.49(1H, s, OH-8), 6.53(1H, s, OH-6), 4.66(1H, qd,J=6.7, 1.1 Hz, H-3), 3.05(1H, qd,J=7.1, 1.0 Hz, H-4), 2.09(3H, s, Me-7), 2.06(3H, s, Me-5), 1.25(6H, dd,J=11.9, 6.9 Hz, Me-3,4);13C-NMR(700 MHz, MEOD)δC: 169.4(C=O, C-1),81.6(CH, C-3), 35.6(CH, C-4), 115.1(C, C-5), 162.5(C, C-6), 110.4(C, C-7), 161.4(C, C-8), 140.8(C, C-4a), 99.6(C, C-8a), 8.2(CH3, C-9),10.7(CH3, C-10), 19.9(CH3, C-11), 20.1(CH3, C-12)。本研究数据和文献核磁数据[10]比对基本相同,所以鉴定为(3R,4S)-6,8-二羟基-3,4-二氢-3,4,5,7-四甲基异香豆素。
2.5 化合物5的结构鉴定
粉红色粉末,1H-NMR(700 MHz, MEOD)δH:5.72(1H, d,J=1.3 Hz, H-3), 4.31(1H, d,J=1.3 Hz, H-4), 6.33(1H, s, H-7), 3.53(3H, s, H-11), 2.18(3H, s, H-13), 2.03(3H, s, H-14);13C-NMR(700 MHz, MEOD)δC: 169.3(C=O, C-1),103.2(C, C-3), 54.8(C, C-4), 117.4(C, C-5), 165.1(C, C-6), 102.3(CH, C-7), 163.7(C, C-8), 101.0(C, C-9), 136.1(C, C-10), 57.1(OCH3, C-11),204.5(C=O, C-12), 29.1(CH3, C-13), 11.1(CH3, C-14)。本研究数据和文献核磁数据[11]比对基本相同,所以鉴定为(3R,4R)-4-乙酰基-3,4-二氢-6,8-二羟基-3-甲氧基-5-甲基异香豆素。
2.6 化合物6的结构鉴定
粉红色粉末,1H-NMR(700 MHz, MEOD)δH: 5.54(1H, d,J=3.6 Hz, H-3), 4.51(1H, d,J=3.6 Hz, H-4), 6.33(1H, s, H-7), 3.65(3H, s, H-11), 2.26(3H, s, H-13), 2.00(3H, s, H-14);13C-NMR(700 MHz, MEOD)δC: 170.4(C=O, C-1),104.4(C, C-3), 53.9(C, C-4), 116.7(C, C-5), 164.8(C, C-6), 102.6(CH, C-7), 163.7(C, C-8), 101.6(C, C-9), 136.6(C, C-10), 58.0(OCH3, C-11),204.6(C=O, C-12), 31.9(CH3, C-13), 10.8(CH3, C-14)。本研究数据和文献核磁数据[11]比对基本相同,所以鉴定为(3S,4S)-4-乙酰基-3,4-二氢-6,8-二羟基-3-甲氧基-5-甲基异香豆素。
2.7 化合物7的结构鉴定
白色粉末,1H-NMR(700 MHz, DMSO)δH: 7.40(1H, d,J=10.0 Hz, H-1), 5.75(1H, d,J=10.0 Hz, H-2), 2.73(1H, dt,J=13.6, 6.7 Hz, H-4), 3.31(1H, s, H-5), 5.10(1H, ddt,J=8.8, 7.3, 1.5 Hz, H-6), 2.62(1H, dt,J=12.6, 2.5 Hz, H-9), 1.97(1H, m, H-11a), 1.60(1H, d,J=14.4 Hz, H-11b), 2.30(1H, dt,J=11.9, 6.2 Hz, H-12a), 1.71(1H, qd,J=12.4, 3.6 Hz, H-12b), 2.51(1H, d,J=7 Hz, H-13),2.26(1H, m, H-15a), 1.90(1H, m, H-15b), 5.63(1H, d,J=8.4 Hz, H-16), 0.79(3H, s, H-18), 1.37(3H, s, H-19), 2.39(2H, m, H-22), 2.13(1H, m, H-23a), 2.07(1H, s, H-23b), 5.03(1H, d,J=1.3 Hz, H-24), 1.56(3H, s, H-26), 1.64(3H, s, H-27), 1.11(3H, d,J=6.8 Hz, H-28), 1.09(3H, s, H-29), 1.87(3H, s, H-31), 2.07(3H, s, H-33);13C-NMR(700 MHz, DMSO)δC: 158.5(CH, C-1), 126.9(CH, C-2), 200.9(C=O, C-3), 40.0(CH, C-4), 48.0(CH, C-5),73.1(CH, C-6), 209.3(C=O, C-7), 52.3(C, C-8), 41.2(CH, C-9), 37.7(CH, C-10), 23.2(CH2, C-11), 25.5(CH2, C-12), 46.1(CH, C-13), 45.6(CH, C-14), 40.4(CH2, C-15), 73.1(CH, C-16), 144.3(CH, C-17), 17.6(CH3, C-18), 27.2(CH3, C-19), 131.1(C, C-20), 171.1(C=O, C-21), 29.3(CH2, C-22), 28.0(CH2, C-23), 123.3(CH, C-24), 37.7(C, C-25), 17.7(CH3, C-26), 25.4(CH3, C-27), 12.3(CH3, C-28), 17.7(CH3, C-29), 169.1(C=O, C-30), 20.4(CH3, C-31), 169.7(C=O, C-32), 20.5(CH3, C-33)。本研究数据和文献核磁数据[12]比对基本相同,所以鉴定为烟曲霉酸。
2.8 化合物8的结构鉴定
白色粉末,1H-NMR(700 MHz, MEOD)δH: 8.10(1H, s, H-2), 8.15(1H, dd,J=7.6, 1.3 Hz, H-4), 7.24(1H,dd,J=8.3, 7.9 H-5), 7.28(1H, dd,J=8.3, 7.1, H-6), 7.48(1H, d,J=8.1 Hz, H-7), 9.89(1H, s, H-8);13C-NMR(700 MHz, MEOD)δC: 169.3(C=O, C-8), 139.7(CH, C-2), 133.6(C, C-3),125.7(C, C-3a), 122.4(CH, C-4), 123.6(CH, C-5), 125.0(CH, C-6), 113.1(CH, C-7), 138.9(C, C-7a)。本研究数据和文献核磁数据[13]比对基本相同,所以鉴定为1H-吲哚-3-甲醛。
3 酶抑制活性分析
对化合物1~8在50 μg/ml浓度下对乙酰胆碱酯酶(AChE)和胰脂肪酶(PL)的抑制作用进行评价。实验结果显示,化合物1、3、6、7、8对AChE具有抑制作用,其中化合物3、7对PL也有抑制作用,而化合物7的抑制作用较强,见表1。
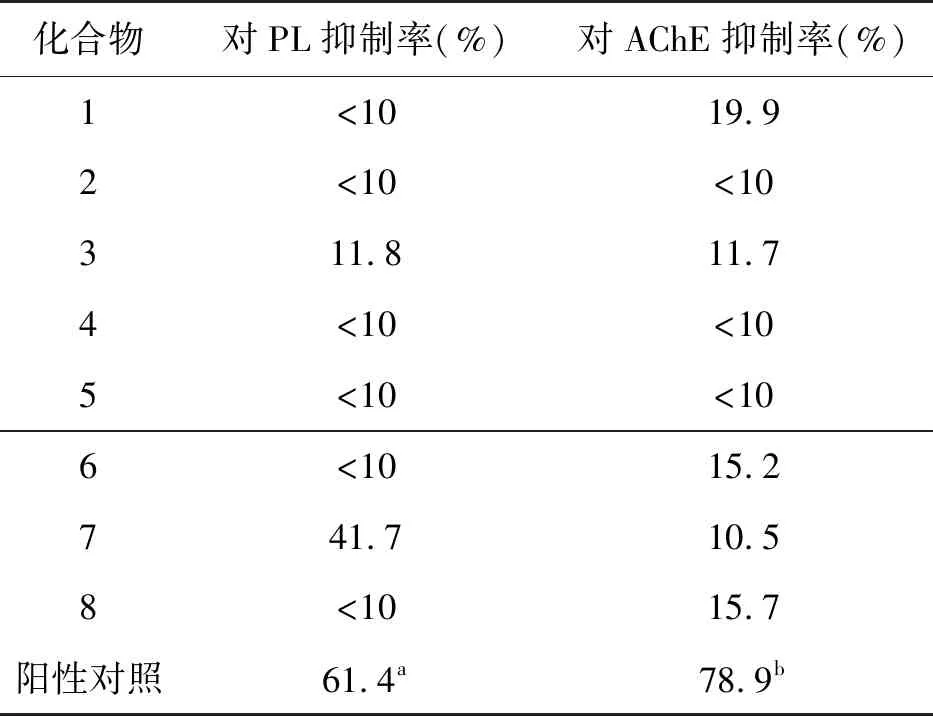
表1 化合物1~8对胰脂肪酶和乙酰胆碱酯酶的抑制活性
4 讨论
本文通过对中国南海软珊瑚来源共附生真菌Emericellopsissp. SCSIO41202的次级代谢产物的研究,共分得8个单体已知化合物:3个异黄酮类,3个异香豆素类,1个庚酸类以及1个单吲哚类生物碱。据相关文献报告,异黄酮类化合物表现出显著的α-葡萄糖苷酶抑制作用[14],同时,对于DPPH自由基具有较强的清除作用[15]。其中化合物1大豆苷元具有显著的抗心血管疾病、解痉和抗癌作用[16]。化合物3染料木素已被证明与顺铂和多西紫杉醇具有协同作用,能够增强对BxPC-3胰腺癌细胞的抗增殖作用[17]。化合物7烟曲霉酸对能够明显抑制B.subtilis以及MRSA活性,MIC值分别为2 μg/mL,4 μg/mL[18]。本研究中,化合物1、3、6、8对AChE和PL均有抑制作用,而化合物7抑制作用较强,达到41.7%。
经多项研究表明,该真菌Emericellopsis sp. SCSIO41202属于嗜碱性真菌,能够产生的多种类的次生代谢产物,化学活性多样。本文丰富了南海海洋软珊瑚中对于嗜碱性真菌Emericellopsis sp.次生代谢产物的研究,也说明了此翅孢壳属真菌中产出独特新颖结构与活性的巨大优势,是后续研究者在挖掘和研究先导化合物中值得关注的重点领域之一。

