醇提联合超声波辅助技术优化黄葵花总黄酮提取工艺研究①
,陈家益,姚玫红,谢小翠,伍纤纤,杨 渊
(广西卫健委全生命周期健康与保健研究重点实验室/桂林医学院公共卫生学院,广西 桂林 541199)
黄蜀葵[abelmoschus manihot(L.)Medic.]属锦葵科植物,椐《全国中草药汇编》记载,黄蜀葵为我国药食两用传统中药材[1],具有显著的临床疗效和营养价值。越来越多的研究者对它的化学成分测定进行广泛而深入的研究,主要集中于对黄葵花的化学成分研究[2]。关于黄葵花的活性成分的研究集中于黄酮类化合物及其单体,包括金丝桃苷、槲皮素、杨梅素、槲皮素-3′-O-β-D-葡萄糖苷、异槲皮苷等[3]。其中,金丝桃苷活性较强,性质稳定,故选择它作为黄葵花总黄酮含量测定质量控制的指标[4]。现代药理学表明,黄葵花提取物和活性成分具有改善肾功能、抗炎、镇痛、抑菌、抗病毒、保护心脑缺血损伤、抗氧自由基、抗肿瘤、抗抑郁等多种药理活性[5],具有广阔的开发前景和研究意义。
迄今为止,对黄葵花总黄酮的提取技术及方法比较分散,还没有形成一套系统高效的提取工艺。本研究目的是建立超声波辅助提取黄葵花总黄酮优化参数。提取过程使用单因素实验和正交试验进行了优化,为后续黄葵花总黄酮的批量生产、产品开发提供技术支持。
1 材料与方法
1.1 试剂
黄葵花药材购于中国安徽省亳州市谯城区药材中心中心街112号,石英酶标板定制于江苏省连云港市,金丝桃苷标准品(编码:Q817147-20 mg,纯度≥98.0%)购于天津希恩思生化科技有限公司,所有试剂及化学品均为AR级(天津市大茂化学试剂厂),使用去离子水。
1.2 仪器与设备
多功能酶标仪(赛默飞世尔科技,Varioskan LUS),超声清洗器(东莞市科桥超声波设备有限公司,KO-2500E),高速冷冻离心机(美国贝克曼库尔特,Avanti JXN-26),循环水式多用真空泵[上海力辰邦西仪器科技有限公司,SHZ-D(III)],电子天平[赛多利斯科学仪器(北京)有限公司,SQP],高速多功能粉碎机(上海顶帅电器有限公司,LD-Y500A),超纯水仪器(广西南宁市博美生物科技有限公司,Milli-Q Direct)。
1.3 提取程序
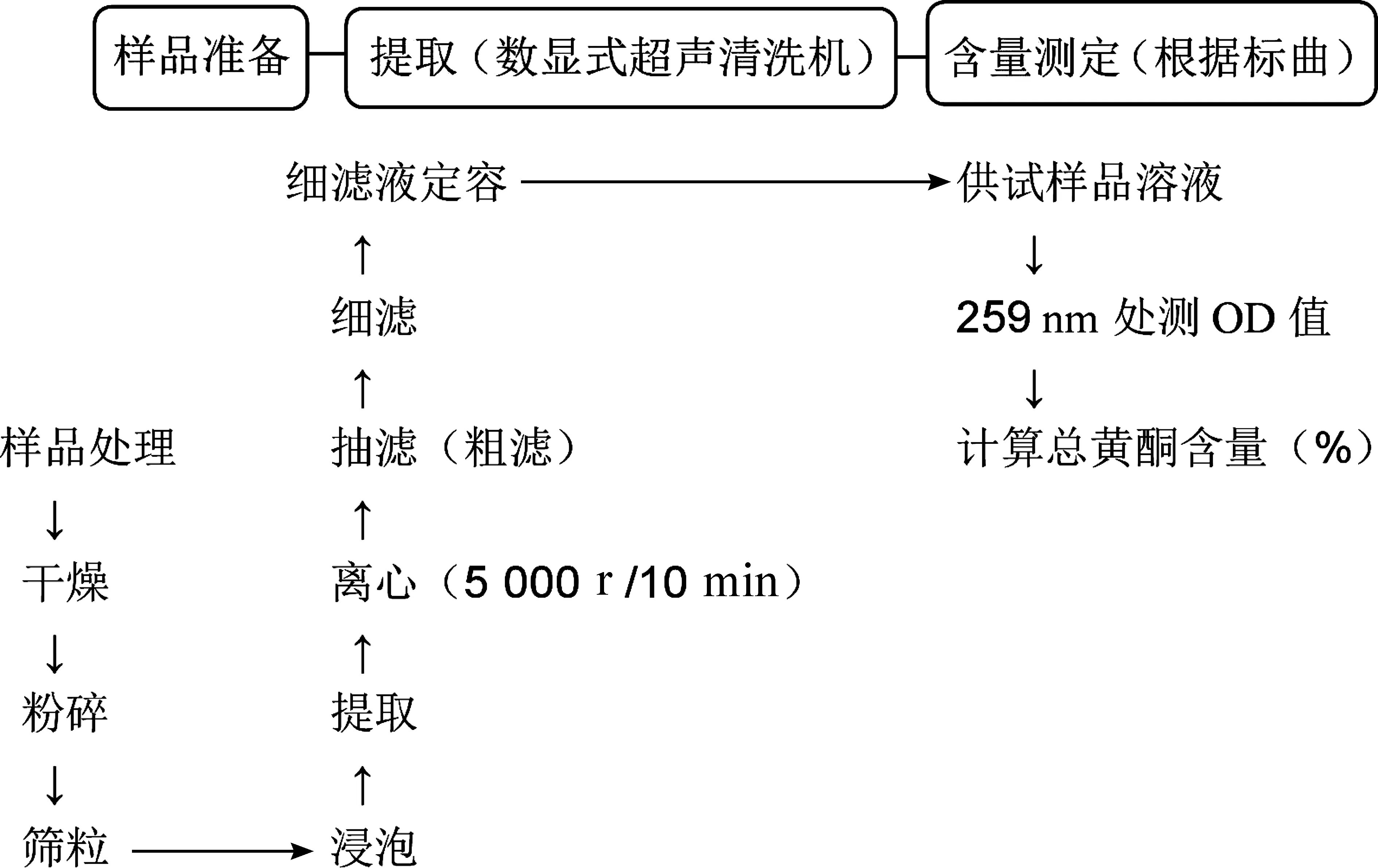
1.4 含量测定(改良酶标仪比色法)
1.4.1 对照品溶液配制 配制200 μg/ml的标准品溶液,精密称取已干燥至恒重的金丝桃苷标准品2 mg至10 ml容量瓶中,用70%乙醇溶解并定容至刻度。摇匀即得。
1.4.2 测定波长的选择 精密量取标准品溶液60 μl,供试品溶液30 μl于试管中,分别加乙醇至1 ml,混匀。各取200 μl至石英酶标96孔板,摇匀;同时取乙醇200 μl作为空白对照,在200~500 nm范围内扫描吸收曲线,确定其最大吸收波长。
1.4.3 标准曲线的建立 从200 μg/ml的标准品溶液中分别精密量取0、5、15、25、50、75、100、125、150、175 μl于试管中,加入乙醇至1 ml,混匀。各管取200 μl至石英酶标96孔板;同时取乙醇200 μl作为空白对照,于259 nm处测定吸光度,以吸光度为纵坐标,浓度为横坐标,用除零浓度以外的测定数据直接求回归方程,制作标准曲线。
1.4.4 供试样溶液配制及含量测定 由不同实验设计的条件要求,按照1.3项的提取程序得到供试样。取供试样溶液10~20 μl于试管中,加乙醇至1 ml,混匀。量取200 μl至石英酶标96孔板,同时取乙醇200 μl作为空白对照,在259 nm处测定吸光度,设置2~3个平行组。由标准曲线回归方程计算供试样品中总黄酮的含量。
1.4.5 精密度实验 精密吸取供试样溶液20 μl,按1.4.4项方法测定吸光度,设计3个平行组。利用酶标仪动力学测量功能模块,重复测定6次,计算吸光度值的RSD。
1.4.6 稳定性实验 取由1.3项提取程序制备的供试品溶液,分别于0 h、0.5~1 h、1~2 h、12 h、15 h、1周测定吸光度,计算总黄酮含量。
1.4.7 回收率实验 取供试品溶液依次加入4 μg/ml、8 μg/ml和12 μg/ml的金丝桃苷标准液500 μl。然后按1.4.4项方法测量并计算回收率。
1.5 提取工艺优化实验
1.5.1 单因素实验 采用超声提取法,对主要影响提取效率的样筛孔径(不筛,90~850 μm)、乙醇浓度(50%~90%)、浸泡时长(1~3 h)、料液比(1∶20~1∶120 g/ml)、提取温度(30~70 ℃)、提取时间(10~50 min),提取次数(1~3次)7个因素设置不同水平,进行单因素实验。
1.5.2 正交试验 根据单因素实验结果,筛选出各因素适宜的水平范围作为正交试验优化的基础,以总黄酮含量为评价指标,采用正交设计标准表L18(3)7建立7因素3水平正交试验组合,见表1。

表1 正交试验因素与水平
2 结果
2.1 黄葵花总黄酮含量测定及验证
根据1.4项方法,确定标准品与供试样品在259 nm处均有最大吸收;在1~35 μg/ml范围内,吸光度与黄葵花总黄酮含量呈良好的线性关系,线性方程为A=0.04690C+0.06030,r2=0.9978;精密度实验中OD测量值的RSD均在2%以内,表明这种测定方法的精密度良好;稳定性实验中样品1周内总黄酮含量测定结果的RSD均小于2%,表明供试品溶液在1周内稳定;回收率实验中平均回收率大于98%,RSD为0.012%,表明该法符合含量测定要求。
2.2 单因素实验结果
2.2.1 样筛孔径对总黄酮提取率的影响 由结果图1(A)可知,随着样筛孔径的减小,黄葵花总黄酮的提取量逐渐增加。当样筛孔径为90 μm时,总黄酮提取量最高;以不筛的粉末为对照,不筛的比样筛孔径为850 μm、250 μm时提取得到总黄酮含量要高,比样筛孔径为150 μm、90 μm时的低。因此,选择不筛、样筛孔径为150 μm、90 μm的黄葵花粉末进一步优化研究。
2.2.2 料液比对总黄酮提取率的影响 如图1(B)所示,随着料液比的减小,总黄酮含量逐渐增加。当料液比减少到1∶80 g/ml之后,所测得总黄酮含量趋于稳定或略微减少,可见黄葵花中的总黄酮已被提取完全。故后续实验中的料液比优化在 1∶60 g/ml和 1∶100 g/ml 之间。
2.2.3 乙醇浓度对总黄酮提取率的影响 乙醇作为最环保的溶剂之一,具有经济性、安全性和可持续性[6]。因此,选择乙醇作为提取溶剂。如图1(C)所示,黄葵花总黄酮的提取量随着乙醇浓度的增大而增加。在70%乙醇时观察到总黄酮最大产量,总黄酮含量随着乙醇浓度的进一步增大而减少。因此,后续实验乙醇浓度选择在60%~80%之间优化。
2.2.4 浸泡时长对总黄酮提取率的影响 研究浸泡时长对黄葵花总黄酮的影响,结果见图1(D),浸泡时长为2 h时黄酮含量达到峰值,然后出现下降的趋势。从经济角度考虑,后续实验中浸泡时长在1~3 h之间优化是最佳的。
2.2.5 提取次数对总黄酮提取率的影响 测定不同提取次数对黄葵花总黄酮含量的影响,结果见图1(E),总黄酮含量在提取2次时基本达到最大值,综合考虑生产需求,后续实验提取次数优化在1~3次之间是最理想的选择。
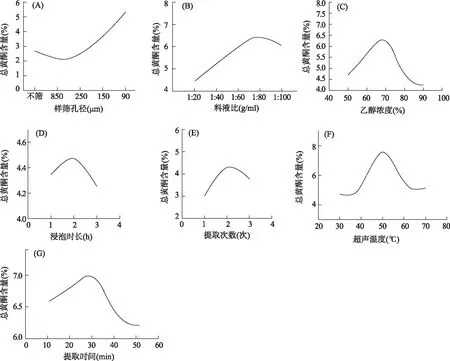
图1 不同参数对总黄酮提取率的影响(A) 样筛孔径对总黄酮提取率的影响;(B) 料液比对总黄酮提取率的影响;(C) 乙醇浓度对总黄酮提取率的影响;(D)浸泡时长对总黄酮提取率的影响;(E)提取次数对总黄酮提取率的影响;(F)温度对总黄酮提取率的影响;(G) 提取时间对黄葵花总黄酮提取率的影响
2.2.6 提取温度对总黄酮提取率的影响 如图1(F)所描绘,提取温度在30 ℃~50 ℃之间总黄酮提取率逐渐增加至峰值。但当温度达到60 ℃时,总黄酮的提取率降低。因此,后续实验选择40 ℃~60 ℃之间的提取温度进行优化。
2.2.7 提取时间对总黄酮提取率的影响 由图1(G)可知,在 10~30 min之间,总黄酮的提取率随时间增加而增加,并且达到峰值。但是随着超声提取时间的继续延长,提取率逐渐降低。考虑到节约时间及能源,后续实验选择提取时间优化在20 min~40 min之间。
2.3 正交试验及验证
正交试验方案及结果见表3,根据极差R值,各因素对总黄酮提取率的影响顺序为样筛孔径、提取次数、提取时间、浸泡时长、料液比、乙醇浓度、提取温度。最佳工艺组合为A3B3C1D2E3F3G1,即样筛孔径90 μm,料液比1∶100,乙醇浓度60%,浸泡时长2 h,提取次数3次,提取温度60 ℃,提取时间20 min。根据表4所示的方差分析结果,样筛孔径、浸泡时长、提取次数、提取时间是显著影响因素(P<0.05)。
按照正交设计筛选出的最优工艺,进行3次平行验证试验,得到总黄酮在黄葵花中的平均含量为6.807%,RSD为0.007%,表明该工艺稳定,合理可行。

表3 正交试验方案及结果

表4 正交试验方差分析
3 讨论
到目前为止,多种提取技术已被用于黄葵花黄酮化合物的提取。如索氏回流、加热回流[7],超声提取[8],改良超临界二氧化碳萃取[9],但黄葵花提取工艺以传统的乙醇加热提取为主。超声波辅助提取是新型、绿色的技术,通过超声波辐射溶液产生的机械效应、热效应、空化效应等作用,瞬时破坏药材细胞壁,增强溶剂渗透作用[10],具有省时、高效、简单的优势。
根据验证试验结果,确定改良酶标仪比色-不显色法[11]测定黄葵花总黄酮的含量可行,该方法比紫外-可见分光光度法操作简单,线性范围良好[12],与HPLC法一样可准确定量测定,并且效率高,更适合大量样品的检测[13]。高贯威等[14]也报告了基于某种比色法应用酶标仪进行活性物质测定的类似研究。
正交试验应用正交原理和数理统计,通过最少的实验次数选出较优条件的组合,应用于中药提取活性物质的条件优化中[15]。正交试验表明样筛孔径、浸泡时长、提取次数、提取时间在醇提联合超声正交优化实验中对黄葵花总黄酮溶解度影响更显著。①样筛孔径:样筛孔径越小,能够滤过的粒径越小,黄葵花总黄酮溶解度亦越大。根据Mai等[16]的说法,黄酮类化合物含量随着粒径的减小而显著增加,具有更大表面积的更细颗粒会加速黄酮类化合物从样品基质中溶解直至饱和。②浸泡时长:物质完全溶解于溶剂需要一定时间[17],浸泡时间越长,越有利于黄葵花总黄酮的溶解,直至完全溶解至饱和。然而浸泡时间过长后,其他杂质也溶解,会影响总黄酮的溶解度。③提取次数:随着超声提取次数的增加,黄酮类物质逐渐被溶解出来。提取到一定次数时,黄葵花中的总黄酮已经基本被溶出,继续增加提取次数,总黄酮的得率不会明显提高,相关研究中也报告提取次数和提取率之间的类似关系[18]。④提取时间:提取过程中细胞内外总黄酮的浓度在一定时间前没达到平衡,随着提取时间的增加,总黄酮逐渐溶解到平衡状态。如果继续延长提取时间,会导致总黄酮长时间暴露在超声波下易降解[16]。
本研究结果表明,超声辅助技术可作为从黄葵花中提取总黄酮的有效方法。在单因素实验的基础上,采用正交试验对提取变量进行优化,发现样筛孔径、浸泡时长、提取次数、提取时间是影响黄葵花总黄酮提取率的关键因素,并确定了最佳提取参数。此外,应用酶标仪比色法优化了黄葵花总黄酮含量测定,为黄葵花总黄酮相关产品精深开发提供了科学依据。

