花姜酮对急性肝损伤大鼠Nrf2/HO-1/NQO-1氧化应激损伤的影响
石洪林 余文胜
肝脏是人体重要的新陈代谢及排毒脏器,其主要通过肝酶对进入人体的药物、酒精、蛋白质、脂肪等外源性物质进行氧化还原、水解催化等生化反应[1]。由于肝脏所负责的代谢功能较多,病毒感染、过量脂肪堆积、药物滥用、酒精过量等原因易造成肝脏生理功能及生理结构的损伤,也是肝纤维化、肝硬化、肝癌等肝脏疾病的重要促发因素。肝脏损伤的发生和发展与其组织中线粒体结构被破坏、线粒体呼吸链活性被抑制、活性氧(ROS)异常堆积增多,从而加剧氧化应激损伤有着密切的关系[2-3]。花姜酮是姜科姜属植物红球姜[Zingiberzerumbet(L.)Smith]根茎中的倍半萜化合物,具有消肿镇痛、抗炎、抗氧化、抗帕金斯、抗肝损伤等药理活性[4-5]。虽然近年来关于花姜酮对急性肝损伤的作用有了初步研究,但未深入阐明其具体的作用机制[6]。本研究通过四氯化碳诱导建立急性肝损伤大鼠模型,深入研究花姜酮对急性肝损伤小鼠的作用及其可能作用机制,为临床应用花姜酮治疗肝损伤提供科学的实验数据。
1 材 料
1.1动物 SD 大鼠50 只,SPF 级,雌雄各半,体质量(200±20)g,由浙江大学实验动物中心提供,实验动物使用许可证:SYXK(浙)2018-0016,实验动物生产许可证:SCXK(浙)2018-0006。大鼠饲养于通风良好的环境,室温18~25℃,相对湿度40%~70%,12h光照昼夜循环。实验开始前大鼠进行适应性喂养1周。该实验属于前期课题申请的基础研究,完全遵照动物实验的伦理要求进行。
1.2药物 花姜酮:美国Sigma 有限公司,批号B 201541;联苯双酯滴丸:北京协和药厂,批号20201206。
1.3试剂 四氯化碳(分析纯):成都市科隆化工试剂厂,批号20 191122;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、丙二醛(MDA)、羟自由基(·OH)、活性氧(ROS)、三磷酸腺苷(ATP)、线粒体呼吸链复合物Ⅰ、Ⅲ(ComplexⅠ、Ⅲ)试剂盒:南京建成,批号20210504、20210507、20210513、20210523、20210527、20210514、20210612、20 210608;锰-超氧化物歧化酶(Mn-SOD)、过氧化氢酶(CAT)酶联免疫吸附测定(ELISA)试剂盒:晶美生物工程有限公司,批号20210613、20 210604;兔抗小鼠核因子E2 相关因子2(Nrf-2)、醌氧化还原酶-1(NQO-1)、血红素加氧酶1(HO-1)多克隆抗体:美国Cell Signaling Technology 公司,批号21354、21476、21427;actin 多克隆抗体(中国Proteintech 公司,批号10586-BH)。
1.4主要仪器 UVmini-1240 型紫外-可见分光光度计(岛津国际贸易上海有限公司);TGL-16G 高速台式冷冻离心机(杭州汇尔仪器设备有限公司);9602A-酶标仪(北京艾普生设备有限公司);垂直电泳仪、转膜及显影设备(美国BIO-RAD 公司)。
2 方 法
2.1动物分组及给药 使用随机数字表法将50 只SD 大鼠分为五组:空白组、模型组、联苯双酯组(40mg/kg)、花姜酮低剂量组(5mg/kg)、花姜酮高剂量组(10mg/kg),每组10 只。腹腔注射相对应药物,每天1 次,每次注射0.8mL,连续注射5d。空白组、模型组大鼠腹腔注射等体积生理盐水。
2.2急性肝损伤模型建立[7]末次注射给药2h 后,模型组、联苯双酯组及花姜酮低、高剂量组腹腔注射0.2%四氯化碳花生油溶液(0.01mL/g),建立急性肝损伤大鼠模型。空白组予等体积花生油腹腔注射。
2.3生化指标检测 注射四氯化碳花生油溶液后16h 戊巴比妥钠麻醉大鼠,大鼠腹主动脉取血,3500r/min 高速低温离心机分离10min,吸取上清液。按试剂盒说明书操作,采用ELISA 法检测大鼠肝功能指标AST、ALT 及抗氧化指标Mn-SOD、CAT、ComplexⅠ、Ⅲ活性、氧化因子MDA、·OH、ROS、ATP含量。
2.4Western blot 法检测 Western blot 法检测肝组织Nrf-2、NQO-1、HO-1 蛋白表达水平。冰浴下制备肝脏10%的匀浆液,12 000r/min,有效离心半径8cm,4℃,高速离心5min,分离上清液。用BCA 法测定蛋白浓度,加入上样缓冲液,根据目的蛋白分子量的大小采用不同浓度的分离胶进行SDS-PAGE 凝胶电泳。将配置好的SDS-PAGE 胶置于电泳槽中,待用蛋白置于水锅中煮沸5min 后,混匀,上样孔中分别加入Marker 及样品蛋白,转移至PVDF 膜,5%脱脂奶粉封闭,洗膜,加入相对应的一抗,4℃孵育过夜,TBST 溶液洗膜,加入稀释的二抗,水平摇床中孵育60min,TBST 溶液洗膜,暗室中曝光显影。凝胶电泳成像分析系统扫描,Image J 软件分析蛋白条带。
2.5病理学检测 切除部分肝脏,制作石蜡,将其切片在二甲苯中脱蜡,移入二甲苯与纯乙醇(1∶1)的混合液中,乙醇逐级脱水,苏木精染液染色,水洗玻片上多余的染液,0.5%盐酸乙醇分色,蒸馏流水冲洗,0.5%伊红染液染色,乙醇逐级脱水,二甲苯透明,封片,显微镜观察肝组织病变程度。
2.6统计学方法 应用SPSS 16.0 软件进行统计分析。所得实验数据均符合正态分布,以均数±标准差()表示,多组间比较采用单因素方差分析,若方差齐性,进一步采用Bonferroni 法进行两两比较;若方差不齐,采用Kruska-Wallis H 秩和检验;P<0.05为差异有统计学意义。
3 结果
3.1各组大鼠血清ALT、AST 水平比较 与空白组比较,模型组大鼠血清ALT、AST 含量显著增加(P<0.05)。与模型组比较,联苯双酯组及花姜酮高、低剂量组大鼠血清ALT、AST 含量均有所下降(P<0.05)。与联苯双酯组比较,花姜酮高剂量组ALT 含量较高,AST 含量较低(P<0.05)。见表1。
表1 各组大鼠血清ALT、AST 水平比较(U/mL,)
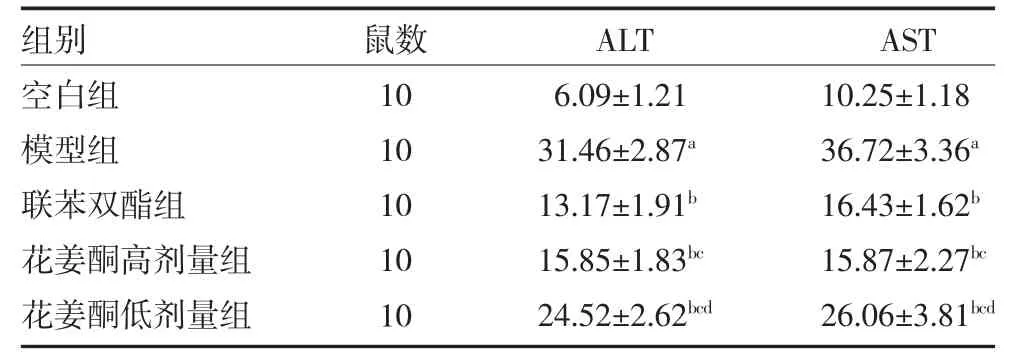
表1 各组大鼠血清ALT、AST 水平比较(U/mL,)
注:空白组为健康SD 大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;联苯双酯组为肝损伤模型大鼠,予3.75mg/kg 联苯双酯混悬液;花姜酮高剂量组为肝损伤模型大鼠,予10mg/kg 花姜酮混悬液;花姜酮低剂量组为肝损伤模型大鼠,予5g/kg 花姜酮混悬液;ALT为天门冬氨酸氨基转移酶;ALT 为丙氨酸氨基转移酶;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与联苯双酯组比较,cP<0.05;与花姜酮高剂量组比较,dP<0.05
3.2各组大鼠肝组织病理学结果比较 HE 染色结果显示,空白组大鼠肝脏细胞结构完整,形态清晰且大小形态均一,排列整齐呈放射状;模型组大鼠肝脏细胞大小不一,且呈不规律排列顺序,有大面积空泡变性及出现大量炎症细胞浸润和肝细胞坏死;联苯双酯组肝组织细胞排列较模型组整齐且规律,细胞形态较好,空白变性较少,炎症细胞浸润减少;花姜酮高剂量组肝组织细胞结构较完整,排序基本呈放射状排列,空泡数量及炎症浸润细胞较少;花姜酮低剂量组细胞结构损伤较严重,细胞形状及大小不一,排列混乱,较模型组整齐,空泡数量及炎症浸润细胞较多。见图1。
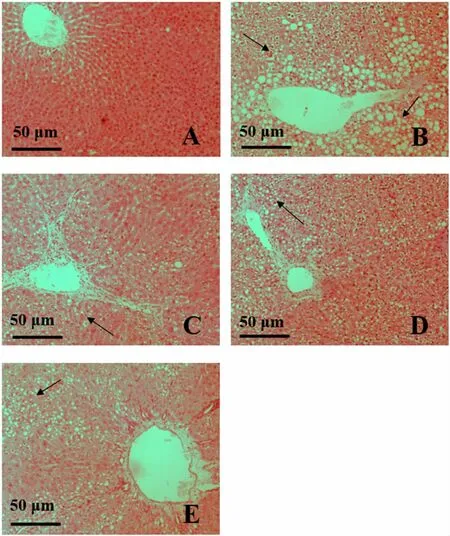
图1 各组大鼠肝组织病理学结果(HE 染色×400)
3.3各组大鼠肝组织Mn-SOD、CAT 活性及MDA含量比较 与空白组比较,模型组大鼠肝脏组织Mn-SOD、CAT 活性降低,MDA 含量增加(P<0.05)。与模型组比较,联苯双酯组及花姜酮高、低剂量组大鼠肝组织Mn-SOD、CAT 的活性增加,MDA 含量减少(P<0.05)。与联苯双酯组比较,花姜酮高剂量组CAT 活性较高、MDA 含量较多(P<0.05),Mn-SOD 活性无明显差异(P>0.05)。见表2。
表2 各组大鼠肝组织氧化因子Mn-SOD、CAT 活性及MDA 含量比较()
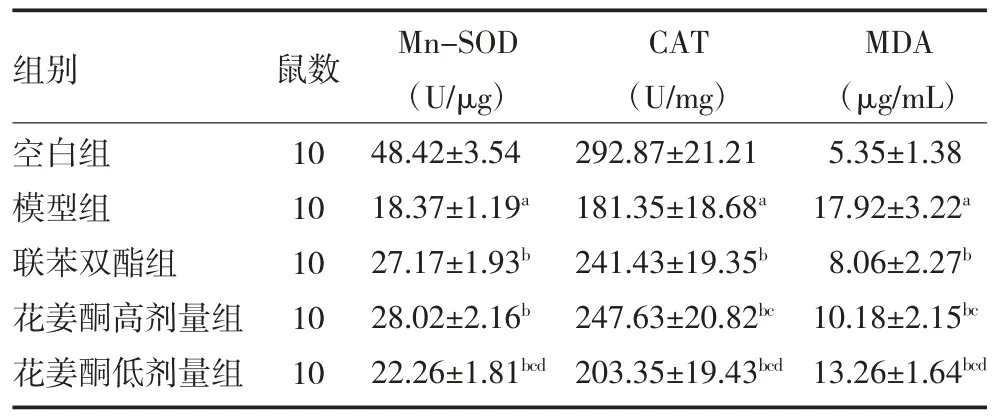
表2 各组大鼠肝组织氧化因子Mn-SOD、CAT 活性及MDA 含量比较()
注:空白组为健康SD 大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;联苯双酯组为肝损伤模型大鼠予3.75mg/kg 联苯双酯混悬液;花姜酮高剂量组为肝损伤模型大鼠予10mg/kg 花姜酮混悬液;花姜酮低剂量组为肝损伤模型大鼠予5g/kg 花姜酮混悬液;Mn-SOD为锰-超氧化物歧化酶;CAT 为过氧化氢酶;MDA 为丙二醛;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与联苯双酯组比较,cP<0.05;与花姜酮高剂量组比较,dP<0.05
3.4各组大鼠肝组织ROS、·OH 含量比较 与空白组比较,模型组大鼠肝组织·OH、ROS 含量明显增加(P<0.05)。与模型组比较,联苯双酯组及花姜酮高、低剂量组大鼠肝组织·OH、ROS 含量显著降低(P<0.05)。与联苯双酯组比较,花姜酮高剂量组ROS、·OH 含量较低(P<0.05)。见表3。
表3 各组大鼠肝组织ROS、·OH 含量比较(nmol/mg,)
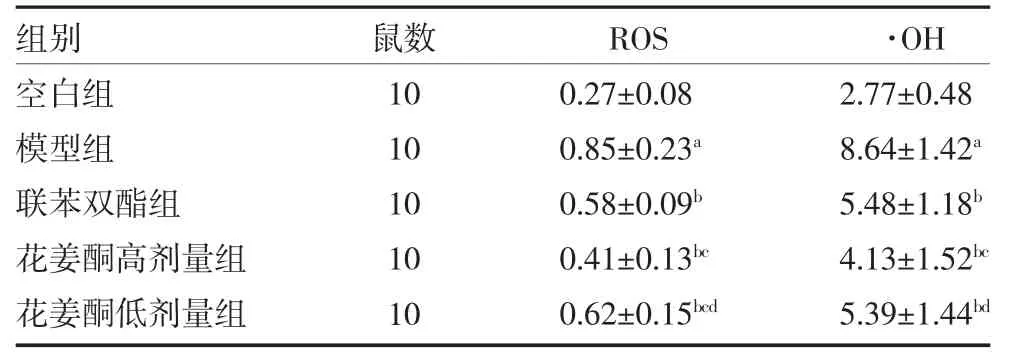
表3 各组大鼠肝组织ROS、·OH 含量比较(nmol/mg,)
注:空白组为健康SD 大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;联苯双酯组为肝损伤模型大鼠予3.75mg/kg 联苯双酯混悬液;花姜酮高剂量组为肝损伤模型大鼠予10mg/kg 花姜酮混悬液;花姜酮低剂量组为肝损伤模型大鼠予5g/kg 花姜酮混悬液;ROS 为活性氧;·OH 为羟自由基;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与联苯双酯组比较,cP<0.05;与花姜酮高剂量组比较,dP<0.05
3.5各组大鼠肝组织ComplexⅠ、ComplexⅢ活性及ATP 含量比较 与空白组比较,模型组大鼠肝组织ComplexⅠ、Ⅲ活性降低,ATP 含量减少(P<0.05)。与模型组比较,联苯双酯组及花姜酮高、低剂量组大鼠肝组织ComplexⅠ、Ⅲ活性提高ATP 含量增加(P<0.05)。与联苯双酯组比较,花姜酮高剂量组ComplexⅠ、Ⅲ活性及ATP 含量较高(P<0.05)。见表4。
表4 各组大鼠肝组织ComplexⅠ、ComplexⅢ活性及ATP 含量比较()
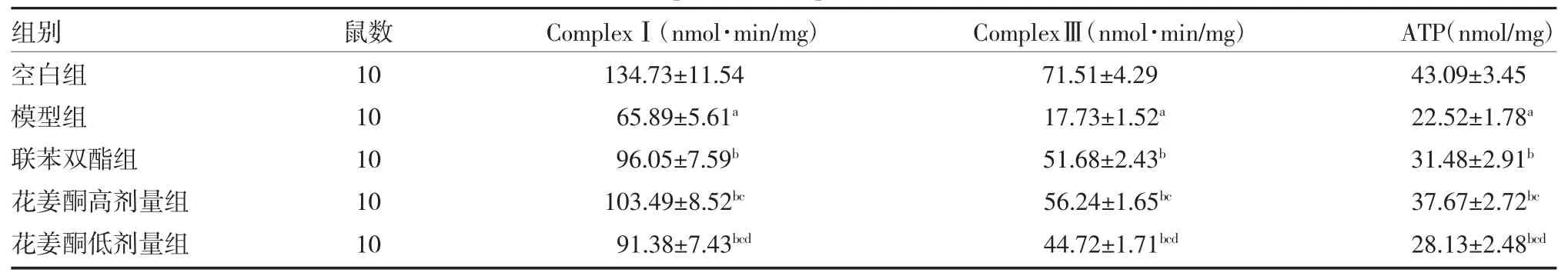
表4 各组大鼠肝组织ComplexⅠ、ComplexⅢ活性及ATP 含量比较()
注:空白组为健康SD 大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;联苯双酯组为肝损伤模型大鼠予3.75mg/kg 联苯双酯混悬液;花姜酮高剂量组为肝损伤模型大鼠予10mg/kg 花姜酮混悬液;花姜酮低剂量组为肝损伤模型大鼠予5g/kg 花姜酮混悬液;ComplexⅠ为线粒体呼吸链复合物Ⅰ;ComplexⅢ为线粒体呼吸链复合物Ⅲ;ATP 为三磷酸腺苷;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与联苯双酯组比较,cP<0.05;与花姜酮高剂量组比较,dP<0.05
3.6各组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达比较 与空白组比较,模型组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达减少(P<0.05)。与模型组比较,联苯双酯组及花姜酮高、低剂量组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达增加(P<0.05)。与联苯双酯组比较,花姜酮高剂量组Nrf-2、NQO-1、HO-1 蛋白表达较高(P<0.05)。见表5,图2。
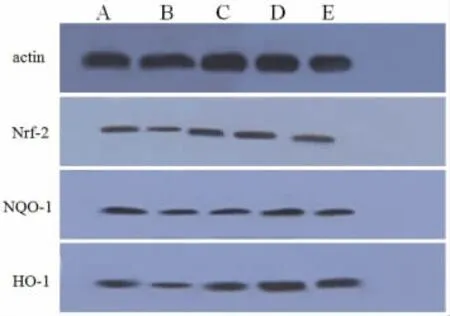
图2 各组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达比较
表5 各组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达比较(相对表达量,)
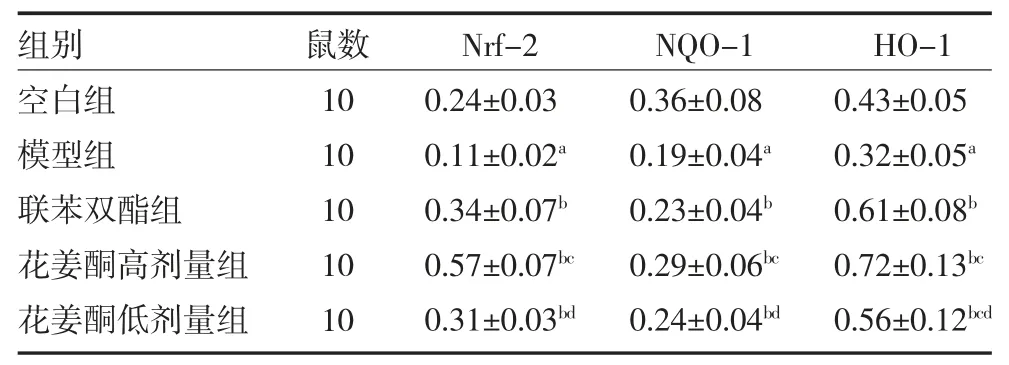
表5 各组大鼠肝组织Nrf-2、NQO-1、HO-1 蛋白表达比较(相对表达量,)
注:空白组为健康SD 大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;联苯双酯组为肝损伤模型大鼠予3.75mg/kg 联苯双酯混悬液;花姜酮高剂量组为肝损伤模型大鼠予10mg/kg 花姜酮混悬液;花姜酮低剂量组为肝损伤模型大鼠予5g/kg 花姜酮混悬液;Nrf-2 为核因子E2 相关因子2;NQO-1 为醌氧化还原酶-1;HO-1 为血红素加氧酶1;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与联苯双酯组比较,cP<0.05;与花姜酮高剂量组比较,dP<0.05
4 讨论
肝细胞对ROS 生成能力远高于清除能力,引起产生与清除之间不平衡,而造成的肝脏氧化应激损伤在肝脏疾病的病理进程中起重要作用[8]。线粒体在正常呼吸过程中,会有一小部分氧气不能完成传输电子,而形成具有细胞毒性的氧自由基。正常情况下,肝脏可通过酶系统和小分子抗氧化剂的抗氧化防御系统对所产生的氧自由基通过氧化还原平衡进行消除[9-10]。但当肝脏功能受损或障碍时,线粒体呼吸过程所产生的氧自由基会与具有完整电子分子的氧原子上的电子进行配对,使其成为新的氧自由基。同时肝脏对ROS 消除能力下降,细胞内大量的ROS 产生及堆积,对DNA 碱基反应进行破坏,并促使生物膜发生脂质氧化,进而形成氧化应激,触发细胞内的凋亡联级反应,引起肝细胞损伤及凋亡[11]。
Nrf-2 是重要的抗氧化转录因子,其与改善氧化应激引起的细胞损伤有着重要的关系[12]。研究表明,在病毒性肝炎、脂肪肝、肝纤维化等急慢性肝损伤中Nrf-2 是治疗的关键调控因子[13-14]。Nrf-2 可通过环氧氯丙烷相关蛋白1(Keap1)依赖途径和非依赖途径被激活,使其由细胞质转移到细胞核中,与特定的抗氧化反应元件(ARE)结合后,激活下游Mn-SOD、CAT 等抗氧化酶的活性,提高机体内源性抗氧化能力,增加机体对氧化自由基ROS、·OH 的清除效率,减少氧化应激对线粒体的损伤,进而改善线粒体的呼吸效能[15-16]。实验结果表明,花姜酮能提高肝脏中CAT、Mn-SOD 的活性及ATP 含量,降低·OH、ROS、MDA 的含量,同时增加肝脏中ComplexⅠ、Ⅲ活性,提示花姜酮能提高机体的抗氧化防御系统功能,减缓氧化应激损伤。
HO-1、NQO-1 是Nrf-2 下游的Ⅱ相解毒酶。在氧化应激损伤过程中,HO-1、NQO-1 可催化血红蛋白降解产生胆绿素和CO 等产物,减少脂质过氧化含量,发挥抗氧化、抗炎的作用。同时HO-1、NQO-1 也可防止细胞凋亡,降低肝脏损伤相关标志物表达,是抗氧化中重要的防御分子。故Nrf2/HO-1/NQO-1 信号通路是减少氧化应激对肝脏损伤的有效途径。实验结果表明,花姜酮能增加肝脏中Nrf-2、NQO-1、HO-1 蛋白表达。
综上所述,花姜酮能改善急性肝损伤大鼠肝功能、增加抗氧化因子CAT、Mn-SOD 的活性及ATP 含量,增强对ROS、·OH、MDA 的清除能力,提高肝脏中ComplexⅠ、Ⅲ活性及Nrf-2、NQO-1、HO-1 蛋白表达,减缓氧化应激对肝脏的损伤,达到对急性肝损伤模型大鼠的保护作用,其作用机制与花姜酮调控Nrf2/HO-1/NQO-1 信号通路有着密切的关系。

