铜锌铝催化剂制备方法对CO2加氢反应性能影响
任 超,徐 波,王安杰,刘颖雅,孙志超,王 瑶
(大连理工大学 化工学院,辽宁 大连 116023)
0 引 言
将CO2加氢转化为高附加值化学品是目前实现CO2资源化利用,解决过量碳排放,达成“碳中和”的重要途径之一。其中,利用CO2加氢制低碳烯烃技术可有效将CO2转化为作为基础化工原料的小分子烯烃,而目前乙烯、丙烯等低碳烯烃的生产主要采用石油烃的高温蒸汽裂解技术。因此,CO2加氢制低碳烯烃相关技术的深入研究对CO2资源化利用和缓解现代化工对石油资源的依赖具有重要意义。
目前,CO2加氢制低碳烯烃的反应路径主要有2条:① 以CO为中间体的路径,即CO2经逆水煤气转化与费-托合成反应制低碳烯烃。该路径多以Fe、Co基催化剂为主,得到的产物分布较广,且受到费托合成产物分布规律制约,同时还伴随着较高的甲烷选择性[1-2]。② 以甲醇为中间体的路径,经两步串联反应得低碳烯烃,即CO2与H2先在加氢活性中心上生成甲醇,然后甲醇在酸催化中心脱水得到低碳烯烃(MTO)[3]。该路径的第1步所用催化剂多为Cu基催化剂,如CuZnAl、CuZnZr等。第2步所用催化剂多为分子筛,如SAPO-34、ZSM-5等。经两步串联反应所得的产物碳数分布在C1~C4,可提高产物中低碳烯烃选择性。因此,近年来以甲醇为中间体进行的CO2加氢制低碳烯烃的反应路径备受关注。目前,由于CO2加氢制甲醇过程与甲醇制烯烃过程(MTO)反应条件不同,若将以上2个过程在一个反应器中实现,须研制与分子筛高效协同的Cu基催化剂。
不同制备方法得到的Cu基催化剂的结晶性、颗粒尺寸、孔隙分布以及被还原的难易度等存在诸多差异,从而导致反应性能差异。因此,制备方法的优化与调整可能是调控Cu基催化剂与分子筛协同效果的有效手段。目前已有很多研究工作详细探讨了不同制备方法对Cu基催化剂催化CO2加氢制甲醇性能的影响。TURSUNOV等[4]分别采用浸渍法和沉淀法合成Al2O3和SiO2负载的CuO-ZnO催化剂。研究表明浸渍法催化剂的催化性能更优异,尤其在氧化铝载体上浸渍制备的催化剂对甲醇的选择性和活性最高。可能原因是浸渍法所得的氧化铜颗粒较小、分散度高、更易在氢气处理下被还原以及Al2O3载体所具有的高稳定性。ANGELO等[5]采用共沉淀法与溶胶-凝胶法制备了以ZrO2、CeO2、Al2O3以及ZrO2-CeO2为载体的CuZnM催化剂,发现以ZrO2为载体,共沉淀法合成的催化剂的活性最优。该催化剂表现出良好的CO2转化率(23%),甲醇选择性为33%。BONURA等[6]分别采用常规碳酸氢钠共沉淀法、柠檬酸络合法和凝胶-草酸共沉淀法制备了3种Cu-Zn-Zr催化剂,考察了制备方法对CO2加氢制甲醇Cu-Zn-Zr体系结构和催化性能的影响。其中,草酸凝胶共沉淀法催化剂的催化性能优于其他方法的催化剂。这可能是因为催化剂中铜的粒径更小且比表面积更大。而对于CO2加氢制低碳烯烃的反应,由于反应过程中存在Cu基催化剂与分子筛催化剂的协同作用,且反应温度等条件的改变使得催化剂达到最优催化性能的制备方法也有所差异。因此,深入研究不同铜锌铝催化剂(Cu/ZnO/Al2O3,简称CuZnAl)制备方法对CuZnAl与ZSM-5协同催化 CO2加氢制低碳烯烃的影响同样具有重要意义。
笔者选用最典型的CuZnAl催化剂作为CO2加氢制甲醇活性组分,选择ZSM-5分子筛作为甲醇脱水制取低碳烯烃的活性组分,研究多种制备CuZnAl催化剂的溶胶-凝胶法和共沉淀法对CuZnAl//ZSM-5体系催化CO2加氢制低碳烯烃性能的影响。
1 催化剂制备与表征
1.1 催化剂制备
采用不同的方法制备铜、锌、铝物质的量比为6∶3∶1的CuZnAl催化剂[7]。
1.1.1溶胶-凝胶法
分别以柠檬酸(C6H8O7·H2O)、酒石酸(C4H6O6)和乙二胺四乙酸(EDTA,C10H16N2O8)为络合剂,制备了CuZnAl催化剂。
1)柠檬酸络合剂。柠檬酸络合[8]:称取适量的三水合硝酸铜(Cu(NO3)2·3H2O)、六水合硝酸锌(Zn(NO3)2·6H2O)和九水合硝酸铝(A1(NO3)3·9H2O)溶解在去离子水中,加入单口烧瓶中,油浴60 ℃搅拌1 h。将一水合柠檬酸溶解后,超声15 min。将其缓慢滴入上述混合溶液中,油浴95 ℃强烈搅拌,冷凝回流反应12 h,蒸除溶剂,直至形成凝胶状黏稠液体,停止加热。120 ℃干燥12 h,500 ℃焙烧5 h,然后压片、研磨,筛分出0.38~0.83 mm(20~40目)的催化剂备用,制得CuZnAl催化剂前体,制备的催化剂记为CZA-N。
柠檬酸-氨水络合:在混合盐溶液中滴入柠檬酸水溶液后,滴加适量氨水调节pH为7[9-10],其余步骤与柠檬酸络合法一致,相应的催化剂记为CZA-NA。
2)酒石酸络合剂。合成步骤与柠檬酸络合剂合成步骤相似,将柠檬酸换成酒石酸[11],制得CuZnAl催化剂前体,得到的催化剂分别记为CZA-L(酒石酸络合剂)和CZA-LA(酒石酸-氨水络合剂)。
3)EDTA络合剂。合成步骤与柠檬酸络合剂合成步骤相似,将柠檬酸换成EDTA[11],制得CuZnAl催化剂前体,得到的催化剂分别记为CZA-E(EDTA络合剂)和CZA-EA(EDTA-氨水络合剂)。
1.1.2沉淀法
分别采用无水碳酸钠(Na2CO3)、草酸(C2H2O4·2H2O)以及尿素(CH4N2O)为沉淀剂制备CuZnAl催化剂。
1)碳酸钠沉淀剂。称取适量的铜、锌和铝硝酸盐溶解在去离子水中,加入单口烧瓶中,油浴60 ℃搅拌1 h至其完全溶解混合均匀。将碳酸钠溶解[12-14],超声15 min。以并流共沉淀的方式沉淀,滴加过程中溶液pH为7.0~8.0,然后70 ℃搅拌2 h。室温下老化12 h,超声15 min,抽滤、水洗、干燥、焙烧、压片,制得CuZnAl催化剂前体,对应的催化剂记为CZA-Na。
2)草酸沉淀剂。传统草酸沉淀法[15]:制备方式与碳酸钠沉淀法类似,用草酸替换无水碳酸钠,将其滴入混合盐溶液中,制得CuZnAl催化剂前体,相应的催化剂记为CZA-CH。
草酸凝胶沉淀法:将传统草酸沉淀法中的溶剂换为无水乙醇[16-17],沉淀完全后离心分离,制得CuZnAl催化剂前体,相应的催化剂记为CZA-CC。
3)尿素沉淀剂。称取适量的铜、锌和铝硝酸盐溶解在去离子水中,加入单口烧瓶中,油浴60 ℃搅拌1 h至其完全溶解混合均匀。将尿素[18-19]溶解([尿素]/[M+]物质的量之比为6.0),超声15 min。将其缓慢滴入硝酸盐水溶液中,油浴加热至90 ℃并强烈搅拌,开始水解反应,冷凝回流12 h。制得CuZnAl催化剂前驱体,相应的催化剂记为CZA-NS。
1.1.3机械混合法
称取适量的铜、锌和铝硝酸盐,置于玛瑙研钵中,充分研磨搅拌后,转入50 mL坩埚中,干燥、焙烧、压片、筛分得到0.38~0.83 mm(20~40目)颗粒,对应的催化剂记为CZA。
1.2 催化剂表征
使用Rigaku D/Max-2400型X射线衍射仪(XRD)对催化剂进行表征。辐射源为Cu-Kα(λ=0.154 18 nm),Ni滤波,管电压为45 kV,电流为200 mA。扫描2θ为5°~80°,扫描速度10 (°)/min。
低温N2物理吸附在Micrometric TriStarⅡ-3020分析仪上进行,采用BET(Brunauer-Emmett-Teller)方法计算样品的比表面积。样品测试前在120 ℃真空处理4 h。
H2程序升温脱附(H2-TPR)在分析仪(Chembet 3000)上进行。还原前先用Ar在350 ℃下恒温吹扫催化剂1 h,然后降至室温后,切换至H2,以10 ℃/min程序升温脱附,用热导检测H2消耗量。
1.3 催化剂性能评价
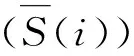
(1)
(2)
(3)
式中,Fin(CO2)为CO2的输入量;Fout(CO2)为CO2的输出量;Fout(i)为i组分产物的输出量;S(CO)为CO的选择性。
2 结果与讨论
2.1 XRD表征
图1为采用溶胶-凝胶法、沉淀法以及机械混合法制备的CuZnAl催化剂前体的XRD谱图。由图1可知,在样品的谱图中,2θ=32.5°、35.6°、38.7°、48.7°、53.6°、58.2°、61.6°、66.2°、68.1°、75.3°处的衍射峰为CuO (JCPDS No.45-0937)的特征衍射峰,2θ为31.8°、34.5°、36.3°、56.7°、62.9°处的衍射峰为ZnO (JCPDS No.36-1451)的特征衍射峰。各样品XRD谱图均未观察到Al2O3的衍射特征峰,说明由于铝的加入量较少且Al2O3以无定型状态存在,或在催化剂前体中高度分散。不同方法制备的催化剂前体XRD谱图中,2θ=35.6°的CuO(002)晶面和2θ=36.3°的ZnO(101)晶面的特征峰重合,表明不同方法制备的催化剂中,CuO和ZnO之间存在强烈的相互作用[22]。
图1(a)为分别以柠檬酸、酒石酸和EDTA为络合剂,未用氨水或用氨水调节pH的CuZnAl催化剂前体的XRD图。图1(b)为不同沉淀剂制备催化剂的XRD谱图(CZA为机械混合法)。与机械混合法得到催化剂前体的XRD图相比,不同沉淀剂所得催化剂的ZnO特征峰更为宽化,这可能是由于不同沉淀剂得到样品中ZnO组分粒径更小或结晶度稍低。
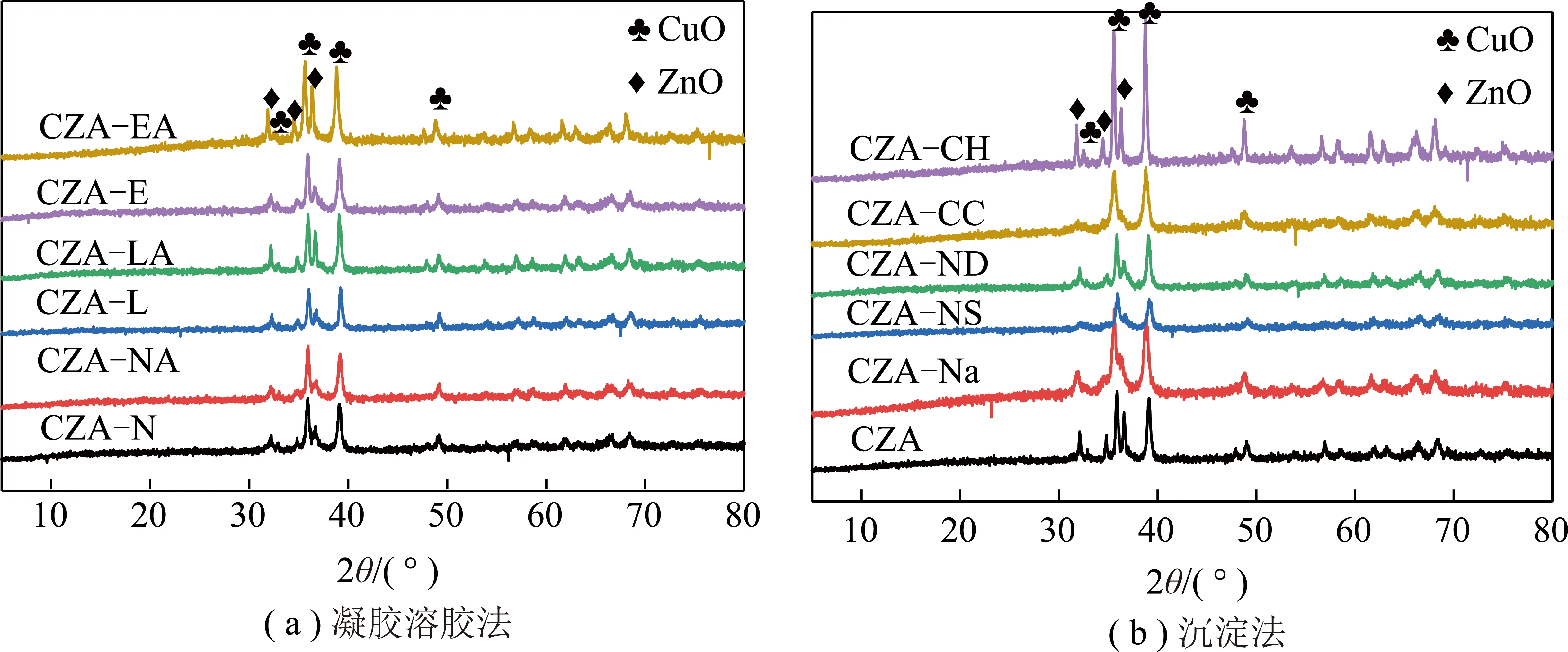
图1 催化剂的XRD表征Fig.1 XRD patterns of catalysts
利用Scherrer公式计算CuO晶粒的尺寸(表1)。由表1可知,不同的络合剂会显著影响催化剂前体中CuO晶粒尺寸(20~25 mm)。其中,柠檬酸络合剂(CZA-N)粒径最小,EDTA络合剂(CZA-E)次之,酒石酸络合剂(CZA-L)最大;从整体趋势来看,添加的氨水会导致催化剂前体的粒径略增加,这可能是在氨水环境下催化剂前体中的部分Cu组分形成了易溶的铜氨离子,从而阻碍金属盐离子与络合剂之间的络合效应。各催化剂前体中CuO粒径大小为CZA-LA>CZA-L>CZA-E>CZA-EA>CZA-NA>CZA-N。
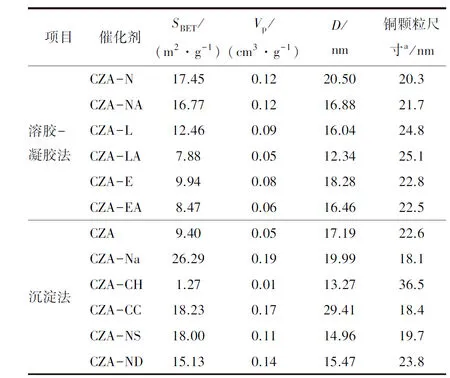
表1 催化剂的结构性质
沉淀法制备催化剂时,沉淀剂种类对催化剂前体中CuO晶粒尺寸影响较大(18~37 nm)。以碳酸钠为沉淀剂的所得催化剂前体(CZA-Na)中CuO晶粒尺寸最小,而以草酸沉淀法制备的催化剂前体(CZA-CH)中CuO晶粒尺寸最大。
2.2 N2物理吸附
不同方法制备的铜锌铝催化剂前体的N2吸附-脱附曲线如图2所示。

图2 催化剂的N2吸附脱附等温曲线Fig.2 N2 adsorption-desorption isotherm of catalysts
从图2的吸附脱附曲线可知,采用不同络合剂的溶胶-凝胶法和不同沉淀剂的沉淀法制备的催化剂前体的吸附-脱附等温线均为IV-H3型曲线,前体结构孔结构不规整,可能以堆叠的颗粒间隙为主,存在介孔和大孔结构。
各催化剂前体的孔结构参数见表1,由表1可知,采用溶胶-凝胶法制备催化剂时,络合剂的种类对催化剂比表面积和孔结构参数影响较大。催化剂前体比表面积的大小排序为CZA-N>CZA-NA>CZA-L>CZA-E>CZA-EA>CZA-LA。其中,柠檬酸做络合剂时,CuZnAl催化剂(CZA-N)具有较大的比表面积(17.45 m2/g)。通过对比比表面积与颗粒尺寸的大小顺序,可以发现在整体上基本遵循颗粒越小比表面积越大的趋势。不同络合剂采用氨水调节pH后的催化剂前体的比表面积和孔径均略有下降。这一现象进一步表明氨水的添加会阻碍金属盐离子与络合剂之间的有效络合,从而导致比表面积下降。
采用沉淀法制备催化剂时,沉淀剂种类对催化剂比表面积和孔结构参数影响较大。其中碳酸钠沉淀剂制备的催化剂(CZA-Na)前体具有最大的比表面积(26.29 m2/g)。而草酸沉淀剂制备的催化剂前体(CZA-CH)的比表面积最小,仅为1.27 m2/g。不同沉淀剂比表面积排序为:CZA-Na>CZA-CC>CZA-NS>CZA-ND>CZA>CZA-CH。结合前述不同制备方法得到的CuZnAl催化剂前体的比表面积与Cu组分粒径差异可知,CuO晶粒尺寸越小,其比表面积越大(CZA-Na-18.1 nm; CZA-CH-36.5 nm)。这一现象表明,所制备催化剂的比表面积可能主要由催化剂颗粒外表面和其堆砌间隙所贡献,而非颗粒内孔。这也与催化剂的IV-H3型吸附等温曲线所反映的非规整孔结构所对应。
2.3 H2-TPR表征
不同方法制备CuZnAl催化剂前体的H2-TPR曲线如图3所示。由图3可知,不同制备方法得到的催化剂前体在200~400 ℃均有一个H2消耗峰,为CuZnAl催化剂中CuO的还原峰[4]。H2消耗峰的出峰温度越低,表明催化剂中的Cu组分分散度越好,越易于被还原为活性单质Cu。图3(a)为络合法制备的催化剂前体H2-TPR曲线,由图3(a)可知,各催化剂耗氢峰的出峰温度的高低排序为:CZA-LA 图3 催化剂的H2-TPR曲线Fig.3 H2-TPR curves of catalysts 不同沉淀剂制备催化剂前体的H2-TPR如图3(b)所示。传统草酸沉淀法(CZA-CH)以及碳酸钠沉淀法(CZA-Na)制备的催化剂的H2耗峰温度向高温方向偏移。机械混合法(CZA)、尿素沉淀剂(CZA-NS)和碳酸钠沉淀剂(CZA-Na)制备的催化剂前体的H2-TPR曲线上,在略低于200 ℃时出现了一个不同程度的H2消耗峰,可能是部分氧化铜被氢还原为氧化亚铜。不同沉淀剂制备的催化剂前体中,氢耗峰的温度排序为:CZA-ND 在温度320 ℃,压力2.0 MPa,CO2∶H2=1∶3,空速3 600 mL/(g·h)的反应条件下,CuZnAl与ZSM-5的质量比为1∶1时,对不同方法制备的CuZnAl催化剂的CO2加氢性能进行了评价,结果见表2。 表2 不同催化剂的催化性能 该体系中,CO2转化率和CO总选择性与CuZnAl特性相关性较大,这可能与CuZn相的形成,Cu-ZnO间电子转移,反应过程中Cu+、Cu0的形成等有关,2者的协同机制仍需进一步深入研究。 1) 采用不同方法制备CuZnAl催化剂,与ZSM-5协同催化CO2加氢制低碳烯烃,CuZnAl催化剂的特性对CO2转化率和CO选择性影响较大,但对有机产物中碳烃产物分布影响不大,说明CuZnAl和ZSM-5协同催化体系中烃类产物的分布由ZSM-5分子筛催化的MTO过程控制。 2) 采用不同络合剂的溶胶-凝胶法制备的CuZnAl催化剂中,柠檬酸络合法制备的催化剂(CZA-N)具有最大的比表面积,且铜物种的粒径更小,CO2转化率最高(20.17%),低碳烯烃选择性为50.48%。络合过程中加入氨水调节pH后,各催化剂的催化性能均有所下降。 3)不同沉淀剂的沉淀法制备的CuZnAl催化剂中,采用碳酸钠沉淀法制备的催化剂(CZA-Na)比表面积最大,表现出最佳的催化活性,CO2转化率为29.14%,低碳烯烃选择性为54.57%。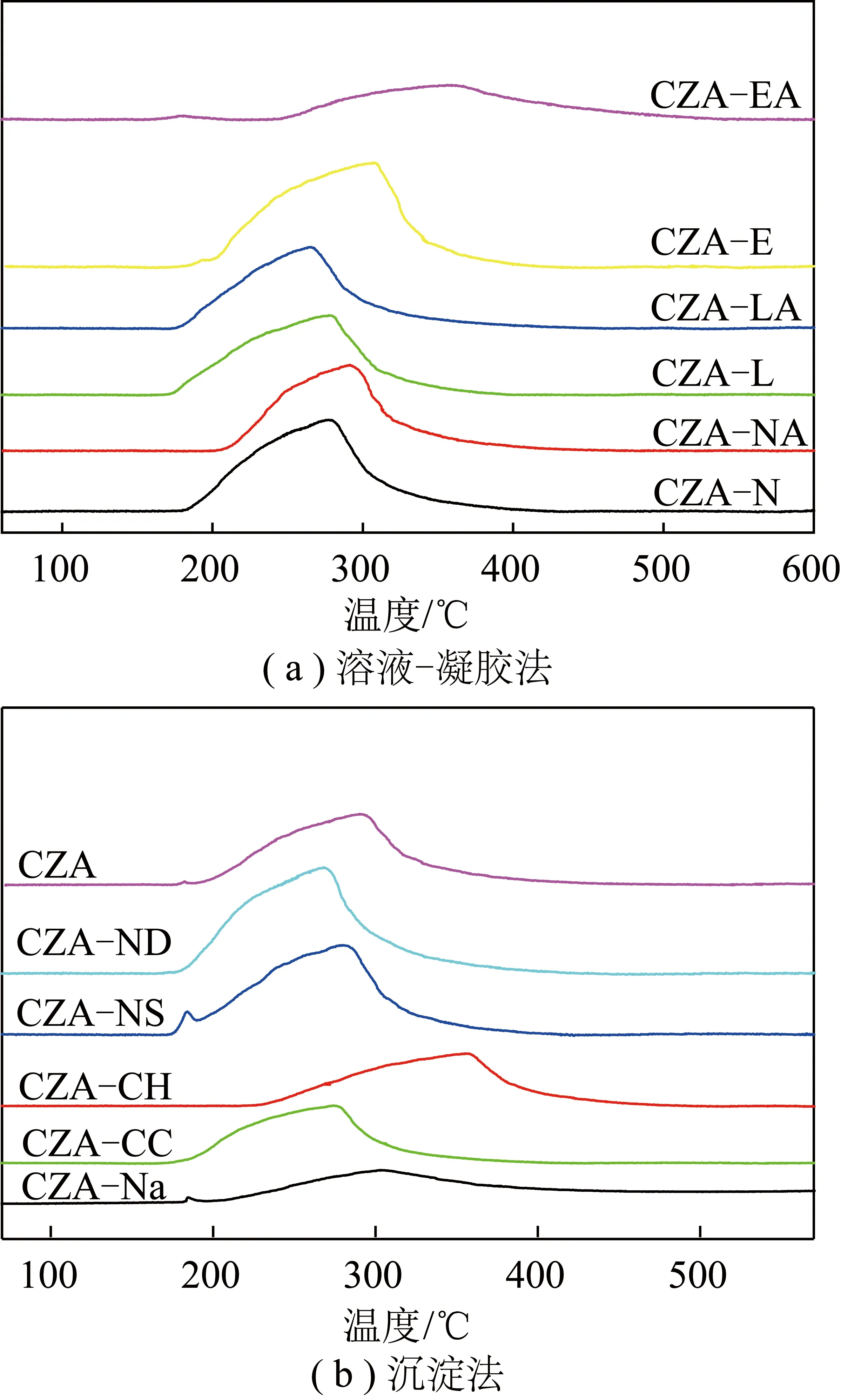
2.4 催化剂性能评价


3 结 论

