不同致病力青枯雷尔氏菌诱导番茄防御相关信号途径基因的表达分析
郑雪芳,王梓然,朱育菁,陈燕萍,王阶平,刘 波
(1. 福建省农业科学院农业生物资源研究所,福建 福州 350003;2. 厦门大学生命科学学院,福建 厦门 361102)
0 引言
【研究意义】由青枯雷尔氏菌(Ralstonia solanacearum,简称青枯菌)引起的番茄青枯病是一种毁灭性土传病害[1],在全国各番茄种植区域普遍发生,尚无有效的药剂防治,主要依靠抗病品种、嫁接苗、栽培措施等。青枯菌在自然界中存在致病力分化现象[2-4],其无致病力突变株可以侵染植株,不引起寄主植物产生病害,具有重要的生防应用潜力[5]。【前人研究进展】青枯菌无致病力菌株及其作用机制有许多报道[6-9]。Frey等[6]用hrp-突变体防治番茄青枯病,病情指数比对照降低80%,并推迟25 d发病。杨宇红等[7]研究表明,无致病力青枯菌hrp-突变体对致病性青枯菌虽无直接抑制作用,但其可在寄主体内定殖,阻止致病性青枯菌的增殖。刘波等指出,病原菌弱毒株侵入植株体内,诱导植物产生类似“弱菌株免疫保护”的防病作用[8]。Feng等[9]报道预接种无致病力青枯菌ΔhrpB突变株,可诱导拟南芥抗病相关基因表达,其中26%上调表达的基因参与脱落酸(ABA)生物合成和信号传导。植物受到外界因子诱导,体内基因会有不同的响应,从而出现基因表达水平不同[10]。植物激素,如水杨酸(salicylic acid, SA)、茉 莉 酸(jasmonic acid, JA)和 乙 烯(ethylene, ET)信号转导途径及其交互作用在植物免疫应答中发挥极其重要的作用[11-12]。【本研究切入点】目前青枯菌致病性菌株诱导番茄、马铃薯和花生等寄主信号转导途径相关基因表达的报道较多[13-15],但是,无致病力青枯菌与番茄互作研究有待深入探讨。我们前期研究已筛选获得一株高防效(番茄盆栽苗和田间防效分别为100%和77.45%)的青枯菌无致病力菌株FJAT1458[16-17],但其诱导抗病机制未明确。【拟解决的关键问题】比较分析青枯菌无致病力菌株FJAT1458和强致病力菌株FJAT91对番茄SA信号转导途径防御相关基因gluA和PR-1a,JA信号转导途径防御相关基因pin2和loxA及ET信号转导途径防御相关基因PR-1b和Osmotin-like表达量的变化,为探明菌株FJAT-1458诱导番茄系统防御反应的分子机制提供依据。
1 材料与方法
1.1 供试材料
青枯菌无致病力菌株FJAT1458和强致病力菌株FJAT91分别分离自健康番茄和青枯病发病植株,由福建省农业科学院农业生物资源研究所菌种库收集保存。青枯菌培养的固体培养基TTC的配制参照Kelman的方法[18],液体培养基为SP(蔗糖20 g,蛋白胨5 g,KH2PO40.5 g,MgSO40.025 g,定容至1 L,pH 7.0)。番茄品种为金石王1号,购自厦门如意集团开发有限公司。
1.2 试验方法
1.2.1 菌株活化和接种处理 青枯菌无致病力菌株FJAT1458和强致病力菌株FJAT91在TTC平板上活化,30 ℃、48 h后,转接至SP培养基,于170 r·min-1、30 ℃培养24 h,两种菌液均稀释至108CFU·mL-1,分别灌根接种于5~6叶龄的番茄盆栽苗上,100 mL·盆-1,每处理20盆(1株·盆-1),设3个重复。接种无菌水为对照(CK)。接种处理后的0、3、6、12、24、36、48、72 h进行取样,随机采取500 mg左右的番茄叶片,放入液氮中速冻,之后迅速放入-80 ℃冰箱备用。
1.2.2 总 RNA的提取 采用Transzol Up Plus RNA提取试剂盒(北京全式金生物技术有限公司)提取番茄叶片总RNA。参照说明书进行提取。提取的RNA用1%琼脂糖凝胶电泳进行检测,并用紫外分光光度计检测RNA的纯度及浓度。
1.2.3 cDNA的合成 按照RevertAid First Stand cDNA Synthesis Kit(Thermo)反转录试剂盒的操作方法,将各处理番茄叶片总RNA进行反转录合成cDNA。获得的cDNA产物直接用于PCR或-80 ℃保存备用。
1.2.4 防御基因荧光定量PCR RT-PCR采用10 μL反应体系:5.0 μL TransStart®Top/Tip Green qPCR Super-Mix (2×),正反向引物各0.5 μL,cDNA模板1 μL,加水至10 μL;RT-PCR的反应程序为95 ℃预变性30 s,94 ℃ 5 s,60 ℃ 退火/延伸30 s,45个循环。荧光定量引物见表1,由上海生工生物工程股份有限公司合成。

表 1 RT-PCR检测基因的特异引物序列Table 1 Specific primer sequences used for RT-PCR
1.3 数据分析
数据分析以管家基因actin作为内参,采用公式方法计算防御基因的表达量[19]。计算公式如下:目的基因相对表达量数据分析采用Excel 2010、DPS 16.05和Graphpad Prism 7.0软件。
2 结果与分析
2.1 不同致病力青枯菌诱导SA途径防御基因gluA和PR-1a的表达结果分析
青枯菌无致病力菌株FJAT1458和强致病力菌株FJAT91均诱导番茄gluA和PR-1a基因的表达量呈先上升后下降的趋势,接种12 h,两种基因在强或无致病力菌株诱导下表达量均达最大值。在观察期内(3 h除外),无致病力菌株FJAT1458诱导番茄gluA基因的表达量均显著大于对照组,而接种强致病力菌株FJAT91初期(3~24 h)诱导番茄gluA基因表达量显著高于对照组,接种72 h后则显著低于对照(P<0.05)。接种初期(12 h前),强致病力菌株FJAT91诱导gluA基因的表达量显著高于无致病力菌株FJAT1458(P<0.05),后期(24 h后)则相反(图1-A)。此外,接种后3~36 h,强致病力菌株FJAT91诱导PR-1a基因表达量均显著高于无致病力菌株FJAT1458和对照组(图1-B)。

图 1 接种青枯菌不同时间番茄叶片gluA基因(A)和PR-1a基因(B)相对表达量Fig. 1 Relative expressions of gluA (A) and PR-1a (B) in tomato leaves after R. solanacearum inoculation for different time lengths
2.2 不同致病力青枯菌诱导JA途径防御基因loxA和pin2的表达结果分析
观察期内(3 h除外)无致病力菌株FJAT1458诱导番茄植株loxA和pin2基因表达量均显著高于对照组(P<0.05)。接种初期(3~24 h)无致病力菌株FJAT1458诱导番茄植株loxA基因表达量显著低于强致病力菌株FJAT91,接种后期(48 h后),FJAT1458诱导番茄植株loxA基因表达量显著高于FJAT91处理(P<0.05)(图2-A)。菌株FJAT1458和FJAT-91诱导番茄植株pin2基因表达量最大值分别出现在接种后12 h和6 h,分别为CK的131.36倍和186.69倍;FJAT-91诱导番茄植株pin2基因相对表达量在12~24 h骤降,接种12 h 后,其诱导pin2基因相对表达量均显著低于FJAT1458处理(P<0.05)。
2.3 不同致病力青枯菌诱导ET途径抗性基因PR-1b和Osm的表达结果分析
观察期内(48 h除外),无致病力菌株FJAT1458诱导番茄植株Osm基因表达量均显著高于CK,接种12 h,FJAT1458 诱导Osm基因表达量达到最大值,为CK的7.68倍。强致病力菌株FJAT-91 诱导番茄植株Osm基因表达量呈现“先上升后下降”趋势,接种12 h达最大值,为对照组13.86倍,接种72 h,其诱导Osm基因表达量与对照组相当,显著低于FJAT1458处理组(图3-A)。接种3~24 h,FJAT1458诱导PR-1b基因表达量显著低于FJAT-91处理组,接种36 h后则相反,PR-1b基因在FJAT1458处理组的表达量显著高于FJAT-91处理组(P<0.05)(图3-B)。
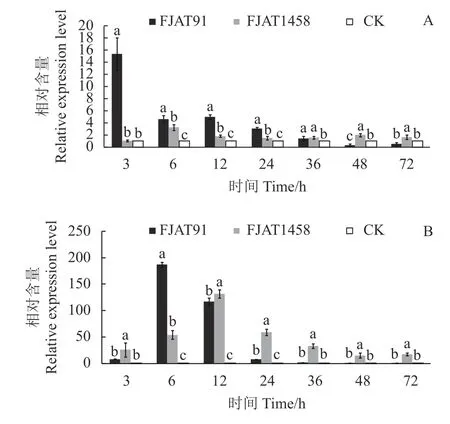
图 2 接种青枯菌不同时间番茄叶片loxA基因(A)和pin2基因(B)相对表达量Fig. 2 Relative expressions of loxA (A) and pin2 (B) in tomato leaves after R. solanacearum inoculation for different time lengths
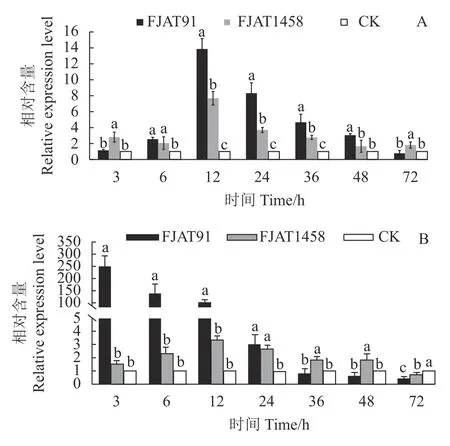
图 3 接种青枯菌不同时间番茄叶片Osm基因(A)和PR-1b基因(B)相对表达量Fig. 3 Relative expressions of Osm (A) and PR-1b (B) in tomato leaves after R. solanacearum inoculation for different time lengths
3 讨论与结论
许多研究表明,青枯菌的无致病力突变株能够诱导植物各个信号途径的系统防御基因的表达[20-21]。陈达[20]研究表明,青枯菌phcA-突变株接种3 d,其对番茄SA、JA和ET信号途径防御基因都有不同程度的诱导,而青枯菌phcA-突变株和hrp-突变株能有效诱导烟草SA和JA信号途径防御基因的表达。本研究发现,青枯菌强弱菌株均能诱导番茄植株SA信号转导途径gluA和PR-1a基因、JA信号转导途径pin2和loxA基因及ET信号转导途径PR-1b和Osmotinlike(osm)基因的相对表达,表明接种青枯菌能够激活番茄植株系统防御反应。
刘俊平等[21]比较了青枯菌GMI1000的hrp-突变株与出发菌株GMI1000对PR-1a基因的诱导情况,发现在接种GMI1000菌株12 h时PR-1a的表达量最高,之后,表达量降低,本研究同样发现青枯菌强致病力菌株FJAT91接种番茄植株12 h时诱导PR-1a表达量达到最高值,随后降低。Milling等[22]研究发现,番茄感病品种接种GMI1000和GMI1000 ΔepsB突变株后,GMI1000诱导番茄植株SA、JA和ET途径的防御基因的相对表达量均高于GMI1000 ΔepsB突变菌株。本研究同样发现,强致病力菌株FJAT91诱导SA途径的防御基因PR-1a表达量显著高于无致病力菌株FJAT1458。然而,Chen等[23]报道,青枯菌phcA基因突变的弱毒株诱导番茄gluA和PR-1a基因表达量显著高于野生型强致力菌株,究其原因可能与菌株来源及番茄品种有关,不同抗性的番茄品种对同一病原菌的诱导抗性存在差异[22]。此外,本研究发现,接种初期,强致病力菌株FJAT91诱导番茄gluA、loxA和PR-1b显著高于无致病力菌株FJAT1458,而接种后期则相反,如PR-1b基因在接种前12 h,其表达量在FJAT91处理组显著高于FJAT1458处理组,而接种36 h后,PR-1b基因在FJAT91处理组的表达量显著低于FJAT1458处理组,可能正是由于强致病力菌株接种后期番茄植株这些防御基因表达量降低,最终导致植株发病死亡。接种后期(36 h之后),无致病力菌株FJAT1458诱导番茄植株防御基因(PR-1a和Osm除外)表达量均显著大于强致病力菌株和对照处理,表明,接种无致病力菌株能够激发番茄植株防御基因表达,从而诱导植株免疫抗病反应。
Ciardi等[24]和Block等[11]报道无致病力野油菜黄单胞菌(Xanthomonas campestris pv vesicatoria)比致病的野油菜黄单胞菌对番茄系统抗性的诱导更快、更强。本研究结果与之相反,青枯菌强致病力菌株FJAT91诱导番茄抗性反应更为强烈,在不同的信号途径中,FJAT91菌株诱导番茄植株抗性基因的最大表达量均大于无致病力菌株FJAT1458,特别是ET途径中的PR-1b基因,感染初期(3-12 h)的表达量是FJAT1458处理组的30.53-165.35倍,说明番茄寄主抗性反应的强弱与病原菌致病力强弱呈正相关。本研究中GluA、PR-1a、pin2、loxA、PR-1b和Osm这些防御基因只是SA、JA和ET信号途径防御调节基因中的一部分,今后应在这3条信号途径中其他重要防御基因在时间和空间表达量变化开展进一步的研究。
综上,青枯菌的强、弱菌株均能诱导番茄植株中SA信号转导途径的gluA和PR-1a基因、JA信号转导途径的loxA和pin2基因及ET信号转导途径的Osm和PR-1a基因表达,从而激活番茄植株系统防御反应。总体来看,强致病力菌株诱导番茄防御基因表达量变化幅度大于无致病力菌株诱导的番茄植株防御基因表达量变化,但在侵染后期(36 h之后),多数基因在无致病力菌株中的诱导表达量比强致病力菌株高。

