原位甲酯法耦合GC-MS快速分析裂殖壶藻中EPA和DHA含量
唐传球 甘莉 刘心雨 刘煌 章平平






摘要 以裂殖壶藻为研究对象,选取料液比、硫酸浓度、浸提温度、抗氧化剂BHT用量4个单因素考察原位甲酯法对EPA和DHA提取率的影响,并与Bligh-Dyer甲酯法进行对比。正交优化试验表明,料液比1∶20(g∶mL)、硫酸浓度3.5%(V/V)、浸提温度80 ℃、BHT用量20 mg为原位甲酯法最佳工艺。通过GC-MS分析发现,2种方法在脂肪酸甲酯组成上没有明显差别,原位甲酯法中EPA和DHA产量分别占总脂肪酸的0.6%和32.4%,稍低于Bligh-Dyer甲酯法的1.4%和34.3%,但与文献测定结果相近,且制备步骤相对简单,所用化学试剂较少,更适合应用于快速筛选高产DHA微藻。
关键词 裂殖壶藻;EPA;DHA;原位甲酯法;GC-MS
中图分类号 O657.63 文献标识码 A 文章编号 0517-6611(2022)05-0166-04
doi:10.3969/j.issn.0517-6611.2022.05.042
开放科学(资源服务)标识码(OSID):
Rapid Analysis of EPA and DHA Contents in Schizochytrium sp. by In-situ Methylester Method Coupled with GC-MS
TANG Chuan-qiu, GAN Li, LIU Xin-yu et al
(School of Chemistry and Environmental Engineering, Hanjiang Normal University, Shiyan,Hubei 442000)
Abstract Taking Schizochytrium sp. as the research object, four single factors including solid-liquid ratio, sulfuric acid concentration, extraction temperature and antioxidant BHT dosage were selected to investigate the effect of in-situ methylester method on the extraction rate of fatty acids, compared with Bligh-Dyer methylester method. The results of orthogonal experiment showed that the optimum conditions of in-situ methyl ester method were as follows: the solid-liquid ratio was 1∶20(g∶mL), sulfuric acid concentration was 3.5%(V/V), the extraction temperature was 80 ℃, and the BHT dosage was 20 mg. GC-MS analysis showed that there was no significant difference in the composition of fatty acid methyl esters between the two methods. The production of EPA and DHA by in-situ methylester method accounted for 0.6% and 32.4% of the total fatty acids, respectively, which was slightly lower than that by Bligh-Dyer methylester method (1.4% and 34.3%). However, it was basically consistent with the results of literature. Moreover, the preparation steps were relatively simple and less chemical reagents were used, which was more suitable for the rapid analysis of fatty acids for screening high-yield DHA microalgae strains.
Key words Schizochytrium sp.;EPA;DHA;In-situ methylester method;GC-MS
基金項目 湖北省教育厅科学技术研究计划指导性项目(B2019189);湖北省教育厅科学技术研究计划中青年人才项目(Q20173102)。
作者简介 唐传球(1980—),男,安徽池州人,副教授,硕士,从事分离材料合成与应用研究。*通信作者,副教授,硕士,从事现代分离分析技术研究。
收稿日期 2021-06-17
ω-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)是指从脂肪酸碳链甲基端算起,第一个双键出现在第3位碳原子上的多不饱和脂肪酸,主要包括十八碳三烯酸(ALA,C18∶3)、二十碳五烯酸(EPA,C20∶5)和二十二碳六烯酸(DHA,C22∶6)。EPA 和DHA因具有降低心血管疾病、延缓脑衰老、抑制肿瘤生长和提高人体免疫机能等重要功能,备受人们关注[1-2]。长久以来,深海鱼类是人们获取EPA 和DHA 的传统原料。后期研究表明,海洋微藻才是 EPA 和DHA 等多不饱和脂肪酸的原始生产者,有些藻体内DHA或 EPA的相对含量高达5%~6%细胞干重。
目前被世界各国批准可用于商业化生产DHA的微藻主要有裂殖壶藻(Schizochytrium sp.)、寇氏隐甲藻(Crypthecodinium cohnii)、吾肯氏壶藻(Ulkenia amoeboida)3类。其中裂殖壶菌是一种单细胞球形异养海洋真菌,胞内油脂含量达70%以上,通过发酵条件的优化及改造菌株的方法,生物量达140~190 g/L,DHA含量可达40%[3]。目前国内在大规模培养微藻获取EPA和DHA的中试放大试验工作还处于起步阶段,大量工作仍集中在筛选高产EPA和DHA藻株领域。
裂殖壶藻中的总油脂由中性脂类和极性脂类组成,中性脂类有甘油三酯,极性脂类主要有游离脂肪酸、甘油二酯和单甘酯,其沸点较高不容易汽化。为了分离提纯其中的脂肪酸,必须通过酯交换反应生成沸点较低且比较稳定的脂肪酸甲酯[4-7]。传统微藻样品进行脂肪酸测定时,通常采用Bligh-Dyer法先抽提出藻油,再进行皂化处理成沸点低、极性小、易挥发的脂肪酸甲酯(简称Bligh-Dyer甲酯法),但该方法烦琐、消耗溶剂量大,不适宜快速分析脂肪酸组成[8-10]。
笔者以裂殖壶藻为原料,采用硫酸-甲醇原位甲酯法,集萃取与酯化为一体,耦合GC-MS,快速有效地揭示裂殖壶藻中EPA、DHA组成的特征与差异;分别选取料液比、硫酸浓度、浸提温度、抗氧化剂用量对方法工艺进行优化,以便于得到最佳的优化参数及较高的DHA提取率,旨在确立DHA微藻最佳不饱和脂肪酸分析方法。
1 材料与方法
1.1 材料与试剂
该研究中使用的裂殖壶藻粉末由中国科学院水生生物研究所藻类生物学研究中心提供。硫酸、硫酸钠、甲醇、三氟化硼均为分析纯,购于国药集团化学试剂有限公司;正己烷,色谱纯,购于Fisher Scientific公司;37种脂肪酸甲酯标准品(Supelco 37 Component FAME Mix)购于Merck 公司。
1.2 仪器与设备
Agilent 7890A-5975C气相色谱质谱联用仪(美国安捷伦科技有限公司);KQ-1000VDB超声波清洗仪(昆山市超聲仪器有限公司);Avanti JXN-26 低温高速离心机(美国贝克曼库尔特有限公司);WH-3漩涡混合器(常州市金坛晨阳电子仪器厂);ME204电子天平(瑞士梅特勒-托利多仪器有限公司);JXMINI-80迷你干式恒温器(上海净信实业发展有限公司)。
1.3 色谱条件
HP-88石英毛细管柱(30 m×0.25 mm,0.25 m),载气为高纯He(99.99%);进样口温度250 ℃;升温程序:175 ℃保持5 min,以3 ℃/min的速率升至220 ℃,停留5 min;进样量1 μL;进样方式20∶1分流进样;柱流量1.0 mL/min;GC-MS接口温度250 ℃。
1.4 质谱条件
EI源;离子源温度 230 ℃;传输线温度230 ℃;电离电压70 eV;质量扫描范围m/z 40~460。
1.5 原位甲酯法
取研磨过的微藻粉末100 mg于15 mL具塞试管中,加入2 mL 4%硫酸-甲醇溶液(V/V)和一定剂量的抗氧化剂,涡旋摇匀,80 ℃水浴加热1 h后,冷却,加入1 mL正己烷和内标液摇匀,再加入1 mL饱和氯化钠溶液摇匀,离心取上层溶液进行GC-MS分析。
由于DHA 和 EPA含有多个不饱和双键,所以它在光、氧、热、金属元素(Fe2+、Cu2+有催化作用)及自由基等因素的作用下,非常容易发生氧化、酸败、聚合和双键共轭化等化学反应,同时产生一些挥发和非挥发性物质,如醛、酮、醇、酸和羰基化合物。防止DHA微藻氧化的最有效方法是添加高效抗氧化剂[11]。该研究综合考虑抗氧化剂的安全性和成本,选定二丁基羟基甲苯(BHT)为抗氧化剂组分[12]。
1.6 Bligh-Dyer甲酯法
采用Bligh-Dyer法提取裂殖壶藻中的脂肪油,参照Araujo等[13]的方法将脂肪酸水解形成脂肪酸甲酯,获得待气质联用仪分析的样品;采用气相色谱质谱联用仪对脂肪酸甲酯进行分析。
2 结果与分析
2.1 Bligh-Dyer甲酯法和原位甲酯法流程对比
如图1所示,通过Bligh-Dyer甲酯法提取微藻脂肪酸的各个阶段与原位甲酯法相比,流程相当冗长。原位甲酯法集萃取与酯化为一体,既节省了劳力,又减少了大量萃取剂的消耗。
2.2 单因素试验
2.1.1 料液比对微藻DHA得率的影响。
在硫酸浓度3%(V/V)、浸提温度80 ℃、BHT用量20 mg条件下,研究料液比对微藻DHA得率的影响,结果见图2。从图2可以看出,随着料液比的降低,DHA得率总体呈上升趋势。但在实际生产过程中,料液比越大,大大增加了生产成本和环境成本,且溶剂蒸发问题不容忽视,因此,1∶20(g∶mL)为相对较合适的料液比用量。
2.1.2 硫酸浓度对微藻DHA得率的影响。
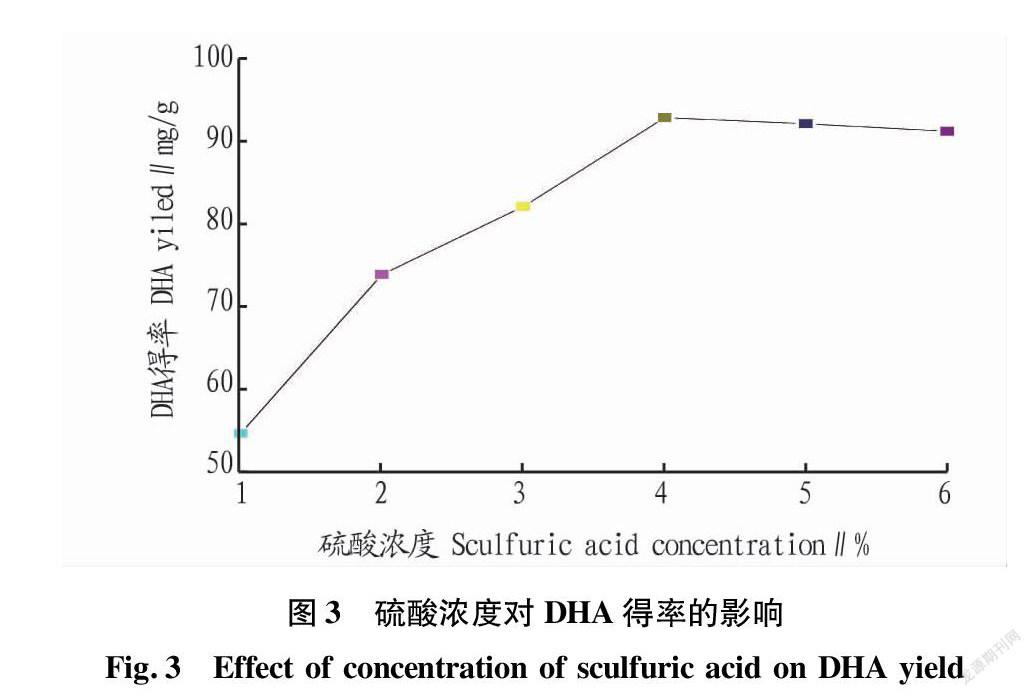
在料液比1∶20、浸提温度80 ℃、BHT用量20 mg条件下,研究不同硫酸浓度对微藻DHA得率的影响,结果见图3。由图3可知,硫酸浓度在1%~4%(V/V)时,得率呈上升趋势;之后随硫酸浓度的进一步提高,得率呈下降趋势,在4%时最佳。
2.1.3 浸提温度对微藻DHA得率的影响。
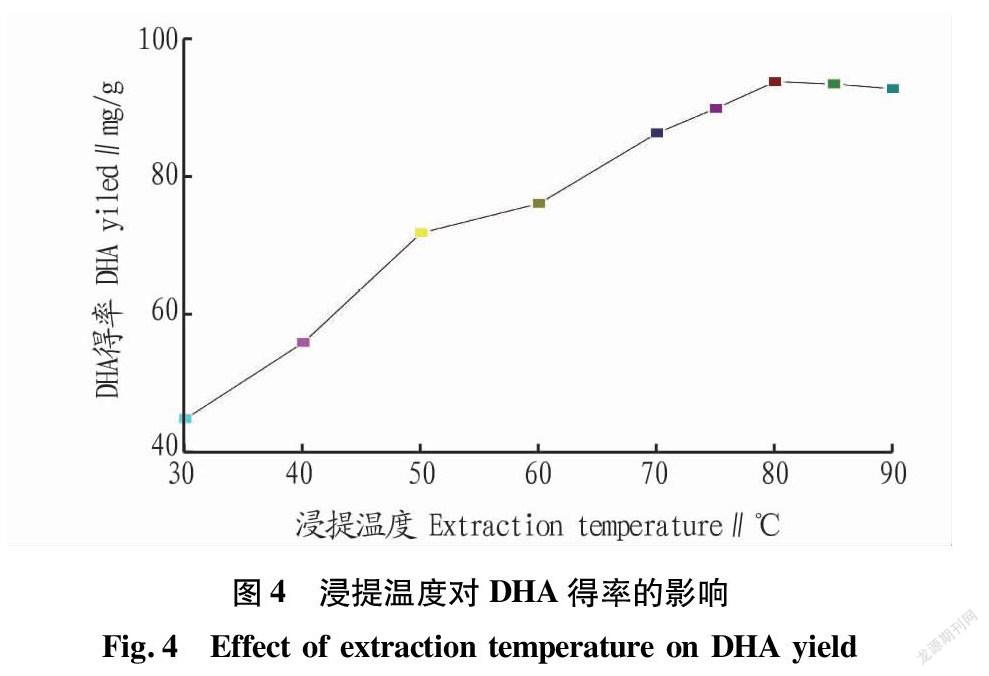
在料液比1∶20、硫酸浓度4%、BHT用量20 mg条件下,研究浸提温度对微藻DHA得率的影响,结果见图4。由图4可知,随着浸提温度的提高,微藻DHA得率呈上升趋势;当浸提温度为80 ℃时,微藻DHA得率达到最大;当浸提温度为45~80 ℃时,微藻DHA得率上升较快;当浸提温度为80 ℃以上时,微藻DHA得率增速呈下降趋势。因此,选择浸提温度为80 ℃。
2.1.4 BHT用量对DHA得率的影响。
在料液比1∶20、硫酸浓度4%、浸提温度80 ℃条件下,研究BHT用量对微藻DHA得率的影响,结果见图5。由图5可知,BHT用量对微藻DHA得率的影响总体上呈随用量增加而提高的趋势。在BHT用量10~30 mg时,上升趋势明显;30 mg之后趋于平缓,微藻DHA得率变化不大,BHT用量增加对微藻DHA得率的影响并不大。因此,30 mg为相对较合适的抗氧化剂用量。
2.2 正交优化试验
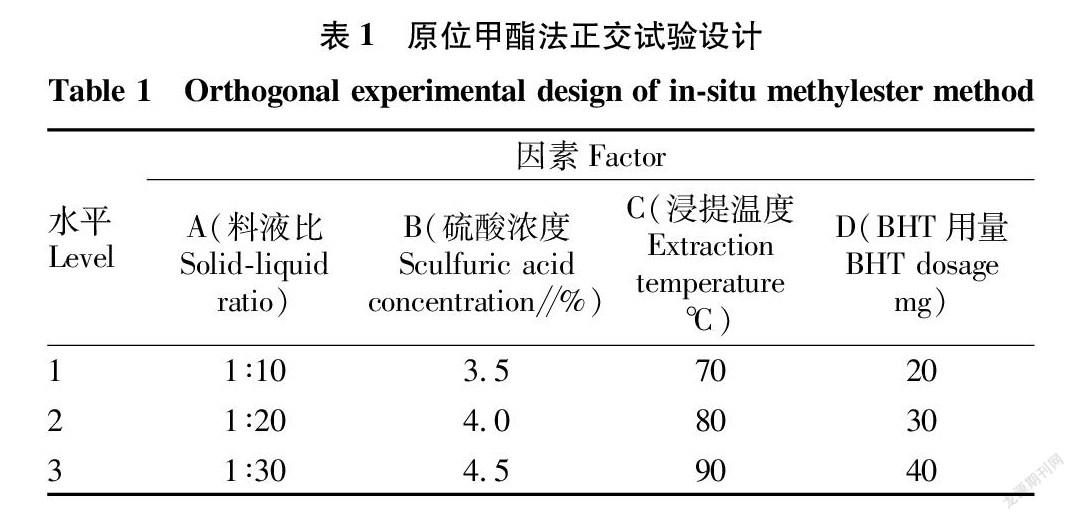
根据单因素预试验结果,在单因素试验的基础上,选取的工艺条件是料液比1∶10~1∶30、硫酸浓度3.5%~4.5%、浸提温度70~90 ℃、BHT 用量20~40 mg,选用L 9(34)正交表(表1)对试验影响因素进行优化。
从正交试验分析结果(表2)可知,原位甲酯法影响因素的主次顺序为C>A>B>D,即浸提温度>料液比>硫酸浓度>BHT用量。故确定最优工艺条件时,首先应满足浸提温度的要求。所以可以确定最优水平组合为A 2B 1C 2D 1,即料液比1∶20、硫酸浓度3.5%、浸提温度80 ℃、BHT用量20 mg。
2.3 验证试验
将优化好的
原位甲酯法和Bligh-Dyer甲酯法处理的DHA微藻经GC-MS检测,其总离子流图(TIC)如图6所示。从图6可以看出,原位甲酯法和Bligh-Dyer甲酯法在脂肪酸甲酯组成上差别较小。2 种方法提取的脂肪酸组分均为C13~ C22的饱和及不饱和脂肪酸组成。原位甲酯法以C15∶0、C16∶0、C22∶6为特征脂肪酸,其中EPA含量占总脂肪酸的0.6%,DHA 含量占总脂肪酸的32.4%,与康晶等[14]的研究结果基本相一致。Bligh-Dyer甲酯法则由以C14∶0、C15∶0、C16∶0、C22∶6为特征脂肪酸,其中EPA含量占总脂肪酸的1.4%,DHA 含量占总脂肪酸的34.3%。
从表3可以看出,原位甲酯法虽然EPA、DHA产量稍低于Bligh-Dyer甲酯法,但DHA含量与文献的研究结果接近[15-17],且分析步骤相对简单,所用化学试剂较少,也不失为一种筛选高产DHA海洋微藻的脂肪酸快速分析方法。
3 结论
通过单因素和正交试验考察原位甲酯法分析裂殖壶菌粉脂肪酸的影响因素,4个主要因素的主次顺序依次为浸提温度、料液比、硫酸浓度、BHT用量。试验较佳的分析条件为料液比1∶20、硫酸浓度3.5%、浸提温度80 ℃、BHT用量20 mg。通过与Bligh-Dyer甲酯法验证对比,在脂肪酸甲酯组成上2种方法没有明显差别。相对于Bligh-Dyer甲酯法,原位甲酯法因消耗溶剂少、操作简单,更适合应用于筛选高产EPA和DHA藻株的脂肪酸分析法。
參考文献
[1] 秦薇.二十二碳六烯酸对人胰腺癌细胞生长抑制的研究[D].苏州:苏州大学,2009.
[2] 肖玫,欧志强.深海鱼油中两种脂肪酸(EPA和DHA)的生理功效及机理的研究进展[J].食品科学,2005,26(8):522-526.
[3] NAUROTH J M,LIU Y C,VAN ELSWYK M,et al.Docosahexaenoic acid(DHA)and docosapentaenoic acid(DPAn-6)algal oils reduce inflammatory mediators in human peripheral mononuclear cells in vitro and paw edema in vivo[J].Lipids,2010,45(5):375-384.
[4] 章莹颖,邓春芳,崔岩,等.不同方法对微藻细胞破碎及油脂提取效果的影响[J].中国油脂,2016,41(3):61-65.
[5] BLIGH E G,DYER W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8):911-917.
[6] 张雨倩,张婧嫣,杨淑暖,等.海洋微藻藻油的提取工艺研究[J].食品工程,2016(1):56-58.
[7] 何文胜,王灿,杨诗颖.裂殖壶菌菌株FJU-512油脂提取的细胞破壁工艺[J].厦门大学学报(自然科学版),2016,55(4):606-610.
[8] 郑天翔,王丽娟,任晓霞,等.响应面优化提取小球藻油脂及其脂肪酸成分分析[J].中国粮油学报,2020,35(5):115-121,129.
[9] 刘艺琳,陈弘培,龚世禹,等.微藻油的提取与功能研究进展[J].食品工业科技,2019,40(5):333-337,342.
[10] 叶青,吴子健,侯惠静,等.两株小球藻培养基的优化及其产EPA性能的研究[J].食品研究与开发,2020,41(8):192-198.
[11] 李翔宇,田勇,陆姝欢,等.响应面试验优化藻类来源磷脂型DHA的提取工艺[J].中国油脂,2017,42(4):118-122.
[12] 李登红,粟晖,姚志湘,等.植物油中3种抗氧化剂的同时快速分析[J].分析试验室,2016,35(1):61-65.
[13] ARAUJO P,NGUYEN T T,FRYLAND L,et al.Evaluation of a rapid method for the quantitative analysis of fatty acids in various matrices[J].J Chromatogr A,2008,1212(1/2):106-113.
[14] 康晶,郑志永,詹晓北,等.氮源和溶氧限制对裂殖壶菌Schizochytrium limacinum SR21合成二十二碳六烯酸的影响[J].工业微生物,2013,43(2):58-63.
[15] B RCENAS-P REZ D,LUKE M,HROUZEK P,et al.A biorefinery approach to obtain docosahexaenoic acid and docosapentaenoic acid n-6 from Schizochytrium using high performance countercurrent chromatography[J/OL].Algal Res,2021,55[2021-01-17].https://doi.org/10.1016/j.algal.2021.102241.
[16] WANG H C,KLINTHONG W,YANG Y H,et al.Continuous extraction of lipids from Schizochytrium sp.by CO 2-expanded ethanol[J].Bioresour Technol,2015,189:162-168.
[17] ZINNAI A,SANMARTIN C,TAGLIERI I,et al.Supercritical fluid extraction from microalgae with high content of LC-PUFAs.A case of study:Sc-CO 2 oil extraction from Schizochytrium sp[J].J Supercrit Fluids,2016,116:126-131.

