PDCA在优化无针输液接头使用一次性消毒帽后消毒效果监测流程中的应用
容毓,林玉英,宋晔莹,卢剑辉,蔡霜,黄芊芊
(广州医科大学附属肿瘤医院 感染管理科,广东 广州 440106)
中心静脉导管作为给药途径,在肿瘤治疗中发挥着重要作用。无针输液接头作为中心静脉导管输液管路的起始部位,本身的设计并不能作为物理屏障,是微生物细菌污染或定植的重要部位[1],容易导致导管相关性血流感染。因此,除了定期对导管接口的维护,无针输液接头表面的消毒也应重视[2]。2016年美国静脉输液护士协会提出,使用一次性含消毒剂的被动式消毒帽(简称“消毒帽”)能够减少导管内腔的病原微生物污染,降低中心静脉相关血流感染[3],加上其节约消毒时间等优势,消毒帽近年来被广泛运用于临床。但消毒帽如何规范使用,使用后输液接头是否需要进行消毒,是临床困惑的一个问题。因此,医院将一次性输液接头消毒帽消毒效果列为目标监测项目,以观察输液接头的染菌情况,进一步开展消毒帽使用与导管相关血流感染的相关性研究。输液接头的采样并非医院常规采样监测项目,尚无统一的采样标准流程,其采样质量又将直接影响到监测效果的准确性。因此,本文通过回顾性收集分析佩戴有一次性消毒帽的无针输液接头的患者信息及消毒效果采样监测的资料,以 PDCA 循环管理模式对采样流程进行改良,从而优化一次性输液接头使用消毒帽后消毒效果监测流程。
1 对象与方法
1.1 研究对象
采用便利抽样的方法,选取2022年3-7月在广州市某三级甲等肿瘤医院住院,并使用中心静脉导管输液,无针输液接头佩戴消毒帽的患者为研究对象,比较PDCA改良前后的细菌采样阳性率。
纳入标准:①留置PICC、输液港等中心静脉管路,使用无针输液接头佩戴消毒帽,输液间隔12 h以上;②患者配合度高,可配合采样;
排除标准:①未使用无针输液接头并佩戴消毒帽的患者;②患有精神疾病;③体温异常;④不能配合采样过程者。
1.2 研究方法
1.2.1分组方法 对照组:2022年3-4月份,实施PDCA改良前,抽取符合标准的使用带一次性消毒帽的无针输液头患者,对其输液接头进行采样;试验组:针对对照组采样过程发现的问题,分析原因,通过头脑风暴、查阅文献等途径,提出改良思路及措施,并于5-7月,抽取符合标准的使用带一次性消毒帽的无针输液头患者,对其使用改良后的流程进行输液接头采样。
1.2.2试验材料与试验方法 对照组试验材料:免洗手消毒液、一次性输液接头消毒帽(含70%异丙醇);无针密闭输液接头;无菌棉签、生理盐水、无菌试管(一次性真空采血管)、酒精灯、血培养基、普通琼脂平板。
对照组采样方法:根据患者行动能力,行动方便的患者在治疗室完成采样,行动不便者在床旁进行采样。采样操作由2名固定院感专职员配合完成,采样前接受统一的采样培训。采样时间为上午9:00左右患者输液前。采样前,将采样用品合理放在治疗车上,点燃酒精灯,做好手卫生;采样时,打开输液接头消毒帽,用无菌棉签蘸取无菌生理盐水后,先在输液接头表面按顺时针方向旋转2 周进行平面擦拭,再在输液接头侧面的接触输液器的螺口顺时针旋转2 周;在酒精灯的火焰正上方打开真空采血管,小心放入无菌棉签并烧断手接触端后,消毒管口边缘并盖上盖子;采样后尽快送检,由检验科微生物室工作人员统一接种后放于37 ℃培养箱培养,48 h 后统计菌落数。
改良后采样方法:采样前,完成手卫生后,增加佩戴无菌手套;打开输液接头消毒帽采样前,增加用一次性乙醇棉片(由带有75% 医用乙醇溶液的无纺布组成)反复擦拭消毒输液接头及消毒帽连接处;采样时,使用无菌中和液代替生理盐水进行棉签湿润;采样后,取消烧断无菌棉签手接触端再送检验科接种环节,改为在酒精灯的火焰正上方,用上述棉签直接在血培养基上按“Z”字形划线接种,接种后尽快送37℃培养箱培养,48 h 后统计菌落数。
1.3 统计学方法
将收集到的改良前后的数据纳入SPSS22.0软件中进行数据分析,采用t检验及卡方检验对比改良前后差异性,P<0.05认为差异有统计学意义。
2 结 果
PDCA管理改良前后的患者共130例,其中改良前采样28例,改良后采样102例,两组在性别、年龄、输液间隔时间等方面的差异没有统计学意义(表1),具有可比性,但改良前采样的导管类型以输液港为主,改良后的采样PICC占比较前提高,两组在导管类型上差异有统计学意义。
改良前后的一次性输液消毒帽采样阳性率对比:实施PDCA改良后的一次性输液消毒帽采样阳性率要低于实施前,差异有统计学意义(χ2=14.72,P<0.001)。见表1。

表1 消毒帽消毒效果监测方法改良前后情况对比
改良前的对照组有13例患者是在床旁采样,阳性率61.5%,治疗室采样15例,阳性率46.7%,差异无统计学意义(P=0.43);改良后床旁采样的阳性率为0,治疗室采样的阳性率为20%,差异亦无统计学意义(P=0.13)。见表2。
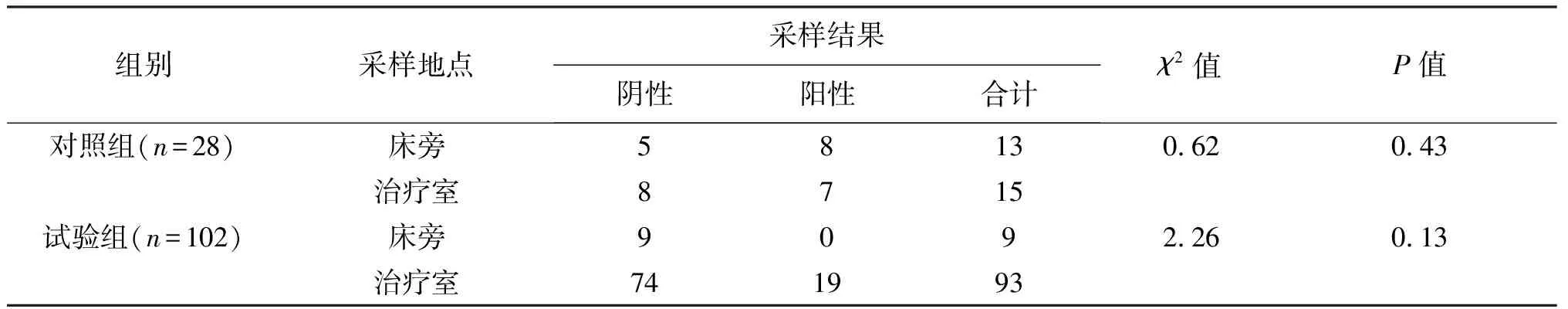
表2 不同采样地点与采样结果的关系
3 讨 论
输液接头表面的无菌状态是预防导管相关性血流感染发生的关键因素。研究证实,中心静脉导管输液接头表面的细菌培养阳性率与导管相关性血流感染密切相关[5],因此,减少输液接头表面污染,除严格规范中心静脉导管维护无菌操作步骤外,使用具有物理屏障功能的一次性消毒帽,能够降低或消除感染。山东某公司生产的一次性使用输液接头消毒帽的产品说明书中提出,消毒帽的有效消毒、抑菌时间长达96 h,但有研究结果表明[6],使用一次性输液接头消毒帽在8 h内可抑制中心静脉导管输液接头表面细菌定植;但输液间隔12 h后,其效果仍无法完全替代手动消毒。而在实际工作中,患者隔天静脉输液间隔时间一般大于12 h,输液接头被污染的风险较高。为了解实际工作中佩戴消毒帽的输液接头染菌的情况,本文起初抽取部分住院患者进行了细菌学采样,但因对采样流程认识不足,采样操作存在不够完善的地方,初始的采样结果发现细菌阳性率高达53.57%。
我们运用PDCA循环管理模式,通过计划、执行、检查、处理等四个部分的循环执行,对采样监测结果进行处理和分析,发现耗材、人员、采样流程等问题,制定解决和实施改进方案,持续的提高了采样流程的规范性。
武全莹等[6]认为,应在治疗室完成输液接头的采样,但我们的回顾性分析发现,在减少人员流动、避免操作扬尘、酒精灯旁操作等保证试验环境同质性的前提下,治疗室采样与床旁采样细菌阳性率无明显差别,提示行动不便的戴输液接头患者同样可以选择在床旁进行采样,以减少抽样时的选择偏倚。
综上所述,通过本轮PDCA循环,我们确定了下一步针对无针输液接头使用消毒帽后消毒效果的规范采样流程:
(1)准备用物:治疗车、无菌手套、免洗手消毒液、一次性乙醇棉片(由带有75% 医用乙醇溶液的无纺布组成);无菌棉签、无菌醇类中和液、酒精灯、血培养基。
(2)采样前准备:采样操作应由固定采样员完成,采样员在采样前应接受培训与考核,培训考核内容包括手卫生规范、消毒帽结构及消毒机理、无菌操作要点、划线接种方法等。
根据患者行动能力,行动方便的患者可集中在治疗室完成采样,行动不便者在床旁进行采样。将采样用品合理摆放在治疗车上,点燃酒精灯,做好手卫生,戴好无菌手套。
(3)采样方法:打开输液接头消毒帽采样前,用一次性乙醇棉片反复擦拭消毒输液接头及消毒帽连接处,再拧开消毒帽进行采样。
采样时,用无菌棉签蘸取无菌中和液后,先在输液接头表面按顺时针方向旋转2 周进行平面擦拭,之后在输液接头侧面的接触输液器的螺口侧面顺时针旋转2周。
(4)接种与送检:采过样的棉签直接在酒精灯的火焰正上方按“Z”字形在血培养基上划线接种,尽快送温箱37 ℃培养,48 h 后统计菌落数。
根据上述流程进行标准化采样后发现,带消毒帽的一次性无针输液头12 h细菌阳性率为17.65%,相比PDCA管理循环实施以前,带消毒帽的一次性无针输液头的采样阳性率明显下降,说明实施PDCA循环后,采样流程规范化、同质化,减少了人为失误导致的送检标本阳性率过高的风险。
尽管改良后的采样阳性率有所下降,但使用消毒帽后的输液接头仍然有细菌定植或污染的机会,我们建议,佩戴消毒帽约15 h后的病人,下次输液前,应使用一次性酒精棉片对输液接头进行再次消毒后,才可进行输液。
本文研究方法具有一定局限性,包括改良前样本量偏少,抽样方法未做到完全随机,未细化研究影响采样阳性率的具体因素等等。而改良后的阳性率是否反映真实的染菌情况,输液头染菌的危险因素有哪些,消毒帽使用与导管相关血流感染之间的关系,这些问题仍有待进一步探讨。

