Child-Pugh、ALBI及aMAP分级在TACE联合仑伐替尼治疗中晚期肝细胞癌患者生存预后中的相关性分析
陈晓薇,韦金玲,杨丽,臧梦雅,袁国盛
(南方医科大学南方医院感染内科肝脏肿瘤中心,广东 广州510515)
肝细胞癌(hepatocellular carcinoma,HCC)是全球常见的恶性肿瘤之一,其发病率及死亡率分别居肿瘤性疾病的第六位和第三位[1,2],全球55%HCC患者来自中国,由此可见HCC给我国人民健康带来了极大的威胁和挑战。由于HCC起病隐匿,导致80%左右患者在确诊时已处中晚期,根治性手术率低,预后较差。而HCC患者的预后与肝脏的储备能力密切相关,大量的研究结果显示不管是手术治疗还是非手术治疗,Child-pugh评分、ALBI以及aMAP分级均有助于评估HCC患者的预后。对于丧失根治手术机会的患者,经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合靶向药物已成为目前重要治疗手段之一[3]。仑伐替尼(lenvatinib)是一种口服多受体酪氨酸激酶抑制剂,REFLECT研究[4]结果表明仑伐替尼的有效性不劣于索拉非尼,且两者安全性类似,成为继索拉非尼后第二个晚期HCC一线靶向药物。但目前尚缺乏TACE联合仑伐替尼用于治疗中国人群中晚期HCC患者的研究报道,也没有研究探索Child-Pugh、ALBI及aMAP分级在预测上述治疗人群总生存时间(overall survival,OS)中的价值。因此,本研究采用单中心、回顾性队列研究设计,比较Child-Pugh、ALBI及aMAP分级在TACE联合仑伐替尼治疗中晚期肝细胞肝癌患者中预测OS的价值。
1 资料和方法
1.1 一般资料
回顾性收集2019年1月1日至2021年3月1日期间就诊于南方医科大学南方医院的中晚期HCC患者的临床资料。纳入标准:(1)按照《原发性肝癌诊治规范(2022年版)》[5]确诊为肝细胞癌;(2)巴塞罗那分期(简称BCLC分期)为B期或C期;(3)既往未接受过任何针对HCC 的系统治疗(主要包括系统化疗、分子靶向治疗、含CTLA-4、PD-1/PD-L1单抗的免疫治疗);(4)TACE 治疗在首次仑伐替尼治疗之后3个月内或者在首次仑伐替尼治疗前1个月内完成;(5)体力状况评分(简称PS评分)≤2分;(6)至少有一个可评估病灶。排除标准:(1)合并心脑肾肺等重要器官功能障碍;(2)认知异常;(3)任何原因停用仑伐替尼超过1个月;(4)治疗过程中同时接受了含CTLA-4、PD-1/PD-L1单抗的免疫治疗;(5)临床资料不完整。
1.2 方 法
1.2.1TACE手术方法 经股动脉穿刺插管成功后,注入碘海醇造影,明确肿瘤血供、性质、数目、大小等;经导管依次洛铂(海南长安国际制药有限公司)50 mg、盐酸表柔比星(辉瑞制药(无锡)有限公司)30 mg及碘化油(laboratorie guerbet)三种药物的混合剂通过导管注入到供养动脉内,同时采用Embosphere微粒球对给予病灶肿瘤供养的动脉血管进行栓塞。术后常规给予止吐、抑酸、护肝等对症治疗。
1.2.2仑伐替尼 TACE后一周内开始服用仑伐替尼,患者体重≤60 kg,起始剂量为8 mg,体重>60 kg,起始剂量为12 mg,口服,1次/日。
1.2.3疗效评估 根据改良实体瘤疗效评估标准(mRECIST)评价短期(术后3、12个月)抗肿瘤疗效,包括:①完全缓解(CR):CT 或 MRI 显示所有目标病灶动脉期强化消失;②部分缓解(PR):目标病灶(动脉期)的直径总和减少≥30%;③稳定(SD):目标病灶(动脉期)的直径总和减少未达到 PR 或增加未达到进展(PD);④PD:直径 总和增加≥20%,或出现新病灶。基于上述肿瘤评估结果,分别计算客观缓解率(ORR)=(CR+PR)/总病例数*100%,疾病控制率(DCR)=(CR+PR+SD)/总病例数*100%。
1.2.4无疾病进展期(PFS)、总生存期(OS)定义 PFS是指从接受治疗开始至患者疾病进展或死亡;OS是指从接受治疗开始至因任何原因引起死亡的时间,该指标为评估肿瘤临床试验最佳的疗效终点。
1.2.5肝功能Child-Pugh 根据患者有无腹水、肝性脑病以及ALB、PT、TB计算,每项1-3分。分级标准:A级5-6分,B级7-9分,C级10-15分。
1.2.6白蛋白-胆红素(ALBI)评分[6]用于评估肝癌患者的肝功能情况,根据ALB和TB水平进行计算:ALBI=0.66×log10[TB(μmol/L)]-0.085×[ALB(g/L)]。1级ALBI评分≤-2.6,2级-2.6﹤ALBI评分≤-1.39,3级﹥-1.39;
1.2.7aMAP评分[7]为首个跨病因跨种族的慢性肝病患者肝癌风险预测模型,根据患者的年龄、性别、白蛋白、血小板、总胆红素5个指标进行计算,评分范围标准化为1-100,aMAP评分的计算规则为:((0.06×年龄+0.89×性别(男性:1,女性:0)+0.48×((log10总胆红素×0.66)+(白蛋白×-0.085))-0.01×血小板)+7.4)/14.77×100,分级标准为:得分0-50为低风险、50-60为中风险、60-100为高风险。
1.3 统计学方法
应用SPSS 22.0统计软件对数据进行处理,正态分布计量资料用平均值±标准差表示,非正态分布计量资料用中位数(极小值,极大值)表达,计数资料用例数(%)表示。采用Kaplan-Meier法计算生存时间并绘制生存曲线,采用Log-rank检验进行不同组别间的比较。采用cox比例风险回归模型以及95% CI的风险比(hazard ratio,HR)进行估计分析影响HCC患者OS 的可能预后因素。单因素分析中P<0.1的变量进入到多因素cox回归分析中。应用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(AUC)评估不同参数预测TACE联合仑伐替尼治疗后生存时间的价值。最终P<0.05为差异具统计学意义。
2 结 果
2.1 患者基线特征分
最终纳入资料完整的94例患者,其中男性84例(89.4%),女性10例(10.6%),平均年龄(53.3±11)岁;有HBV感染史83例(88.3%);BCLC分期B期41例(43.6%),C期53例(56.4%);Child-Pugh分级A级69例(76.4%),B级17例(18.1%),C级8例(8.5%);ALBI分级1级26例(27.7%),2级29(30.9%),3级39例(41.5%);94例患者接受TACE平均治疗次数为2.2(95 CI: 1.7-2.7)次。所有患者的基线特征见表1。

表1 所有纳入TACE联合仑伐替尼治疗HCC患者的基线特征
2.2 抗肿瘤疗效评估
术后3个月,TACE联合仑伐替尼治疗HCC患者的ORR、DCR分别为60.6%(57/94)和87.2%(82/94)。术后12个月,ORR、DCR分别为60.6%(57/94)和87.2%(82/94),见表2。
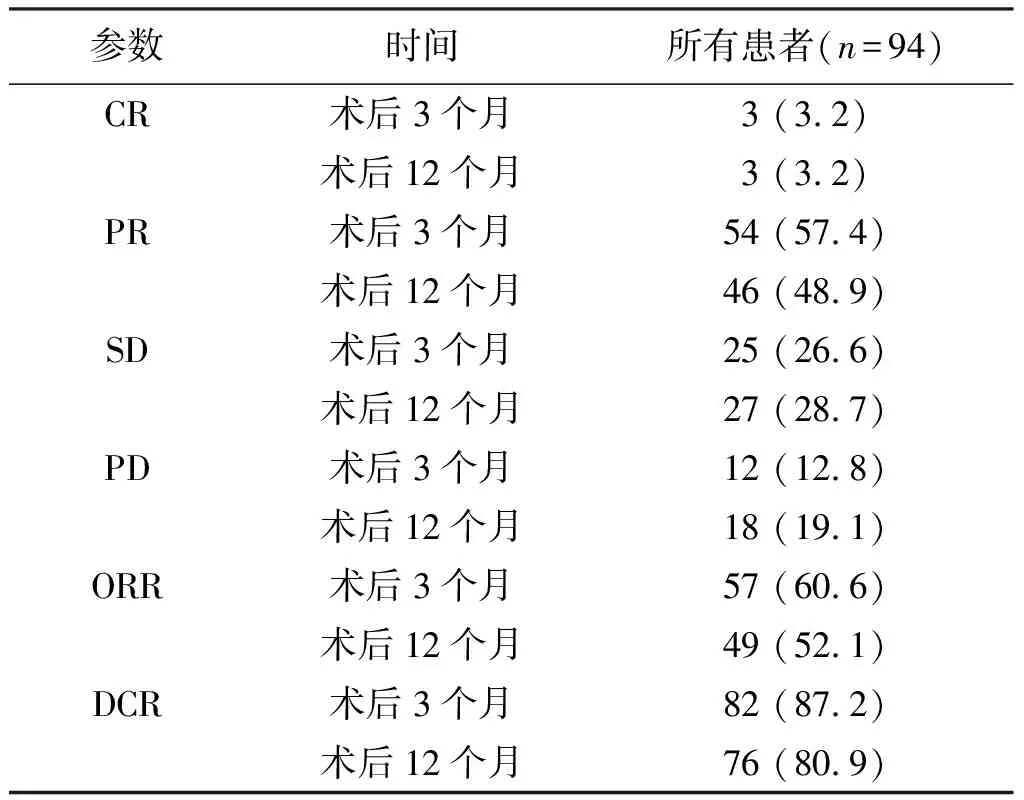
表2 术后3、12个月TACE联合仑伐替尼治疗HCC患者的抗肿瘤疗效
2.3 生存曲线分析
生存分析显示TACE联合仑伐替尼治疗中晚期HCC患者的mPFS为7.0个月,见图1。另,截止2022年2月1日,共有45例(47.9%)患者死亡,49例(52.1%)存活,中位OS为18.6个月(95%CI: 14.4-22.8),见图2。
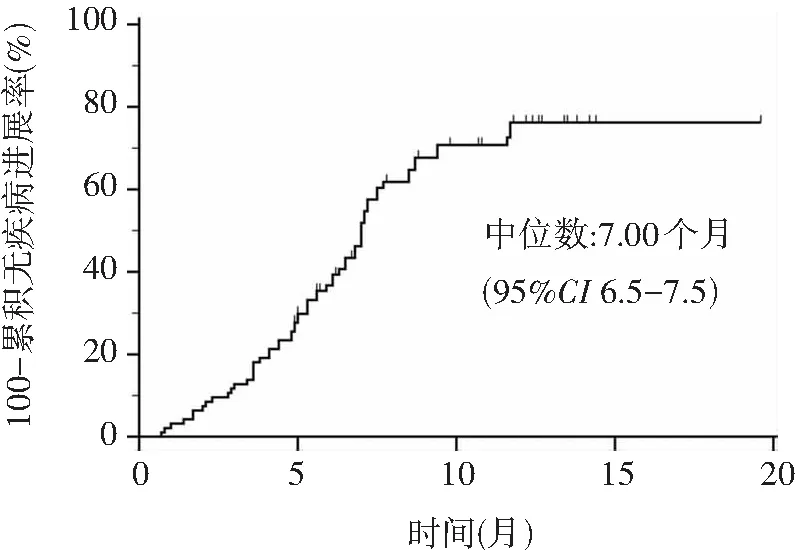
图1 94例TACE联合仑伐替尼患者的PFS分析
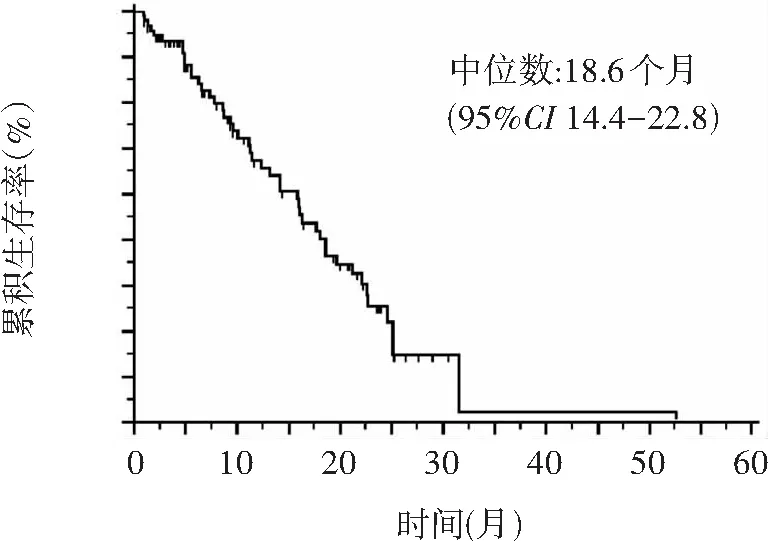
图2 94例TACE联合仑伐替尼患者的生存曲线分析
2.4 影响患者OS的单因素和多因素分析
单因素COX回归分析结果显示,肿瘤最大直径≥7 cm、BCLC分期、AFP≥400 ng/mL、ALBI分级均与生存相关(均P<0.1);将上述指标纳入多因素COX回归分析显示:肿瘤最大直径≥7 cm,BCLC C期及ALBI分级(2/3级)均为患者OS的独立危险因素,见表3。
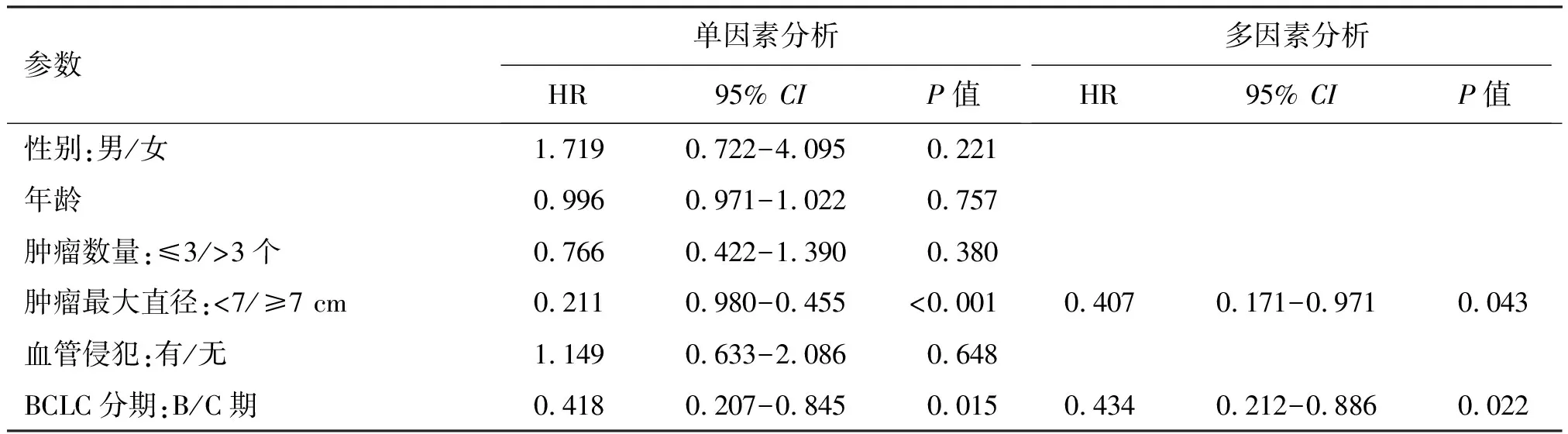
表3 单因素及多因素COX回归分析基线指标对所有患者OS的影响
2.5 按ALBI分级分层后,比较各组患者的OS
如图3所示,按ALBI分级进行分层后,ALBI 1级患者的中位生存时间显著长于2级、3级患者,差异有统计学意义(卡方=28.366,P<0.001)。

图3 94例TACE联合仑伐替尼患者按ALBI分级进行分层后的生存曲线分析
2.6 AU-ROC曲线下面积分析ALBI分级、BCLC分期及最大肿瘤直径对患者OS的预测价值
经ROC曲线分析,结果显示ALBI分级、BCLC分期和肿瘤最大直径≥7 cm对TACE联合仑伐替尼治疗后OS均有一定的预测价值,其AUC分别为0.910、0.705和0.809,见图4。
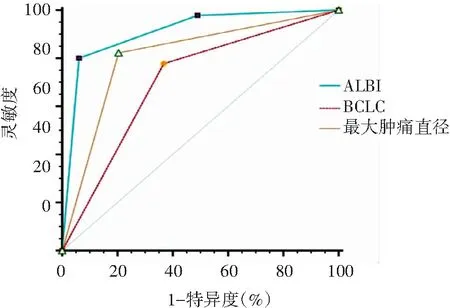
图4 94例TACE联合仑伐替尼患者按ALBI分级、BCLC分期及肿瘤最大直径分层后的受试者工作曲线
3 讨 论
在我国,HCC以中晚期为主[8],TACE是中晚期不可切除HCC主要的姑息性局部治疗方法,也是BCLC B期HCC的标准治疗手段,但其在控制肿瘤新生血管方面作用欠佳,单纯的TACE 治疗远期疗效不佳。有研究[9]结果显示TACE可显著延长晚期HCC患者OS,但术后复发率高,6个月内的复发率可高达29%,因此越来越多的临床医生开始探索更有效的联合治疗手段。本研究结果显示,TACE联合仑伐替尼治疗中晚期HCC患者的中位OS为18.3个月,较既往单纯TACE治疗报道[10-12]的中位OS(7.0-14.0个月)延长,提示TACE与仑伐替尼靶向治疗可以起到协同作用。其可能机制是:TACE术后可诱发肝脏占位内部缺血及缺氧环境,进而促使血管表皮生长因子VEGF表达上调,与术后新生血管生成关系密切,在肝癌转移、复发过程中发挥了重要作用。而仑伐替尼则通过抑制血管表皮生长因子受体(VEGFR)和血小板衍生因子受体(PDGFR)下游信号通路,发挥抗血管生成作用[13-15]。另外本研究结果显示TACE联合仑伐替尼治疗中晚期HCC患者的中位OS优于既往TACE联合索拉非尼方案的研究报道[16-18],其可能原因是仑伐替尼相比较索拉非尼,对VEGFR-2的亲和力更强,对患者可能具有更好的疗效。以上结果提示TACE联合仑伐替尼有效,值得临床应用和推广,但本研究作为回顾性临床随访研究存有一定的局限性,需要开展大样本、前瞻性研究加之证实。
本研究还发现,在Child-Pugh、ALBI分级以及aMAP评分中,相较Child-Pugh及aMAP分级,ALBI分级可较好预测TACE联合仑伐替尼治疗中晚期HCC患者OS。Child-Pugh和ALBI分级是临床上最常用的两种无创肝储备功能评估工具,既往报道[19]两者均能够系统评估肝硬化患者的肝功能储备情况,有效预测患者病情的严重程度和预后,且两者均为HCC患者生存预后的独立影响因素,但因Child-Pugh评分对腹水、肝性脑病的评估具有较高的主观性,且白蛋白与腹水作为变量又相互影响,存在局限性。aMAP是全球首个跨病因、跨种族的针对慢性肝病患者的肝癌风险预测评分模型[7],目前主要在乙肝、丙肝、非病毒性肝病等各类人群中进行广泛的应用,可优化资源配置,实现患者个体化的肝癌风险监测,从而提高肝癌的早诊早治,降低死亡率。相较上述两种模型,ALBI评分相对客观且更为准确,有助于中晚期HCC患者制定最优的系统治疗方案。据报道[20],ALBI评分同样可作为免疫联合靶向治疗后肿瘤应答的独立预测因子,提示ALBI评分在中晚期HCC患者系统治疗中具有较好的相关性。
综上所述,相较Child-Pugh及aMAP评分,ALBI对于TACE联合仑伐替尼治疗中晚期HCC患者OS具有较好的相关性,结合其客观性及简便性,ALBI可能成为HCC患者接受TACE联合仑伐替尼治疗后的基线筛选标志之一。由于我们的研究是回顾性、单中心设计,上述结果尚需进一步的前瞻性、多中心研究来进行验证和后续探索。

