敲低miR-21-3p抑制非小细胞肺癌细胞增殖、迁移及侵袭
陈彬彬,陈 丹
[湖南省人民医院(湖南师范大学附属第一医院)呼吸三科,湖南 长沙 410016]
微小核糖核酸(miRNA)是近年来发现的一类长度为20~23个核苷酸的内源性单链非编码小分子RNA,通过和靶基因mRNA碱基配对,引导沉默复合体降解mRNA或阻碍其翻译,与多种肿瘤的发生均密切相关[1]。miR-21-3p生物学功能多样,包括调节肿瘤细胞增殖、迁移、凋亡及分化等过程。随着研究的深入,miR-21-3p可能成为新的肿瘤标志物,并为肿瘤的基因治疗提供新靶点[2]。然而,miR-21-3p调控非小细胞肺癌(non-small-cell carcinoma,NSCLC)的详细机制仍有待进一步研究。CTD小磷酸酶样蛋白(CTDSPL)是一种抑癌基因,其在各种原发性肿瘤和继发性肿瘤中常被发现失活[3]。本研究旨在探讨miR-21-3p对NSCLC细胞增殖、迁移及侵袭的影响,以及其与CTDSPL的初步关系,现将研究报道如下。
1 材料与方法
1.1 材料
1.1.1 临床样本收集2018年5月至2019年12月湖南省人民医院(湖南师范大学附属第一医院)收治的未进行过放化疗并接受肿瘤切除术的16例T2期NSCLC患者的肿瘤组织和癌旁组织。本研究经院内医学伦理委员会批准,且所有患者对本研究知情并签署知情同意书。
1.1.2 细胞正常人肺上皮细胞(BEAS-2B)和NSCLC细胞株A549和H1975均来自中科院上海细胞库。
1.1.3 主要试剂胎牛血清和洛斯维公园纪念研究所 -1640(RPMI-1640)培养基(美国Gibco公司);miR-21-3p模拟物(mimic) / 抑制剂(inhibitor)和阴性对照(miR-NC)(上海吉玛制药技术有限公司);Lipofectamine 2 000试剂和Trizol试剂(美国Invitrogen公司);靶向抑制CTDSPL表达的shRNA(sh-CTDSPL)和阴性对照载体(sh-Con)(上海生工生物工程股份有限公司);PrimeScript RT试剂盒(北京天根生化科技有限公司);端粒酶活性荧光实时定量PCR法检测试剂盒(江苏凯基生物技术股份有限公司);噻唑蓝(MTT)试剂(美国Thermo Fisher Scientific公司);5- 乙炔基 -2’- 脱氧尿苷(EDU)细胞增殖分析试剂盒、4',6- 二脒基 -2- 苯基吲哚(DAPI)试剂(广州锐博生物科技有限公司);CTDSPL抗体(英国Abcam公司);HRP- 缀合的兔 / 小鼠抗 -IgG(美国Proteintech公司);p-MIR-reporter质粒(美国Ambion公司);荧光素酶测定试剂盒(美国Promega Corporation公司)。
1.1.4 主要仪器蛋白质Western blot印迹系统(上海天能科技有限公司,型号:Tanon V8);化学发光成像系统(上海易孛特光电技术有限公司,型号:eBlot Touch Imager);多功能酶标仪(美国Molecular Devices公司,型号:SpectraMax iD3);实时荧光定量PCR系统(美国Applied Biosystems公司,型号:ABI 7500);荧光分析仪(美国Thermo Scientific公司,型号:Fluoroskan Ascent FL)。
1.2 研究方法
1.2.1 细胞培养、转染与分组将BEAS-2B、A549和H1975细胞培养于含10%胎牛血清的RPMI-1 640培养基中,并置于37 °C、5% CO2的细胞培养箱中常规培养。取对数期A549细胞,接种于96孔板,次日细胞达到80%融合时,改用无血清培养基培养6 h,然后按照说明书步骤进行转染,将20 nmol/L的miR-21-3p inhibitor和miR-NC转入A549细胞,常规培养48 h后收集细胞,命名为miR-21-3p inhibitor组和miR-NC组。取已转染miR-NC或miR-21-3p inhibitor的A549细胞,按照上述方法,用lipofectamine 2 000试剂将10 nmol/L的sh-Con或sh-CTDSPL分别转入细胞,分别命名为miR-NC+sh-Con组、miR-21-3p inhibitor+sh-Con组及miR-21-3p inhibitor+sh-CTDSPL组。
1.2.2 检测方法
1.2.2.1 实时荧光定量聚合酶链式反应(RT-qPCR)检测肺癌组织和肺癌细胞株中miR-21-3p的相对表达量使用Trizol试剂从临床肺癌肿瘤组织、癌旁组织及细胞系(BEAS-2B、A549和H1975细胞)中提取RNA,并通过PrimeScript RT试剂盒合成cDNA。按照端粒酶活性荧光实时定量PCR法检测试剂盒说明书步骤,分别取目的基因正向和反向引物(各0.3 μM)、2×Maxima SYBR Green qPCR Master Mix(12.5 μL)、TERT 正向和反向引物(各1.0 μM)、cDNA(200 ng)和无核酸水混匀(总体积25 μL),然后在实时PCR系统上进行PCR反应。反应程序设定为95 ℃总变性10 min,然后进行40个循环(95 ℃变性15 s,60 ℃复性30 s和72 ℃延伸 30 s)。miR-21-3p 上游引物:5′-ACACTCCAGC TGGGCAACACCAGTCGATGGGC-3′,miR-21-3p 下游引物:5′-CTCAACTGGTGTCGTGGA-3′;U6 上游引物:5′-CTCGCTTCGGCAGCACA-3′,U6 下游引物:5′-AACGCTTCACGAATTTGCGT-3′。用 U6 作为 miR-21-3p的内部参照,用2-ΔΔCt法计算miR-21-3p的相对表达量。取三份样品做3次独立实验,取平均值作为实验结果。
1.2.2.2 MTT法检测细胞活力将各组细胞接种到96孔板中(5×103细胞/孔),培养24 h后,弃旧的培养基,每孔加入浓度为5 mg/L的MTT试剂(20 μL),并继续孵育4 h,然后每孔加入150 μL二甲基亚砜在室温下溶解15 min。使用酶标仪记录每孔在波长570 nm处的吸光度值。细胞活性(%) = (观察组吸光度值/阴性对照组吸光度值)×100%。每组细胞均设4个复孔,取均值作为一次独立实验的结果。均进行3次独立实验。
1.2.2.3 EDU掺入法测定细胞增殖将各组细胞接种到96孔板中(1×103细胞/孔),加入50 μmol/L EDU孵育4 h,用PBS洗去未渗入的EDU,将细胞用固定液固定15 min后,用0.5% TritonX-100透过细胞5 min,加入100 μL Apollo染色液避光染色30 min,用PBS洗涤细胞2次,然后用DAPI染核5 min,荧光显微镜观察并计数EDU阳性细胞和总细胞数。EDU阳性细胞率以每个视野下EDU阳性细胞占总细胞的百分率表示。每组细胞均设3个复孔,每孔随机选3个视野,取均值作为一次独立实验的结果。均进行3次独立实验。
1.2.2.4 Transwell测定细胞的迁移与侵袭细胞以1×105/mL重悬于无血清的培养基中。迁移的测定:取200 μL细胞悬液添加到含8 μm孔径的聚碳酸酯膜的Transwell小室中,并将500 μL含10%胎牛血清的培养基添加到Transwell板孔中,培养24 h后,擦除小室膜上层面的细胞,然后用0.1%结晶紫染色20 min,显微镜下拍照并计数。对于侵袭测定,采用基质胶包被的聚碳酸酯膜,其余步骤同细胞迁移的实验方法。均进行3次独立实验。
1.2.2.5 荧光素酶报告基因检测miR-21-3p与CTDSPL的靶向关系分别将人CTDSPL的整个3'-UTR(WT)和CTDSPL 3'-UTR突变片段(Mut)克隆到p-MIR-reporter质粒中。按照转染试剂说明书步骤,分别用Lipofectamine 2 000转染WT或Mut萤火虫荧光素酶报道质粒(0.3 μg),并转染20 nmol miR-21-3p mimic和miR-NC或者miR-21-3p inhibitor和miR-NC。转染48 h后,通过荧光素酶测定试剂盒对荧光素酶含量进行测定。均进行3次独立实验。
1.2.2.6 Western blot检测CTDSPL的蛋白表达将细胞采用含有1%蛋白酶抑制剂混合物的RIPA裂解缓冲液裂解并提取蛋白,用BCA试剂盒对蛋白定量后,进行蛋白电泳,并将蛋白转移到硝酸纤维素膜上,用5%脱脂乳封闭45 min,并在4 ℃下孵育一抗CTDSPL(1∶1 000)和GAPDH(1∶10 000)过夜,随后用PBST洗膜5次,并与HRP- 缀合的兔/小鼠抗 -IgG(1∶10 000)在室温下孵育2 h。用PBST洗膜5次后,用化学发光成像检测系统显像,拍照蛋白条带,用Image J软件检测条带吸光度值,蛋白相对表达量=(目标蛋白吸光度值/内参GAPDH蛋白吸光度值)×100%。均进行3次独立实验。
1.3 观察指标①miR-21-3p相对表达量。对比肺癌组织、癌旁组织及BEAS-2B和NSCLC细胞(A549、H1975)中miR-21-3p相对表达量。②敲低miR-21-3p表达对肺癌A549细胞细胞增殖、迁移及侵袭的影响。以肺癌A549细胞为研究细胞株,对比miR-21-3p inhibitor组和miR-NC组A549细胞中miR-21-3p的相对表达量、细胞活性、EDU阳性细胞、迁移和侵袭细胞数。③荧光素酶报告基因检测miR-21-3p与CTDSPL的靶向关系。④CTDSPL蛋白表达情况。对比BEAS-2B、A549细胞及miR-21-3p inhibitor组和miR-NC组A549细胞中CTDSPL蛋白相对表达水平。⑤敲低miR-21-3p表达通过CTDSPL降低A549细胞的增殖、迁移及侵袭。对比miR-NC+sh-Con组、miR-21-3p inhibitor+sh-Con组及miR-21-3p inhibitor+sh-CTDSPL组A549细胞的细胞活性、迁移及侵袭。
1.4 统计学方法使用GraphPad Prism 6.0统计软件对数据进行统计分析,计量资料以(±s )表示,两组间比较用t检验,多组间比较用单因素方差分析,均数的两两比较采用事后Bonferroni校正。以P<0.05表示差异有统计学意义。
2 结果
2.1 NSCLC肺癌组织和癌旁组织中miR-21-3p相对表达量与癌旁组织[(100.45±8.89)%]相比,在NSCLC肺癌组织中miR-21-3p相对表达量[(234.78±18.76)%]显著升高,差异有统计学意义(P<0.05)。
2.2 BEAS-2B和NSCLC细胞(A549和H1975)中miR-21-3p相对表达量与BEAS-2B细胞[(98.67±28.34)%]相比,A549[(536.43±21.49)%]和 H1975 细胞[(379.21±41.54)%]中 miR-21-3p相对表达量均显著升高,差异均有统计学意义(均P<0.05)。
2.3 敲低miR-21-3p表达对肺癌A549细胞细胞增殖、迁移及侵袭的影响经比较BEAS-2B和NSCLC细胞株A549和H1975中miR-21-3p表达后,选择表达差异更为明显的A549进行后续实验。结果显示,与miR-NC组比较,miR-21-3p inhibitor组细胞中miR-21-3p相对表达量显著降低,细胞活性和EDU阳性细胞率均显著降低,迁移细胞数和侵袭细胞数均显著降低,差异均有统计学意义(均P<0.05),见表1、图1和图2。
表1 敲低miR-21-3p表达降低A549细胞的增殖、迁移及侵袭( ±s )
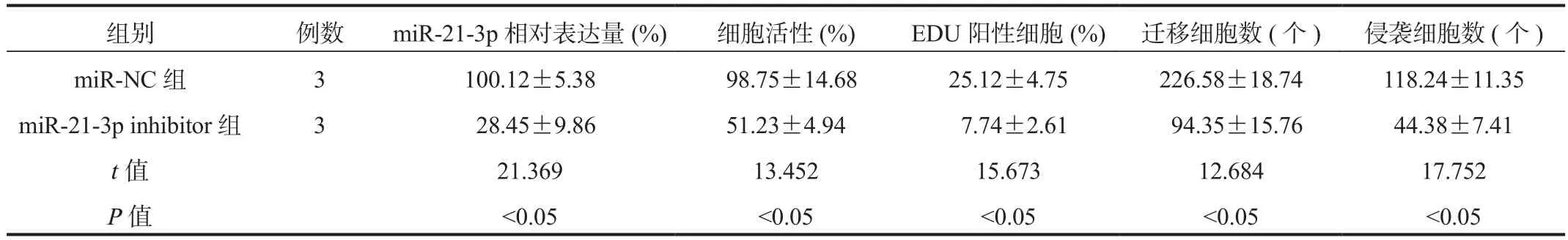
表1 敲低miR-21-3p表达降低A549细胞的增殖、迁移及侵袭( ±s )
注:EDU:5- 乙炔基 -2’- 脱氧尿苷。
组别 例数 miR-21-3p相对表达量(%) 细胞活性(%) EDU阳性细胞(%) 迁移细胞数(个) 侵袭细胞数(个)miR-NC 组 3 100.12±5.38 98.75±14.68 25.12±4.75 226.58±18.74 118.24±11.35 miR-21-3p inhibitor组 3 28.45±9.86 51.23±4.94 7.74±2.61 94.35±15.76 44.38±7.41 t值 21.369 13.452 15.673 12.684 17.752 P值 <0.05 <0.05 <0.05 <0.05 <0.05
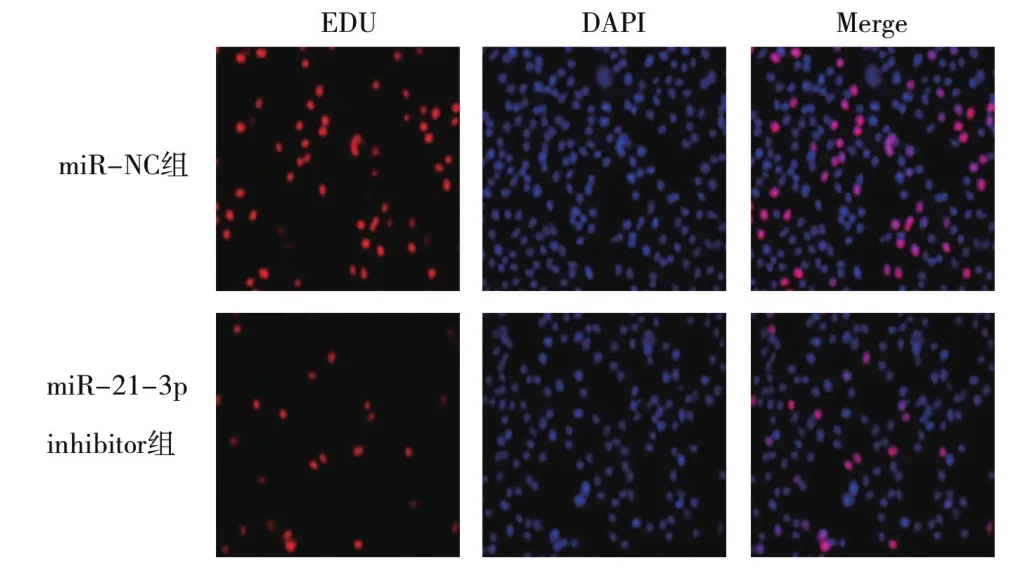
图1 各组A549细胞EDU荧光染色图(×200)
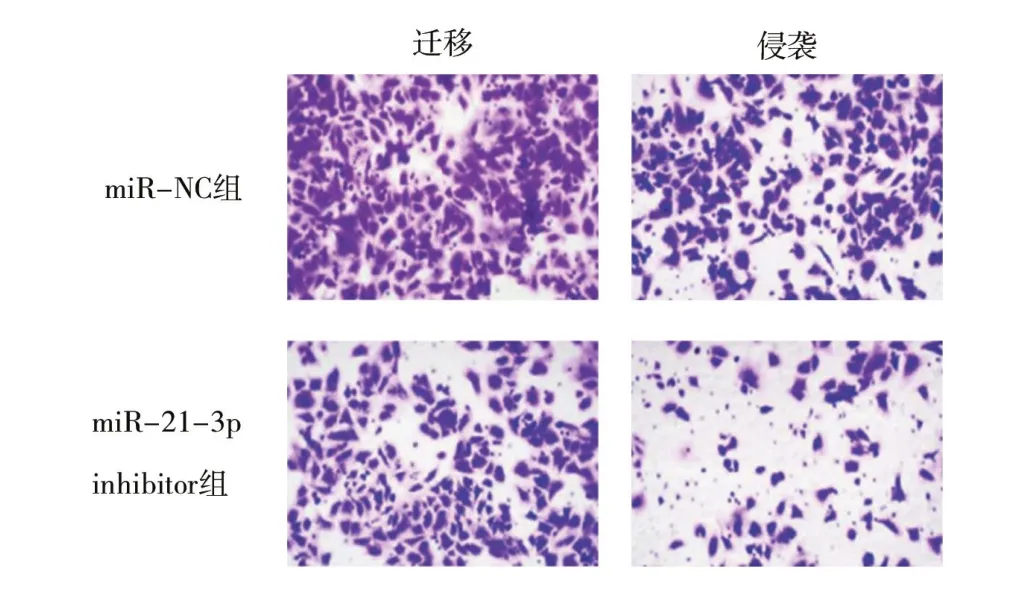
图2 各组A549细胞迁移与侵袭的Transwell图(×200)
2.4 荧光素酶报告基因检测miR-21-3p与CTDSPL的靶向关系首先用Target Scan鉴定miR-21-3p的潜在mRNA靶标,并预测CTDSPL是miR-21-3p的靶基因,见图3。为了证实CTDSPL是miR-21-3p的真正分子靶标,在miR-21-3p mimic 或miR-21-3p inhibitor与CTDSPL WT 3'-UTR质粒和CTDSPL Mut 3'-UTR质粒的共转染后,在A549细胞中进行荧光素酶报告分子测定。共转染实验显示,miR-21-3p mimic显著降低了A549细胞中WT型CTDSPL的荧光素酶活性(WT+miR-NC组vs WT+miR-21-3p mimic组),采用miR-21-3p inhibitor转染则显著增加了这种活性(WT+miR-NC组vs WT+miR-21-3p inhibitor组),通过数据比较,差异均有统计学意义(均P<0.05);但使用Mut型CTDSPL未观察到该结果,通过数据比较,差异无统计学意义(P>0.05),表2。
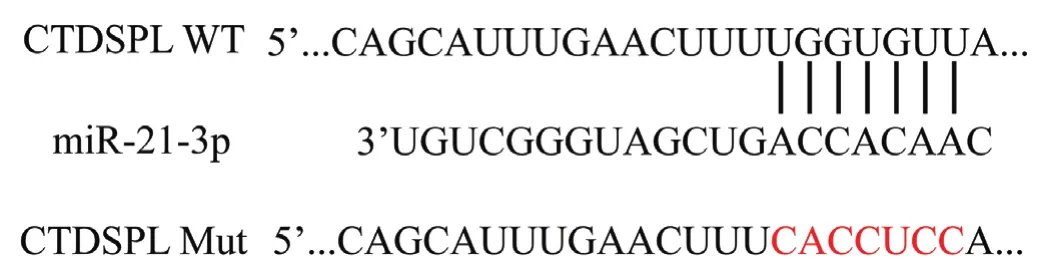
图3 预测的CTDSPL的3′-UTR区与miR-21-3p的结合序列以及构建的CTDSPL突变体
表2 各组相对荧光活性比较( ±s )
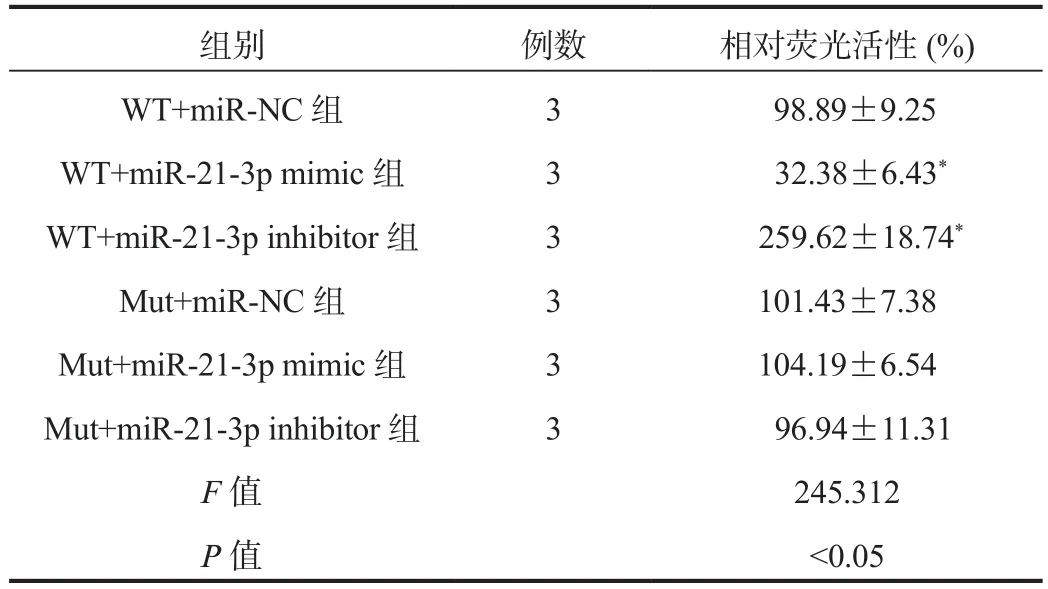
表2 各组相对荧光活性比较( ±s )
注:与WT+miR-NC组比,*P<0.05。
组别 例数 相对荧光活性(%)WT+miR-NC组 3 98.89±9.25 WT+miR-21-3p mimic组 3 32.38±6.43*WT+miR-21-3p inhibitor组 3 259.62±18.74*Mut+miR-NC组 3 101.43±7.38 Mut+miR-21-3p mimic组 3 104.19±6.54 Mut+miR-21-3p inhibitor组 3 96.94±11.31 F值 245.312 P值 <0.05
2.5 CTDSPL蛋白表达情况Western blot法进一步研究了BEAS-2B细胞、A549细胞及转染miR-NC和miR-21-3p inhibitor的A549细胞中CTDSPL表达,结果显示,与BEAS-2B细胞比,A549细胞中CTDSPL表达显著降低,差异有统计学意义(P<0.05),见表3、图4;与miR-NC组比,miR-21-3p inhibitor组CTDSPL蛋白表达显著升高,差异有统计学意义(P<0.05),见表4、图5。
表3 BEAS-2B和A549细胞中CTDSPL蛋白相对表达量比较 ( ±s )

表3 BEAS-2B和A549细胞中CTDSPL蛋白相对表达量比较 ( ±s )
注:CTDSPL:CTD小磷酸酶样蛋白。
组别 例数 相对表达量(%)BEAS-2B细胞 3 101.43±5.21 A549细胞 3 28.69±7.43 t值 26.478 P值 <0.05
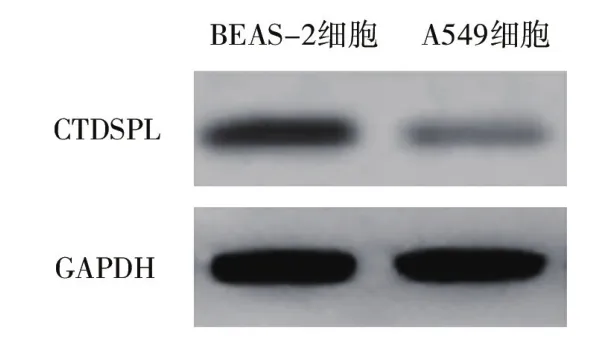
图4 Western blot法检测BEAS-2B和A549细胞中CTDSPL蛋白表达
表4 miR-NC组和miR-21-3p inhibitor组A549细胞中CTDSPL蛋白相对表达量比较( ±s )

表4 miR-NC组和miR-21-3p inhibitor组A549细胞中CTDSPL蛋白相对表达量比较( ±s )
组别 例数 相对表达量(%)miR-NC组 3 98.68±8.79 miR-21-3p inhibitor组 3 416.53±29.36 t值 25.412 P值 <0.05
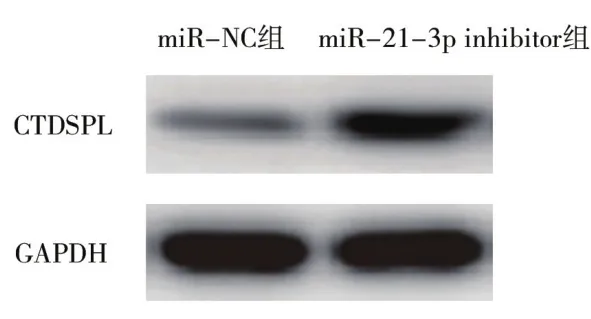
图5 Western blot法检测miR-NC组和miR-21-3p inhibitor组CTDSPL的蛋白表达
2.6 敲低miR-21-3p表达通过CTDSPL降低A549细胞的增殖、迁移和侵袭与miR-21-3p inhibitor+sh-Con组比较,miR-21-3p inhibitor+sh-CTDSPL组细胞活性、细胞迁移数和细胞侵袭数均显著增加,差异均有统计学意义(均P<0.05),见表5、图6。
表5 sh-CTDSPL能部分逆转miR-21-3p inhibitor对A549细胞增殖、迁移及侵袭的抑制作用( ±s )

表5 sh-CTDSPL能部分逆转miR-21-3p inhibitor对A549细胞增殖、迁移及侵袭的抑制作用( ±s )
注:与miR-NC+sh-Con组比,#P<0.05;与miR-21-3p inhibitor+sh-Con组比,△P<0.05。
组别 例数 细胞活性(%) 迁移细胞数(个) 侵袭细胞数(个)miR-NC+sh-Con 组 3 102.38±10.54 236.45±29.56 124.52±18.56 miR-21-3p inhibitor+sh-Con 组 3 49.56±6.23# 83.66±24.52# 56.73±9.28#miR-21-3p inhibitor+sh-CTDSPL组 3 78.35±8.42△ 178.53±20.15△ 101.23±21.54△F值 89.692 71.034 125.395 P值 <0.05 <0.05 <0.05
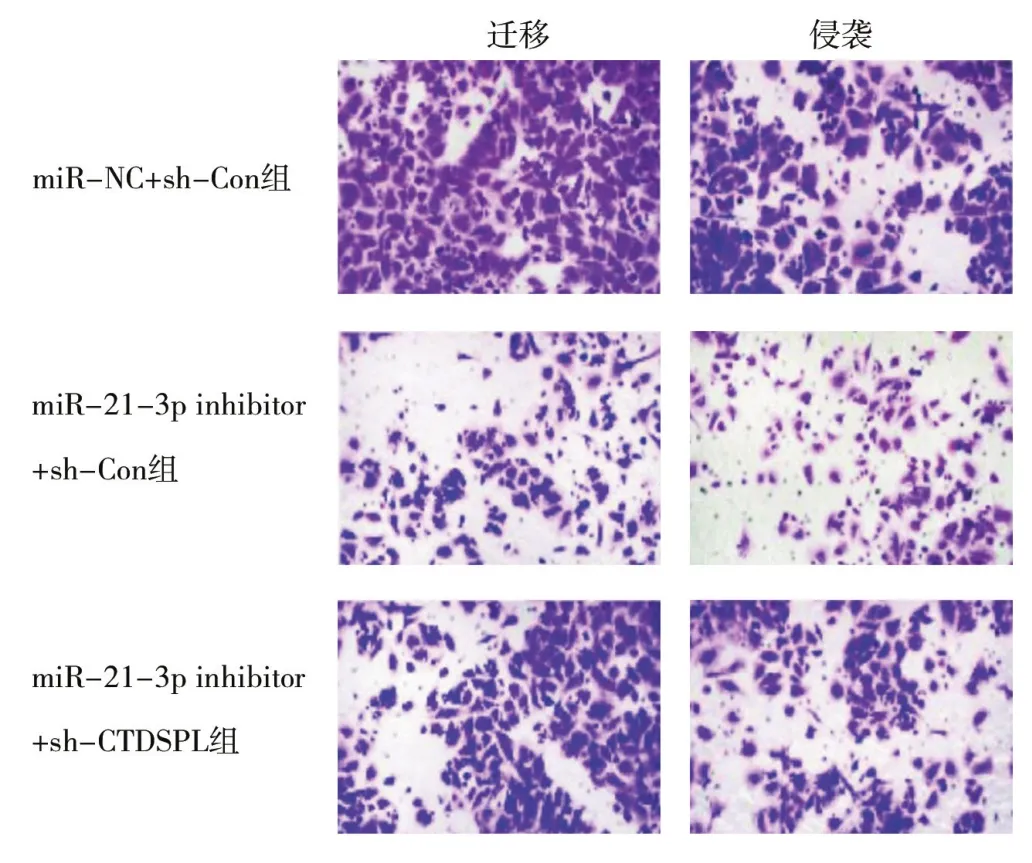
图6 各组代表性细胞迁移与侵袭的Transwell图(×200)
3 讨论
肺癌是全世界最常见的恶性肿瘤之一,肺癌一旦发生转移,预后较差,研究表明,NSCLC细胞的高速增殖、迁移及侵袭水平不仅能促进NSCLC的进展,还与其预后不良密切相关[4]。尽管近几十年来对NSCLC进展的机制已进行了大量研究且已取得了众多成果,但目前对于NSCLC细胞的增殖、迁移及侵袭的机制仍不完全清楚。对影响NSCLC的机制进一步研究有助于制定更优的NSCLC治疗策略。因此,探索NSCLC的进展中新的分子靶标和作用机制,对于延长NSCLC患者的生存至关重要。
miRNAs在肿瘤细胞的增殖、迁移及侵袭中发挥重要作用[5]。其中,miR-21-3p定位于人类染色体17q23.1上,其已被发现在乳腺癌、直肠癌及口腔癌等多种恶性肿瘤患者中呈异常高表达,且可发挥促肿瘤因子作用[6-8]。本研究发现,miR-21-3p也在NSCLC肿瘤组织和细胞中呈高表达,提示miR-21-3p在NSCLC细胞进展中可能也发挥着重要作用。为验证miR-21-3p在NSCLC进展中的作用,本研究进一步在A549细胞中转染miR-21-3p inhibitor,结果发现,抑制miR-21-3p的表达可以降低A549细胞的增殖、迁移及侵袭,这一结果提示抑制miR-21-3p的表达可能是潜在的抵抗NSCLC进展的有效策略。miRNAs是通过转录后调控靶基因的表达来发挥生物学作用[9]。先前已有研究发现,miR-21可通过靶向HBP1增强耐药性肺腺癌细胞的侵袭和迁移[10]。而同一个miRNA可通过不同的靶基因在机体中发挥相同甚至不同的生物学效应。因此,本研究对miR-21-3p在发挥调控NSCLC中作用的靶基因进行了进一步探索,发现CTDSPL是miR-21-3p的靶基因,抑制miR-21-3p的表达且能上调CTDSPL的表达。已有文献报道,CTDSPL高表达能促进肺癌细胞的增殖、迁移及侵袭[11]。尽管miR-21-3p具有许多其他靶向基因,但sh-CTDSPL可以成功地抵抗miR-21-3p inhibotor对NSCLC细胞增殖、迁移及侵袭的抑制作用,这些发现揭示了上调靶基因CTDSPL的表达是miR-21-3p作为抑制NSCLC进展中的关键机制。
综上,miR-21-3p在NSCLC细胞中呈高表达,下调其表达能通过促进CTDSPL的表达来抑制NSCLC的增殖、迁移和侵袭。此外,下调CTDSPL可以部分逆转抑制miR-21-3p表达对NSCLC的增殖、迁移和侵袭的抑制作用,这些结果可能为临床治疗NSCLC提供一种新的参考方法。

