酶解预处理工艺在烟叶茄尼醇提取中的应用
黄振瑞 柳颖 黎志德






摘 要:为提高烟叶中茄尼醇的提取率,通过纤维素酶-半纤维素酶联用的方法对烟叶进行预处理,研究了酶种类、添加量、温度、pH和反应时间对烟叶提取液中游离茄尼醇和总茄尼醇含量的影响,并以Box-Behnken响应面法优化酶解工艺。结果表明,在单因素试验中,最优工艺为纤维素酶-半纤维素酶联用(酶添加量为每克烟叶各1.00 U)、温度55 ℃、pH 5.2和反应时间60 min;与未经酶解预处理的空白组(CK)相比,纤维素酶-半纤维素酶联用处理后,游离和总茄尼醇提取率分别增加305.61%和113.55%,响应面法优化后,总茄尼醇提取率较CK提高158.78%。本研究探索出一种提高茄尼醇提取率的有效方法,对烟草综合利用具有指导意义。
关键词:烟叶;茄尼醇;酶解;响应面法
Abstract: In this study, both cellulase and hemicellulose were used in pretreatment process in order to improve the extraction rate of solanesol in tobacco leaves. The effects of enzyme types, dosage, temperature, pH and reaction time on the content of free solanesol and total solanesol in tobacco leaf extracts were studied. Optimization of enzymatic hydrolysis was carried out by the Box-Behnken response surface method. The results of single-factor experiment showed that the optimal enzymatic hydrolysis process was cellulase-hemicellulase combined use (1.00 U per gram of tobacco leaves), temperature 55 ℃, pH 5.2 and reaction time 60 min; Compared with the control group without enzymatic hydrolysis pretreatment, the extraction rate of free solanesol of the cellulase-hemicellulase combined use group was increased by 305.61% and the total solanesol was increased by 113.55%. After response surface optimization, the total solanesol extraction rate was increased by 158.78% compared with the control group. This study has explored an effective way to improve the extraction rate of solanesol in tobacco leaves, which has guiding significance for the comprehensive utilization of tobacco.
Keywords: tobacco leaf; solanesol; enzymatic hydrolysis; response surface methodology
茄尼醇(Solanesol)是一种不饱和的聚异戊二烯醇,属四倍半萜醇和长链脂肪醇[1],具有抗菌、消炎和止血作用,同时也是许多药物的重要中间体,可用于合成N-茄尼基谷酰氨、辅酶Q10[2]和维生素K2[3]等,广泛存在于烟草、马铃薯和桑树等植物中,以烟草中的含量最为突出,最高可达3%[4]。其在烟草中以游离态或化合态形式存在,新鲜烟叶中通常以化合态为主,随着贮存时间的延长逐渐转化为游离态[5]。茄尼醇易溶于正己烷等有机溶剂,微溶于乙醇[6],在光照、加热环境中易发生衰变[7]。目前茄尼醇的提取方式以有机溶剂(如正己烷、乙醇)提取为主,存在提取时间长、溶剂使用量大,易出现乳化现象导致难以分层等问题[8]。其他提取方法如超临界二氧化碳萃取、分子蒸馏和微波辅助萃取等,存在前期设备投入大,工艺复杂不利于扩大等问题,在实际生产中鲜有应用[9]。
植物细胞壁主要包含纤维素、半纤维素、木质素和少量果胶,使用相应水解酶可破坏细胞壁,促进组织内物质释放,从而提高提取效率。酶解处理具有反应条件温和、试剂用量少和绿色环保高效等优点[10],已被广泛应用于活性天然产物的提取工艺中,如酶解辅助提取白藜芦醇[11]和羟基酪醇[12]等。以纤维素酶为主的复合酶制剂被报道用于提高烟叶中茄尼醇[13]、烟碱[14]、绿原酸[15]和香气物质[16]的提取率,但以上研究仍存在提取时间长、酶添加量大等不足。造成以上问题的原因可能是,半纤维素与木质素相互交联覆盖于纤维素表面形成致密保护层,阻碍了酶对纤维素的可及性,而采用相应酶水解半纤维素和木质素有助于全面破坏植物细胞壁[17-18],提升天然产物提取率。有文献以纤维素酶-木质素酶复合预处理提升烟叶中茄尼醇提取率[13],尚未见在煙叶中使用半纤维素酶及纤维素酶-半纤维素酶联用预处理辅助提取茄尼醇的报道。本试验在正己烷超声提取茄尼醇的基础上,探索以较低量添加纤维素酶和半纤维素酶对烟叶进行预处理来提升茄尼醇提取率、缩短萃取时间,为烟叶资源综合利用提供经济便捷的新方法。
1 材料与方法
1.1 主要材料与仪器
烟叶由广东省农业科学院作物研究所广东省烟草育种与综合利用工程技术研究中心提供。
试剂:纤维素酶40 000 U/g、半纤维素酶20 000 U/g(上海源叶生物科技有限公司),正己烷、无水乙醇(AR,上海麦克林生化科技有限公司);甲醇、异丙醇[色谱纯,西格玛奥德里奇(上海)贸易有限公司],冰乙酸、柠檬酸、氢氧化钠、磷酸氢二钾(AR,国药集团化学试剂有限公司)。
纤维素酶活力单位:1 h水解底物(滤纸、CMC、脱脂棉或水杨素)产生1 mg葡萄糖的酶量为1个酶活力单位U。
半纤维素酶活力单位:1 min内从半纤维素产生1 μg还原糖所需要的酶量为1个酶活力单位U。
仪器:Q-Grad型四元高压混合梯度泵、在线脱气机、自动进样器、605型柱温箱(美国SSI公司);检测器,Lab Alliance CS4000 Model 201;色谱柱,Apollo C18 5u反相分离柱(美国Grace公司);超声振荡器JH-1001(郑州长城科工贸有限公司)。
1.2 提取工艺
1.2.1 烟叶前处理 将约1.5 kg烟叶置于烘箱中55 ℃烘至恒重,碾碎后混合均匀,置于防潮箱中备用。每试验组取样3次,每次取1 g烟叶;每个样品平行测定3次。
1.2.2 酶解辅助提取烟叶茄尼醇工艺流程 经前处理的烟叶→缓冲液浸泡预热→加入酶制剂(空白对照CK以灭活酶液代替)→涡旋振荡→水浴→弃液烘干→超声辅助正己烷萃取→离心→取上清→皂化→水洗→定容。
将烟叶按1∶10(m∶V)置于乙酸-乙酸钠缓冲液中预热15 min,加入经适当稀释的酶液振荡摇匀,水浴保温至预定时间,弃去液体部分,残余烟叶55 ℃烘干待用。按1∶30(m∶V)向烟叶加入正己烷,45 ℃水浴中以1500 w功率超声提取15 min,然后4000 r/min离心10 min,收集上清后分两次向烟叶加入1∶10(m∶V)的正己烷重复上述步骤,合并上清,稀释定容,分析游离茄尼醇的含量。空白对照(CK)烘干后,直接加入正己烷按上述步骤提取。
取4 mL定容后的提取液加入4 mL 0.02 mol/L氢氧化钠-乙醇溶液,摇匀后加塞,并在60~65 ℃条件下振荡皂化2 h,收集皂化液,加入适量正己烷补齐体积至4 mL,加入3 mL蒸馏水涡旋振荡,稀释定容,分析总茄尼醇的含量。
1.2.3 酶解工艺参数优化试验 分别以酶种类、添加量、温度、pH和水解时间对烟叶提取液中游离茄尼醇和总茄尼醇含量的影响进行单因素试验。
酶种类与添加量的影响:纤维素酶和半纤维素酶每克烟叶添加量为0.25、0.50、1.00、2.50和5.00 U,其中pH及温度条件按酶活最适条件设定(纤维素酶pH 4.8[19],半纤维素酶pH 5.6[20])温度45 ℃下反应1 h,未加酶处理的空白组为对照(CK)。
温度的影响:温度为25、35、45、55和65 ℃,酶添加量为纤维素酶和半纤维素酶各1.00 U,反应pH为4.8,反应时间1 h。
pH的影响:以乙酸-乙酸钠、柠檬酸-磷酸氢二钠缓冲溶液配制不同的pH体系,分别为4.0、4.4、4.8、5.2、5.6和6.0,酶添加量为每克烟草纤维素酶和半纤维素酶各1.00 U,反应温度45 ℃,反应时间1 h。
时间的影响:选取不同的反应时间30、60、90和120 min,酶添加量为每克烟草纤维素酶和半纤维素酶各1.00 U,反应pH为4.8,反应温度45 ℃。
基于上述单因素试验结果,采用Design-Expert设计响应面优化酶解工艺参数,以反应温度、pH和时间为自变量,以未经酶解处理的空白组总茄尼醇提取量为对照,考察不同酶解工艺参数组合对茄尼醇提取率的影响。其中反应温度为25~65 ℃,反应pH为4.0~6.0,反应时间为15~120 min。
1.2.4 茄尼醇的分析方法 采用GB/T 31758—2015《烟叶和烟叶提取物中茄尼醇的测定》中的方法对各样本组游离茄尼醇与总茄尼醇含量进行分析。具体条件如下:流动相V甲醇∶V异丙醇=7∶3;柱温40 ℃;检测波长213 nm;流速1.3 mL/min,进样体积20 μL。取适量的茄尼醇系列标准溶液及待上机试样溶液,由保留时间进行定性,根据系列标准液的浓度及茄尼醇响应峰面积建立标准曲线。计算进样液茄尼醇浓度后,根据待测液体积以及样品称样量换算出烟叶样品中茄尼醇含量。
1.2.5 数据处理 采用Design-Expert 12.0和Excel 2019 MSO进行试验设计、数据分析和作图,每个样本重复3次,组间分析使用单因素方差分析(ANOVA)和Box-Behnken响应面法,结果采用平均值±偏差表示。
茄尼醇提取增长率:
X:样本茄尼醇含量,mg/g;
T0:对照组茄尼醇含量,mg/g。
2 结 果
2.1 酶添加量对提取液中茄尼醇含量的影响
由图1、2可知,与CK相比,经酶解预处理的各组提取液中游离与总茄尼醇含量均有所提高。由图1可知,纤维素酶添加量为每克烟叶1.00 U时,提取液中游离茄尼醇与总茄尼醇含量均较CK增长明显,而添加量在1.00~5.00 U时,提取液中总茄尼醇含量增长放缓至出现下滑。试验中观察到添加量为每克烟叶2.50 U及5.00 U的样本,经酶解预处理后烟叶质量大幅下降,萃取液中出现大量浑浊物,两相分层界面模糊,为控制加酶成本和确保后续工艺方便,纤维素酶添加量选择为每克烟叶1.00 U。由图2可知,半纖维素酶添加量每克烟叶1.00 U时提取液中总茄尼醇含量最高,添加量每克烟叶1.00~5.00 U时提取液中游离茄尼醇继续升高,但总茄尼醇含量下滑趋势明显,推测是由于酶解程度过大导致总茄尼醇在预处理阶段流失,因此半纤维素酶添加量选择为每克烟叶1.00 U。
2.2 温度对提取液中茄尼醇含量的影响
由图3可知,提取液中游离茄尼醇含量受温度影响较小,但酶处理组均高于CK。提取液中总茄尼醇含量受温度影响较大,45~55 ℃总茄尼醇含量最高,当温度升至65 ℃,提取液中总茄尼醇含量明显下降。为保证茄尼醇稳定并控制能耗成本,酶解温度选择55 ℃。
2.3 pH对提取液中茄尼醇含量的影响
由图4可知,pH低于4.8时提取液中游离及总茄尼醇含量与CK相当,pH在4.8~5.6时提取液中游离及总茄尼醇含量较CK有明显提高,其中pH为4.8和5.2两组样本含量最高且接近。当pH升至6.0时,提取液中茄尼醇含量下降到CK水平,因此酶解pH选择为5.2。
2.4 酶解时间对提取液中茄尼醇含量的影响
由图5可知,各组提取液中游离和总茄尼醇含量均高于CK。酶解时间30~60 min时,游离和总茄尼醇提取量随时间延长而上升,60 min后,随酶解时间延长游离和总茄尼醇提取率逐渐下降。因此,酶解时间选择60 min。
2.5 单因素试验结果验证
以反应温度55 ℃、pH 5.2和反应60 min为最优参数,烟叶提取液中的茄尼醇含量见表1。由表1可知,单一纤维素酶、单一半纤维素酶、双酶联用酶解处理与CK相比,提取液中游离茄尼醇的含量分别提高了158.05%、197.80%和305.61%,总茄尼醇含量提高了78.29%、71.95%和113.55%。双酶处理游离茄尼醇较单一酶处理提高36.20%~57.18%,总茄尼醇提高19.78%~24.20%。因此,优选双酶联用进行酶解预处理。
2.6 基于Box-Behnken响应面法优化酶解预处理工艺
每組分别按每克烟叶1.00 U添加纤维素和半纤维素酶,由Design-Export调整反应温度、pH和时间3个参数组合生成17个试验组,考察各组扣除空白对照的总茄尼醇提取增长率,拟合方程为:
Y=1.463 69−0.0446 327A−0.167 564B+0.042 855 3C+0.340 852AB+0.383 681AC+0.584 477BC−0.411 444A2−0.515 03B2−0.754 646C2
响应面试验设计和结果见表2。由表2可知,组别13、16、17提取增长率为负值,说明该项工艺参数提取率较不作酶处理的空白对照1差,组别2工艺参数为45 ℃、pH 5.2和60 min的试验组增长率最高为158.60%。
响应面拟合回归方程的方差分析见表3。由表3可知方差分析模型的p-value<0.05,拟合精度好,可利用该响应面近似模型进行后续优化设计。3个自变量相互作用显著(p<0.05),同时失拟误差不显著,说明模型与真实值具有较好的拟合[21]。
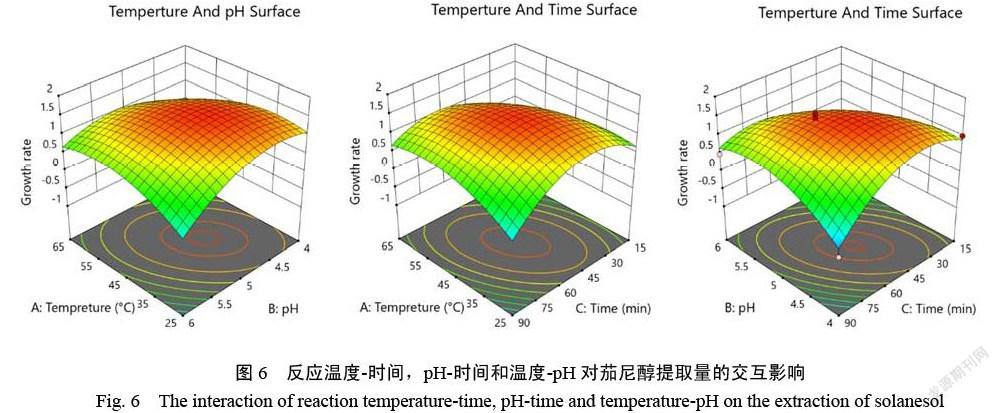
酶解参数互作对茄尼醇萃取效率的影响见图6。由图6可知,3个图谱均呈现出同心椭圆形,说明两两参数间交互作用明显。在45~50 ℃和pH 4.6~5.0;pH 4.4~5.2和40~65 min以及35~55 ℃和40~50 min三组区间内茄尼醇提取率都处于高水平,3个自变量的变化趋势与单因素试验中较吻合。通过响应面三维立体图通过软件对模型极值进行推算,酶解工艺在温度45 ℃,pH 4.8下酶解反应51 min后进行提取可获得最高的茄尼醇提取率,最终实际验证该条件下提取茄尼醇增长率158.78%。
3 讨 论
本研究通过单因素试验及响应曲面法优化了酶解预处理辅助提取烟叶中茄尼醇的工艺参数,采用纤维素酶与半纤维素酶水解细胞壁,促进茄尼醇溶出。酶添加量增加可促进酶蛋白与烟叶有效接触,使水解反应速度加快,延长酶解时间可以促使烟叶细胞内含物充分释放;但是,酶解程度过大时会导致茄尼醇过早析出,造成后续提取量下降。酶蛋白对温度和pH敏感,在其最适温度(45 ℃)和pH条件(纤维素酶pH 4.8,半纤维素酶pH 5.6)下酶活力最高,结合相应萃取工艺可得到最优的茄尼醇提取量。在单因素实验优化的最佳条件(反应温度55 ℃、pH 5.2和反应60 min)下,纤维素酶、半纤维素酶单独使用以及纤维素酶-半纤维素酶联用时,提取液中茄尼醇含量均有大幅提高,说明酶解预处理能有效提高烟叶中茄尼醇的提取率;纤维素酶-半纤维素酶联用与使用单酶处理相比,茄尼醇提取率分别提高36.20%~57.18%(游离茄尼醇)和19.78%~24.20%(总茄尼醇),说明双酶联用能进一步提高对烟叶中茄尼醇的提取率。
本研究确定的最佳预处理工艺,每克烟叶按纤维素酶-半纤维素酶1∶1各添加1.00 U,在45 ℃,pH 4.8酶解51 min,与王星敏等[13]按纤维素酶∶木质素酶15∶1,每克烟叶共添加175 U并酶解8 h的处理工艺相比,大幅减少酶添加量,缩短酶解预处理时间。另外,本研究通过3次共45 min即完成有机溶剂提取步骤,与GB/T—31758中要求的12 h及其他工艺方法[7,9,13]要求的单次1~2 h并重复多次相比,溶剂提取时间缩短,生产效率提升。该工艺尚待研究改进的地方在于:(1)酶解处理后烟叶需充分烘干才可进行正己烷提取;(2)烟叶酶解处理后重量明显下降,为减少有机溶剂用量创造可能,但烟叶的减重幅度与酶的添加量、反应条件等的对应关系有待研究;(3)不同品种烟叶的茄尼醇含量[22]和细胞壁纤维素、半纤维素、木质素比例有所不同[23],下一步需结合具体的生产条件,对该工艺进行细化研究。
4 结 论
本研究建立了一种酶解预处理辅助提取烟叶中茄尼醇的工艺,通过纤维素酶-半纤维素酶联用预处理,显著提升了烟叶提取液中茄尼醇的含量。本方法操作简单,酶添加量小,酶解及溶剂提取时间大幅缩短,对烟草资源的综合利用具有一定指导意义。
参考文献
[1]STEDMAN R L. Chemical composition of tobacco and tobacco smoke[J]. Chemical Reviews, 1968, 68(2): 153-207.
[2]LIPSHUTZ B H. Devising an especially efficient route to the ‘miracle’ nutrient coenzyme Q10[J]. Chem inform, 2005, 36(23): 269-292.
[3]TANG D S, ZHANG L, CHEN H L, et al. Extraction and purification of solanesol from tobacco: (I). Extraction and silica gel column chromatography separation of solanesol[J]. Separation and Purification Technology, 2007, 56(3): 291-295.
[4]DAVIS D L, NIELSEN M T. 煙草—生产,化学和技术[M]. 北京:化学工业出版社,2003:251-270.
DAVIS D L, NIELSEN M T. Tobacco: production, chemistry and technology[M]. Beijing: Chemical Industry Press, 2003: 251-270.
[5]杜咏梅,张怀宝,张忠锋,等. 我国烤烟茄尼醇含量及其与烟草和烟气主要化学成分的相关性[J]. 中国烟草科学,2014,35(6):54-58.
DU Y M, ZHANG H B, ZHANG Z F, et al. Solanesol content in flue-cured tobacco leaves and its correlations with main chemical components of leaf and mainstream smoking[J]. Chinese Tobacco Science, 2014, 35(6): 54-58.
[6]彭靖里,马敏象,吴绍情,等. 论烟草废弃物的综合利用技术及其发展前景[J]. 中国资源综合利用,2001(8):18-20.
PENG J L MA M X, WU S Q, et al. Comprehensive utilization technology of tobacco waste and its development prospect[J]. Comprehensive Utilization of Resources in China, 2001(8): 18-20.
[7]岑波,段文贵,赵树凯. 从废次烟草中提取茄尼醇的新工艺研究[J]. 广西大学学报(自然科学版),2002(3): 240-242.
CENG B, DUAN W S, ZHAO S K. Study on the new technology of extracting solanesol from waste tobacco[J]. Journal of Guangxi University (Natural Science Edition), 2002(3): 240-242.
[8]周新光,薛华欣,陆华,等. 废弃烟草中茄尼醇和烟碱的提取[J]. 中国医药工业杂志,2006,37(7):458-459.
ZHOU X G, JIANG H X, LU H, et al. Isolation of solanesol and nicotine from discarded tobacco[J]. Chinese Journal of Pharmaceuticals, 2006, 37(7): 458-459.
[9]唐德松. 烟叶中茄尼醇的提取与分离研究[D]. 杭州:浙江大学,2007.
TANG D X. Extraction and separation of solanesol from tobacco[D]. Hangzhou: Zhejiang University, 2007.
[10]YOSHIYUKI K, HIROMICHI O. Resveratrol isolated from polygonum cuspidatum root prevents tumor growth and metastasis to lung and tumor-induced neovascularization in lewis lung carcinoma-bearing mice[J]. Journal of Nutrition, 2001(6): 1844-1849.
[11]黄志芳,易进海,刘倩伶,等. 酶解法提取纯化虎杖提取物中白藜芦醇的工艺研究[J]. 天然产物研究与开发,2009,21(6):1061-1064.
HUANG Z F, YI J H, LIU Q L, et al. Research of extracting and purifying process of resveratrol from polygonum cuspidatum extxact by enzymic hydrolysis[J]. Natural Product Research and Development, 2009, 21(6): 1061-1064.
[12]李春燕,颜军,陈封政,等. 油橄榄叶中羟基酪醇的提取及分离纯化[J]. 食品与发酵工业,2014,40(4):227-232.
LI C Y, YAN J, CHEN F Z, et al. Extraction, separation and purification of hydroxytyrosol from olive leaves[J]. Food and Fermentation Industries, 2014, 40(4): 227-232.
[13]王星敏,张渝文,张桂芝,等. 酶解破壁促进废次烟叶中茄尼醇溶浸[J]. 生物工程学报,2013,29(11):1706-1710.
WANG X M, ZHANG Y W, ZHANG G Z, et al. Improved extraction of solanesol from tobacco waste by enzymatic cell wall breaking[J]. Chin J Biotech, 2013, 29(11): 1706-1710.
[14]吳映捷,吕新美,闫兵兵,等. 响应面法优化酶辅助提取废弃烟叶中烟碱[J]. 山东农业大学学报(自然科学版),2017,48(2):203-209.
WU Y J, LYU X M, YAN B B, et al. Optimization of nicotine extracted from abandoned tobacco with response surface method[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2017, 48(2): 203-209.
[15]朱松,娄在祥,陈尚卫,等. 超声辅助酶法提取废次烟叶中绿原酸、烟碱工艺研究[J]. 食品工业科技,2012,33(5):181-184.
ZHU S, LOU Z X, CHEN S W, et al. Study on ultrasound-assisted enzyme extraction of chlorogenic acid and nicotine from tobacco leaves[J]. Science and Technology of Food Industry, 2012, 33(5): 181-184.
[16]宁勇,王晶,陈小敏,等. 福建烟叶提取物的制备及其在卷烟中的应用[J]. 香料香精化妆品,2019(5):21-25.
NING Y, WANG J, CHEN X M, et al. Preparation of Fujian tobacco leaf extract and its application in cigarettes[J]. Fragrance Flavor Cosmetic, 2019(5): 21-25.
[17]吉喆,凌喆,张逊,等. 预处理对木质纤维素生物质细胞壁超微结构的影响[J]. 生物工程学报,2014,30(5):707-715.
JI Z, LING Z, ZHANG X, et al. Effect of pretreatment on topochemical and ultrastructural changes of lignocellulose plant cell walls[J]. Chin J Biotech, 2014, 30(5): 707-715.
[18]李春黎,李文豪,余君,等. 烟秆高效复合降解菌群的筛选、鉴定及组合应用[J]. 中国烟草科学,2019,40(6):26-32.
LI C L, LI W H, YU J, et al, Screening, identification and combination of high efficiency degrading bacteria for tobacco stem[J]. Chinese Tobacco Science, 2019, 40(6): 26-32.
[19]罗伟光. 枯草芽孢杆菌源纤维素酶基因的克隆、表达及其酶学性质[D]. 洛阳:河南科技大学,2015.
LUO W G. Cloning, expression and enzymatic properties of cellulase gene from Bacillus subtilis[D]. Luoyang: Henan University of Science and Technology, 2015.
[20]BUCHERT J, RANUA M, KANTELINEN A, et al. The role of two Trichoderma reesei xylanases in the bleaching of pine kraft pulp[J]. Applied Microbiology & Biotechnology, 1992, 37(6): 825-829.
[21]李莉,张赛,何强,等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索,2015,34(8):41-45.
LI L, ZHANG S, HE Q, et al. Application of response surface methodology in experiment design and optimization[J]. Research and Exploration in Laboratory, 2015, 34(8): 41-45.
[22]向德虎,赵韬智,杜咏梅,等. 烟草茄尼醇含量的遗传分析[J]. 中国烟草科学,2015,36(6):1-7.
XIANG D H, ZHAO T Z, DU Y M, et al. Genetic analysis on solanesol content of tobacco[J]. Chinese Tobacco Science, 2015, 36(6): 1-7.
[23]唐军,陈兴,华一崑,等. 烟叶细胞壁物质研究进展[J]. 河北农业科学,2014,18(5):82-84.
TANG J, CHEN X, HUA Y K, et al. Research advancement of the cell wall substances in tobacco leaf[J]. Journal of Hebei Agricultural Sciences. 2014, 18(5): 82-84.
1221501186367

