超临界CO2在肉及肉制品杀菌中的应用研究进展
柴利 贺稚非 谢晓红 韩薇 李洪军
摘 要:超临界CO2是一种绿色、环保和实用的超临界流体,目前已广泛用于提取各种生物活性物质。近年来,随着非热杀菌技术的兴起,超临界CO2在杀菌方面的研究也显著增加。与冷等离子体、高压脉冲电场和高压CO2等非热杀菌技术相比,超临界CO2的操作温度和压力相对较低,能最大限度保留食品中的营养成分和提高食品的微生物安全性。本文综述超临界CO2对细菌、芽孢、真菌和病毒的灭活机理和影响其杀菌效率的因素。此外,还对超临界CO2杀菌技术的优势以及在肉及肉制品中的应用进行总结,并对目前存在的问题和未来的发展趋势进行阐述,旨在为该技术在肉及肉制品中的进一步研究和应用提供参考。
关键词:超临界CO2;肉及肉制品;微生物安全;杀菌机理;联合杀菌
Advances in the Application of Supercritical Carbon Dioxide in the Sterilization of Meat and Meat Products
CHAI Li1, HE Zhifei1,2, XIE Xiaohong3, HAN Wei1, LI Hongjun1,2,*
(1.College of Food Science, Southwest University, Chongqing 400715, China; 2.Chongqing Engineering Technology Research
Centre of Regional Foods, Chongqing 400715, China; 3.Sichuan Academy of Animal Science, Chengdu 610000, China)
Abstract: Supercritical carbon dioxide is a green, environmentally friendly and practical supercritical fluid. At present, it is used to extract various bioactive substances. With the rise of non-thermal sterilization technology, research on the application of supercritical carbon dioxide in sterilization has increased significantly in recent years. Compared with non-thermal sterilization technologies such as cold plasma, high-voltage pulsed electric field and high-pressure carbon dioxide, supercritical carbon dioxide is operated at relatively low temperature and pressure, and thus can preserve nutrients in foods to the maximum extent while improving the microbiological safety of foods. This article reviews the inactivation mechanism of bacteria, spores, fungi and viruses by supercritical carbon dioxide and the factors affecting the sterilization efficiency. In addition, this paper not only summarizes the advantages of supercritical carbon dioxide technology for microbial inactivation and its applications on meat and meat products, but also discusses existing problems and future development trends. We anticipate that this review will provide a reference for further application of supercritical carbon dioxide technology on meat and meat products.
Keywords: supercritical carbon dioxide; meat and meat products; microbiological safety; sterilization mechanism; combined sterilization
DOI:10.7506/rlyj1001-8123-20210924-214
中圖分类号:TS205.9 文献标志码:A 文章编号:1001-8123(2022)02-0046-07
引文格式:
柴利, 贺稚非, 谢晓红, 等. 超临界CO2在肉及肉制品杀菌中的应用研究进展[J]. 肉类研究, 2022, 36(2): 46-52. DOI:10.7506/rlyj1001-8123-20210924-214. http://www.rlyj.net.cn
CHAI Li, HE Zhifei, XIE Xiaohong, et al. Advances in the application of supercritical carbon dioxide in the sterilization of meat and meat products[J]. Meat Research, 2022, 36(2): 46-52. DOI:10.7506/rlyj1001-8123-20210924-214. http://www.rlyj.net.cn
肉及肉制品是人类饮食中蛋白质、脂肪、维生素和矿物质的主要来源。肉类中丰富的营养物质以及适宜的水分活度和pH值非常适合微生物生存[1]。微生物导致的腐败变质是影响肉类色泽、风味、气味和质地等感官品质和货架期的主要原因[2-3],所以微生物一直是影响肉及肉制品安全的重要因素,控制肉及肉制品中的微生物安全也是当今食品加工业中极为重要的环节。食品杀菌技术可分为热力杀菌和非热力杀菌。传统的热力杀菌,如巴氏杀菌、低温杀菌、高温杀菌和超高温瞬时杀菌已广泛用于果蔬汁、乳制品、肉及肉制品等食品中微生物和酶的灭活。热处理虽然能保证食品中的微生物安全,但其經常会对产品的色泽、风味等产生不利影响,这使得超临界流体、高静水压、紫外光、脉冲电场和超声等非热杀菌技术成为目前食品领域的研究热点。
在众多新兴的非热杀菌技术中,超临界CO2杀菌技术以其独特的优势受到了广泛关注。超临界流体状态下的CO2具有安全、廉价、非易燃、无毒、扩散速度快和传质效果好等特点[4],还具有非常低的黏度和表面张力,增强了超临界CO2对微生物细胞的渗透作用[5]。另外,超临界CO2杀菌技术的操作温度和压力较低,易于调节,能最大限度地减少不耐热营养素的降解,保持肉及肉制品的感官和营养特性。目前,超临界CO2杀菌技术已经用于液体(如果汁、啤酒和牛乳)和固体(如畜禽肉、鱼类、水果、蔬菜和香料)食品的杀菌[6-7]。有研究还表明,超临界CO2对多种细菌[8-9]、芽孢[10]、真菌[11]和病毒[12]都有灭活作用。因此超临界CO2杀菌是一种非常有发展潜力的非热杀菌技术。目前关于超临界CO2杀菌技术在肉及肉制品中的研究较多,但对其应用和杀菌机理的总结还缺乏较为全面的概述。基于此,本文综述超临界CO2杀菌技术的机理及影响灭菌效率的因素,总结超临界CO2杀菌技术在肉及肉制品中的应用,以期为超临界CO2杀菌技术在肉及肉制品加工业中的进一步研究和应用提供理论支撑。
1 超临界CO2灭活微生物的机理研究及影响杀菌效率的因素
1.1 超临界CO2灭活微生物的机理研究
超临界流体是指温度和压力均高于其临界点的流体,CO2的临界温度和临界压力分别为31.26 ℃和7.29 MPa,此状态下的CO2具有类似气体的扩散性及液体的溶解能力[13]。超临界CO2杀菌是一种新型的非热杀菌技术,其杀菌流程与萃取非常相似,主要是通过高压泵将CO2和产品泵入系统,再混合并保持一段时间以实现杀菌目的。总的来说,超临界CO2灭活微生物的作用来自多因素的组合,主要包括细胞质的酸化、CO32-浓度的提高、渗透胁迫、CO2萃取作用导致细胞膜通透性的增加和泄漏以及细胞的破裂等[14]。
1.1.1 灭活细菌的机理
目前,关于超临界CO2使细菌失活的机理主要有以下几种:1)CO2溶于水后降低了细胞外的pH值,抑制了细菌的新陈代谢和生长[15]。但是,这并不足以解释超临界CO2对微生物细胞的致死作用,因为在相同pH值条件下,CO2与盐酸相比具有更强的抑菌效果[16]。还有证据表明,缓冲液中的CO2对细菌的生长也有抑制作用[17],这说明pH值的降低不是导致细菌细胞损伤的直接原因,而应该是pH值的降低增强了细胞的通透性,从而有利于CO2向细胞内扩散。2)通过质子转运ATP酶来维持pH值稳态的能量消耗急剧增加,导致微生物对失活的抗性降低[18]。3)细胞结构及胞内的蛋白质和关键酶被破坏,其主要机理是超临界CO2扩散到细胞内,并从细胞壁和细胞膜中提取出疏水化合物和磷脂等重要成分,从而使得蛋白质变性和酶失活。例如,Xu Feiyue等[8]发现超临界CO2可用于灭活副溶血性弧菌,其作用机制是pH值的降低以及关键酶和细胞结构的破坏;赵玉芳等[19]也得到了类似的研究结果。Chen Yuanyao等[9]的研究结果也表明,大肠杆菌在高水分活度下经超临界CO2处理后死亡的主要原因是CO2诱导了膜流化作用和膜通透性的改变。4)细菌的遗传物质与变性的胞内蛋白缠绕在一起,转录和复制受到抑制。另外,细菌遗传物质也可能直接受到低pH值的影响而发生变性。Yao Chunyan等[20]在用碘化丙啶进行膜通透性研究时得出,在低pH值条件下,大肠杆菌的DNA发生变性,双螺旋展开,这表明核酸变性可能是超临界CO2使大肠杆菌失活的一个重要原因。5)破坏细胞内的电解质平衡。当CO2进入细胞后可以形成H2CO3,H2CO3解离形成CO32-,而CO32-可以沉淀细胞内的Ca2+和Mg2+等无机电解质[21]。由于这些无机电解质在维持细胞和周围环境的渗透平衡方面起着重要作用,因此这些离子的沉淀对整个细胞有不利影响。6)升压和降压过程会导致细胞内容物溢出,从而导致细胞死亡[8]。
1.1.2 灭活芽孢的机理
芽孢是细菌高度分化的休眠形式,对高温、化学试剂和辐射都具有极强的抗性。超临界CO2杀菌已成为一种很有前景的灭活芽孢的技术,在70 ℃以上的灭活量可达到6(lg(CFU/mL))[10]。但是,单独使用超临界CO2灭活芽孢需要相对较高的温度(60~90 ℃),在实际应用过程中也很少单独使用超临界CO2来灭活芽孢,添加少量的H2O2、过氧乙酸(peracetic acid,PAA)或水就可以在更低的温度和压力下杀灭芽孢[22]。例如,Park等[23]通过Box-Behnken设计和响应面法(10 MPa、44 ℃、12 min、231 μL H2O处理3 g大麦种子)证明了以水为辅助溶剂的超临界CO2可以有效杀灭大麦种子中的草酸青霉芽孢,并且发现草酸青霉芽孢的失活率随助溶剂(水)添加量的增加而显著增加。目前关于超临界CO2使芽孢失活的机理主要有以下2 种:一种是基于动力学的萌发失活机制,另一种是基于形态学和芽孢结构损伤的失活机制[24]。前者是假设芽孢先被激活,然后在萌发时超临界CO2使它们失活。然而,后来的研究表明,芽孢在超临界CO2中没有萌发,这与先前的假设相矛盾[24]。后者认为,芽孢失活是pH值降低导致休眠芽孢的内膜破坏和结构改变的结果[25],并且Rao Lei等[24]通过透射电子显微镜也证实了超临界CO2造成了芽孢皮层和内膜的损伤。综上,超临界CO2使芽孢失活的机理是超临界CO2增加了细胞内膜的通透性,使得CO2进入细胞后破坏了内膜中与芽孢萌发相关的蛋白质,这些变化阻止了芽孢进一步萌发。
1.1.3 灭活真菌和病毒的机理
酵母菌和霉菌等真菌污染是食品加工业中一个严重的问题,给食品行业带来了巨大的经济损失。虽然超临界CO2对真菌的灭活作用尚未得到广泛的研究,但比较大肠杆菌和真菌所需的灭活条件发现,真菌表现出更强的抗性。例如,Garcia-Gonzalez等[11]发现,在相同条件下(10 MPa、35 ℃、20 min)真菌的敏感性明显低于细菌,其中真菌(如克福尔蒂青霉、黑曲霉、酿酒酵母和白色念珠菌)失活量不超过2(lg(CFU/mL)),而细菌(如单增李斯特菌、鼠伤寒沙门氏菌、荧光假单胞菌和小肠结肠炎耶尔森菌)失活量为3.5~5.0(lg(CFU/mL));但粪肠球菌和酸杆菌等细菌比真菌表现出更强的抗性(仅降低0.3(lg(CFU/mL)))。因此,超临界CO2杀菌用于灭活真菌的机理还需要进一步的研究。
除了细菌和真菌外,病毒也可能会污染食品。对食品安全造成威胁的病毒主要有诺如病毒、甲型和戊型肝炎病毒、轮状病毒、朊病毒和禽流感病毒等。目前关于超临界CO2灭活病毒的研究主要集中在医用生物材料方面。有研究者发现,CO2比N2O具有更好的抗病毒活性,说明病毒灭活可能与酸化有关;进一步的研究发现,H2CO3解离产生的H+可以穿透噬菌体的蛋白质外壳并溶解磷脂,从而导致病毒死亡[12]。
1.2 影响超临界CO2杀菌效率的因素
超临界CO2的杀菌效率受多种因素的影响,如压力、温度、时间、食品种类、加工介质、水分含量、CO2的比例和污染水平等。一般来说,随着压力和温度的增加,微生物的失活速率也会增加。这主要是因为CO2在较高的压力下溶解能力也会增强,这有助于CO2溶解细胞和细胞膜中的重要成分,从而使微生物失活。而高温会促进CO2的扩散,还可以使细胞膜的流动性增强,甚至会导致细胞膜发生不可逆的改变[26]。侯思涵等[27]将哈密瓜汁于35~55 ℃、10~35 MPa条件下进行超临界CO2杀菌,发现随着温度和压力的升高,大肠杆菌的灭活速率逐步上升;并且在35 MPa條件下处理的大肠杆菌有明显的胞浆泄漏、细胞结构层次感完全消失和部分细胞壁消失的现象。Castillo-Zamudio等[28]在不同压力(15、25、35 MPa)和时间(5、10、15 min)条件下用超临界CO2处理干腌火腿样品,也发现温度的升高显著增加了大肠杆菌的灭活水平(P<0.05)。此外,快速的压力循环也会增加微生物的失活率[7]。
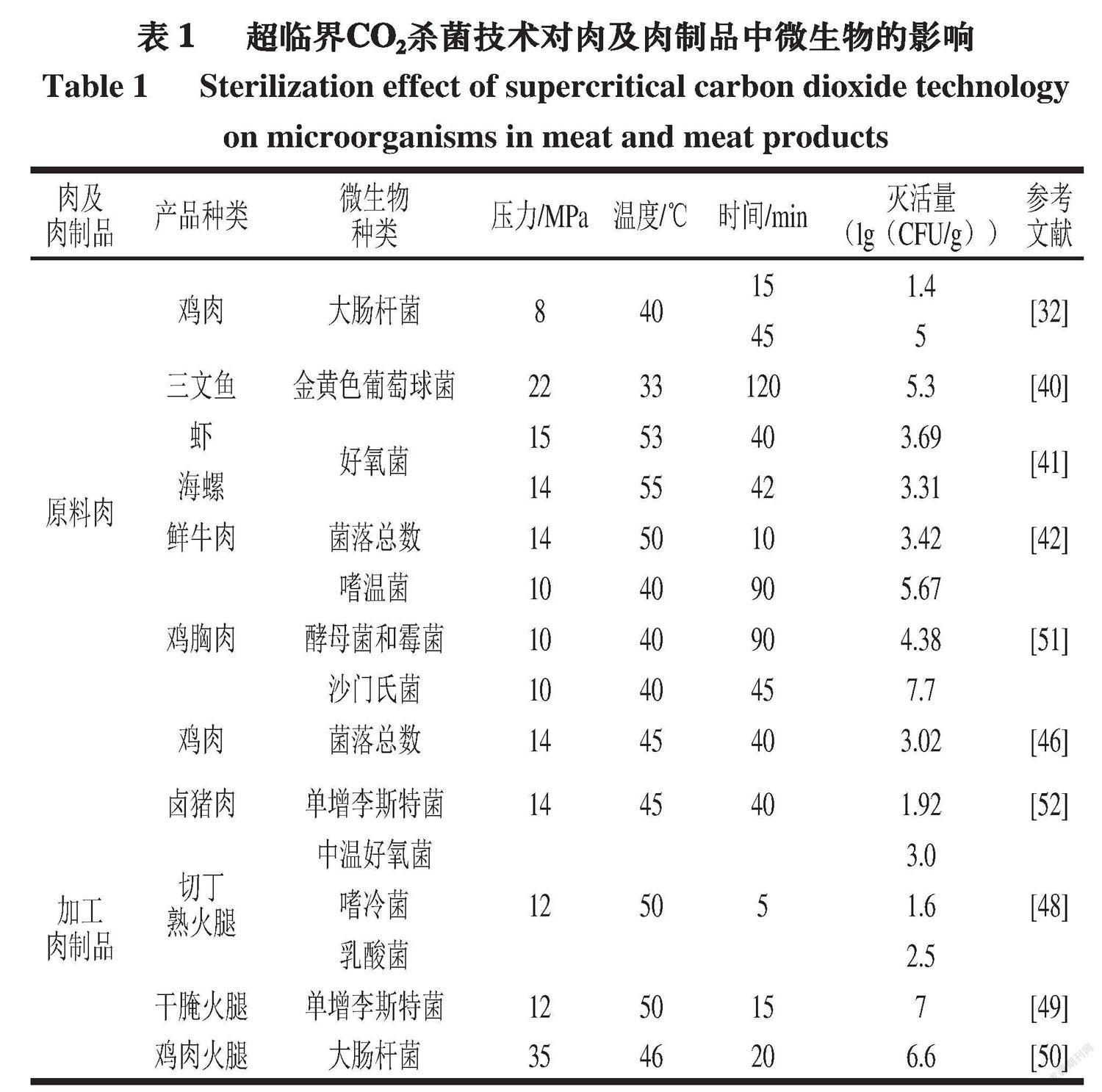
水的存在也极大提高了CO2的杀菌效果,这可能与pH值效应有关。Kamihira等[29]发现,CO2杀菌仅对水分含量70%~90%的细胞有效,而水分含量2%~10%的细胞则具有较强的抗性。Setlow等[30]也发现,干芽孢比湿芽孢具有更强的抗性。除上述参数外,时间、搅拌次数也是影响超临界CO2杀菌效率的关键因素。Silva等[31]用超临界CO2处理接种7(lg(CFU/mL))干酪乳杆菌的苹果汁,发现干酪乳杆菌的失活速率随处理时间的延长而增大,而压力的改变则对其灭活效率没有显著影响。Gonzalez-Alonso等[32]在40 ℃条件下用超临界CO2处理鸡肉,发现微生物灭活与处理时间有很强的相关性,处理15 min后大肠杆菌的减少量可达1.4(lg(CFU/g)),45 min后可达5(lg(CFU/g)),而压力从8 MPa增加到14 MPa对微生物的灭活影响不大。在一定范围内,搅拌次数与微生物失活数量成正比,因为在不进行搅拌的情况下,只有存在于食品表面的细胞直接受到超临界CO2的影响,而其余细胞的失活只能依赖于CO2的扩散作用。
超临界CO2杀菌的有效性在很大程度上还取决于食品的类型,一般液体食品比固体食品的杀菌效率要高,这主要与食品内部CO2的浓度和其他食品成分(如蛋白质和脂肪)的保护作用有关。另外,微生物的不同生长阶段对超临界CO2的抗性也存在差异。例如,大肠杆菌和酿酒酵母随着生长期的延长,对超临界CO2的抗性也越强[33]。总的来说,除了初始细胞数和食物基质的影响外,随着工艺参数(如压力、温度和时间)的增加,微生物失活率也会有所提高。
2 超临界CO2杀菌在肉及肉制品中的应用
传统的热杀菌虽然能有效杀灭肉及肉制品中的有害微生物,但热处理后的肉及肉制品在营养成分、感官品质和风味等方面都会有所下降。许多新兴的非热杀菌技术也会对肉类的食用品质带来不利影响,并且还存在成本过高的问题。例如,高压处理已经用于不同肉制品的低温巴氏杀菌[34],但是它需要非常高的压力条件(>300 MPa)以及高昂的设备投资和运营成本[35]。高电场强度(>20 kV/cm)下的脉冲电场对肉类中的许多腐败微生物和致病菌都有灭活作用,但高强度电场会对肉类的感官和营养品质产生不利影响[36]。Zhuang Hong等[37]发现,非热高压介质阻挡放电对嗜冷菌也有一定的抑制效果,但该处理后的鸡胸肉呈现苍白色,大大降低了鸡胸肉的感官品质。辐照杀菌也可以用于肉类的低温杀菌,但也会引起感官上的不良变化和异味,并且辐照标签有时会受到消费者的抵制[38]。而超临界CO2杀菌技术是一种节能环保的非热杀菌技术,它能够在中等压力(7.3~50.0 MPa)和温度(35~55 ℃)条件下阻止肉及肉制品中病原微生物和腐败微生物的生长[36],其主要是通过CO2的快速扩散来降低肉及肉制品中的微生物水平,并且在灭菌的同时最大限度地保持肉类原本的质地、风味和营养成分。该技术已经用于水产品(如三文鱼、虾和海螺)、牛肉、鸡肉、猪肉和火腿等肉及肉制品中微生物的灭活。此外,超临界CO2杀菌本身就是加工蛋白质类食品的一种有效技术,因为许多食品成分(如游离氨基酸、蛋白质、脂肪、维生素和多糖等)的共价键能够抵抗高压带来的影响[39]。因此,超临界CO2有可能成为提高肉及肉制品中微生物安全性的一种新型加工方式。
2.1 超临界CO2杀菌在生鲜肉中的应用
肉類的腐败变质是由化学反应和微生物污染导致的,特别是肉类的脂肪氧化。超临界CO2能有效抑制微生物繁殖并防止脂肪氧化,因此可用于保存鲜肉制品。研究表明,超临界CO2可以有效杀灭三文鱼中的金黄色葡萄球菌,并且压力是灭活过程中最重要的因素,其最佳实验条件为22.5 MPa,降压速率为10 MPa/min,三文鱼与CO2的质量比为5∶3,在33 ℃下处理2 h[40]。Chen Manhua等[41]用超临界CO2处理虾和海螺,使虾(15 MPa、53 ℃、40 min)和海螺(14 MPa、55 ℃、42 min)中的好氧菌分别减少3.69、3.31(lg(CFU/g))。罗亚兰等[42]采用正交法优化超临界CO2在鲜牛肉中的灭菌条件,结果显示,在14 MPa、50 ℃、灭菌时间为10 min时灭菌效果最优,灭菌率可达99%。在众多生鲜肉中,超临界CO2杀菌技术在鸡肉中的应用最为广泛。在过去几十年中,禽肉的消费量在全球范围内不断增加,并以年均2%的增长率主导市场[43]。但鲜禽肉由于具有较高的pH值,并且在屠宰过程中,胃肠道、肺部、皮肤和羽毛中存在的微生物可以通过多种途径在肌肉组织中定植[44],因此鲜禽肉比猪肉或牛肉更容易腐败。鸡肉是人类饮食中蛋白质的主要来源之一,但其极易受到高温的影响,因为当温度为23~80 ℃时,鸡肉中的可溶性蛋白、肌原纤维蛋白和鸡肉的质量都会减少[45]。超临界CO2处理虽然能最大限度降低鸡肉的蒸煮损失和营养物质的流失,但仍可能会影响鸡肉的感官品质。例如,González-Alonso等[32]在14 MPa、40 ℃、15~45 min的条件下用超临界CO2处理鸡肉,结果显示,与对照组相比,鸡肉的质地变硬,颜色也发生改变。Jauhar等[46]也得到了类似的结果,其中,经14 MPa、45 ℃、40 min的超临界CO2处理后,鸡肉中的菌落总数、酵母菌总数和霉菌总数都有所下降,但在贮藏7 d后,颜色和质地等感官品质也有所下降。Jauhar等[47]在后续的研究中采用更温和的条件(11.4 MPa、31 ℃、10 min),发现处理后鸡肉的质地和颜色有所改善。因此,应用超临界CO2来改善鸡肉的品质需要在较低的温度和压力以及较短的时间条件下进行。
2.2 超临界CO2杀菌在肉制品中的应用
在欧洲国家,干腌火腿是一种获得消费者广泛认可的传统食品。其中,腌制是火腿加工中非常重要的加工环节,能赋予火腿独特的风味,并且还能抑制腐败微生物的生长。随着社会的进步和经济的发展,目前市场的趋势是降低火腿中的盐含量,但这可能会降低火腿的微生物安全性,缩短保质期。而超临界CO2杀菌技术可以在降低火腿中盐含量的同时维持微生物安全性和稳定性。Ferrentino等[48]研究超临界CO2对切丁熟火腿中天然微生物菌群的影响,响应面分析表明,在12 MPa、50 ℃、5 min的条件下,中温好氧菌、嗜冷菌和乳酸菌的减少量分别为3.0、1.6、2.5(lg(CFU/g));酵母菌、霉菌和大肠杆菌则达到了检测限以下水平。Ferrentino等[49]还研究了超临界CO2对接种于干腌火腿表面的单增李斯特菌灭活的可行性,发现在12 MPa、50 ℃、15 min条件下,单增李斯特菌的总失活量为7(lg(CFU/g)),并且该处理对火腿的色泽和感官品质几乎没有影响。Benedito等[50]用超临界CO2处理火鸡火腿时发现,当压力从15 MPa增加到35 MPa(46 ℃)时,大肠杆菌数量减少6.6(lg(CFU/g)),处理时间从30 min减少到20 min,还发现温度显著提高了样品中大肠杆菌的失活率(P<0.05)。
超临界CO2杀菌技术对肉及肉制品中微生物的影响如表1所示。总的来说,肉及肉制品中的水分含量越高,超临界CO2杀菌的效率也就越高。但是,为了开发和利用超临界CO2杀菌生产出高品质的肉及肉制品,还要进一步研究各种微生物在不同肉及肉制品中的失活机制。此外,加工不同肉类所涉及的工艺参数也会存在差异,因此研究不同工艺参数对肉及肉制品中的微生物失活水平、营养成分和感官品质的影响也是十分必要的。
3 超临界CO2与其他技术或添加剂联合杀菌的研究进展
虽然单独使用超临界CO2可以消除食品中的细菌营养细胞,但需要较长的时间才能达到与热处理相似的灭活水平,难以满足企业的生产要求。因此,超临界CO2与其他添加剂或其他非热技术的结合使用是超临界CO2杀菌技术的发展趋势。近年来,有关联合杀菌的研究也显著增多,其中研究最多的是超临界CO2与超声波、香菜精油、迷迭香和PAA的联合使用。
3.1 超临界CO2与超声波联合杀菌的研究进展
超声波是最常与超临界CO2联用的技术,其原理是超声波激发交替的低压和高压液体波,导致真空气泡的形成和破裂,这些气泡会使细菌或酵母菌的细胞壁和细胞膜遭到破坏,从而加速超临界CO2对重要成分的提取以及微生物的死亡[53]。超临界CO2与超声波联用还可以减少灭菌所需的时间。Benedito等[50]发现,在培养基中仅用超临界CO2(35 MPa、36 ℃)处理时,大肠杆菌和酿酒酵母失活量为7~8(lg(CFU/g))需要25~140 min;而使用高功率超声(high power ultrasound,HPU)辅助超临界CO2将2 种微生物完全灭活仅需1~2 min。Castillo-Zamudio等[28]将超临界CO2和HPU联合用于干腌火腿灭菌的最佳条件为35 MPa、51 ℃、5 min,此时大肠杆菌减少3.2(lg(CFU/g)),处理后的干腌火腿脂肪含量显著降低46%(P<0.05),并且在贮藏过程中颜色、质地和pH值均无明显变化。同样,Morbiato等[51]将其应用在鸡胸肉中也得到相似的结果,超临界CO2条件10 MPa、40 ℃、15 min,结果表明,在40 ℃以下就可以达到干燥和灭活全部微生物的效果,并且除VB12外,该产品的营养特性与原料肉相似。另外,由于生理盐水(saline solution,SS)具有较大的表面张力,可使气泡以更大的力量破裂,产生比单独使用超临界CO2更强的空化效应,从而提高微生物的致死率[54]。例如,Castillo-Zamudio等[28]用超临界CO2+HPU+SS作用于干腌火腿,结果显示,超临界CO2+HPU+SS组的灭活率为(2.49±0.20)(lg(CFU/g)),显著高于超临界CO2+HPU组的(1.87±0.20)(lg(CFU/g))(P<0.05)。
3.2 超临界CO2与添加剂联合杀菌的研究进展
香菜精油对细菌的生长有明显抑制效果,其可以有效抑制或杀灭大肠杆菌、金黄色葡萄球菌、黑曲霉、酿酒酵母和沙门氏菌等微生物[55]。同样,迷迭香的主要成分迷迭香酸对革兰氏阴性菌和革兰氏阳性菌都具有较强的抑制作用,还可以抑制金黄色葡萄球菌的生长和生物膜的形成[56]。PAA可以通过改变微生物细胞内的pH值和依靠强氧化使酶失活,从而使微生物死亡[57]。因此,在超临界CO2杀菌过程中加入香菜精油、迷迭香和PAA等化学物质也能极大增强杀菌效果。例如,Gonzalez-Alonso等[32]优化香菜精油的浓度,实现了超临界CO2与香菜精油对鸡肉中大肠杆菌的协同灭活。Huang Shirong等[58]用超临界CO2抑制冷藏猪肉糜中微生物的生长,发现超临界CO2与迷迭香混合处理后的菌落总数略低于单独使用超临界CO2的菌落总数。超临界CO2与PAA也可以联用,并且PAA的浓度对微生物的失活率有显著影响[59]。
4 结 语
超临界CO2杀菌是一种提高肉及肉制品中微生物安全性的新型非热加工技术,不仅破解了传统热杀菌能耗大、污染严重、食品不耐热营养素降解和感官品质下降等问题,而且还能广泛应用于各种肉及肉制品中细菌、真菌和芽孢等微生物的灭活。此外,其较低的工艺温度和压力降低了企业的运行成本和初始投资。因此,超临界CO2杀菌具有很大的发展潜力,对该技术进行深入研究对促进肉及肉制品行业的发展具有深远意义。但是,超临界CO2应用于肉及肉制品中的杀菌大多还处于实验研究阶段,为了该技术在实际生产中广泛应用,未来还需在以下几方面进行研究:1)目前,超临界CO2杀菌技术在食品中的研究和应用主要集中在苹果汁、橙汁和牛乳等液体食品,在肉及肉制品中的应用还相对较少。因此,未来还需更深入的研究来阐明超临界CO2对不同肉及肉制品的感官特性和营养成分的影响,以期完善肉及肉制品的加工工艺,使超临界CO2杀菌技术在肉及肉制品中实现工业化。2)在微生物的机理研究方面,现大多集中在大肠杆菌、单增李斯特菌、沙门氏菌和金黄色葡萄球菌等细菌上,对真菌、芽孢和病毒的研究还较少,其失活机理尚不明确。为了完善超临界CO2在肉及肉制品中的作用机制,研究人员还需进行系统、深入的研究和探讨。3)超临界CO2与其他非热技术或添加剂的联合杀菌是目前非热杀菌中的一大热点,但目前很多研究者仅局限于超临界CO2与超声波的联用研究,这非常不利于非热技术在肉及肉制品中的转化和利用。为了加快超临界CO2杀菌技术的工业化步伐,以及降低企业的投资成本,未来可以加大超临界CO2与精油、壳聚糖和黄酮类等天然抗菌剂联用的研究。
参考文献:
[1] Aminzare M, Hashemi M, Azar H H, et al. The use of herbal extracts and essential oils as a potential antimicrobial in meat and meat products: a review[J]. Journal of Human, Environment, and Health Promotion, 2016, 2(1): 63-74. DOI:10.29252/jhehp.1.2.63.
[2] Chmiel M, Roszko M, Ha?-Szymańczuk E, et al. Time evolution of microbiological quality and content of volatile compounds in chicken fillets packed using various techniques and stored under different conditions[J]. Poultry Science, 2020, 99(2): 1107-1116. DOI:10.1016/j.psj.2019.10.045.
[3] XIONG Qiang, ZHANG Muhan, WANG Ting, et al. Lipid oxidation induced by heating in chicken meat and the relationship with oxidants and antioxidant enzymes activities[J]. Poultry Science, 2020, 99(3): 1761-1767. DOI:10.1016/j.psj.2019.11.013.
[4] 劉延青. 灵芝子实体生物活性成分的分析及口服液开发[D]. 泰安: 山东农业大学, 2021: 7-8. DOI:10.27277/d.cnki.gsdnu.2021.000198.
[5] Wrona O, Rafińska K, Mo?eński C, et al. Optimization and upscaling of the supercritical carbon dioxide extraction of Solidago gigantea Ait. of an industrial relevance[J]. Industrial Crops and Products, 2019, 142: 111787. DOI:10.1016/j.indcrop.2019.111787.
[6] Silva E K, Meireles M A A, Salda?a M D A. Supercritical carbon dioxide technology: a promising technique for the non-thermal processing of freshly fruit and vegetable juices[J]. Trends in Food Science and Technology, 2020, 97: 381-390. DOI:10.1016/j.tifs.2020.01.025.
[7] Perrut M. Sterilization and virus inactivation by supercritical fluids (a review)[J]. The Journal of Supercritical Fluids, 2012, 66: 359-371. DOI:10.1016/j.supflu.2011.07.007.
[8] XU Feiyue, FENG Xiaomei, SUI Xiao, et al. Inactivation mechanism of Vibrio parahaemolyticus via supercritical carbon dioxide treatment[J]. Food Research International, 2017, 100: 282-288. DOI:10.1016/j.foodres.2017.08.038.
[9] CHEN Yuanyao, Temelli F, G?nzle M G. Mechanisms of inactivation of dry Escherichia coli by high-pressure carbon dioxide[J]. Applied and Environmental Microbiology, 2017, 83(10): 1-13. DOI:10.1128/AEM.00062-17.
[10] Soares G C, Learmonth D A, Vallejo M C, et al. Supercritical CO2 technology: the next standard sterilization technique?[J]. Materials Science and Engineering C: Materials for Biological Applications, 2019, 99: 520-540. DOI:10.1016/j.msec.2019.01.121.
[11] Garcia-Gonzalez L, Geeraerd A H, Elst K, et al. Influence of type of microorganism, food ingredients and food properties on high-pressure carbon dioxide inactivation of microorganisms[J]. International Journal of Food Microbiology, 2009, 129(3): 253-263. DOI:10.1016/j.ijfoodmicro.2008.12.005.
[12] Vo H T, Imai T, Ho T T, et al. Inactivation effect of pressurized carbon dioxide on bacteriophage Qβ and ΦX174 as a novel disinfectant for water treatment[J]. Journal of Environmental Sciences, 2014, 26(6): 1301-1306. DOI:10.1016/S1001-0742(13)60603-8.
[13] 孫睿. 花椒籽油的制备及α-亚麻酸的纯化技术研究[D]. 成都: 成都大学, 2020: 6-8. DOI:10.27917/d.cnki.gcxdy.2020.000079.
[14] 钱静亚, 张咪, 孙文敬, 等. 蛋白质组学在食品非热杀菌中的应用研究进展[J]. 食品科学, 2020, 41(3): 288-294. DOI:10.7506/spkx1002-6630-20190120-240.
[15] Spilimbergo S, Dehghani F, Bertucco A, et al. Inactivation of bacteria and spores by pulse electric field and high pressure CO2 at low temperature[J]. Biotechnology and Bioengineering, 2003, 82(1): 118-125. DOI:10.1002/bit.10554.
[16] LIN Hongmei, CAO Nengjie, CHEN Linfeng. Antimicrobial effect of pressurized carbon dioxide on Listeria monocytogenes[J]. Food Science, 1994, 59(3): 657-659. DOI:10.1111/j.1365-2621.1994.tb05587.x.
[17] WAN Rui, CHEN Yinguang, ZHENG Xiong, et al. Effect of CO2 on microbial denitrification via inhibiting electron transport and consumption[J]. Environmental Science and Technology, 2016, 50(18): 9915-9922. DOI:10.1021/acs.est.5b05850.
[18] 吕懿超, 李香澳, 王凯博, 等. 乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J]. 食品科学, 2021, 42(19): 281-290. DOI:10.7506/spkx1002-6630-20200620-279.
[19] 赵玉芳, 许飞跃, 韩玉谦. 超临界CO2对副溶血性弧菌杀菌机理的研究[C]//第十二届全国超临界流体技术学术及应用研讨会暨第五届海峡两岸超临界流体技术研讨会. 大连: 中国化工学会超临界流体技术专业委员会, 2018: 1.
[20] YAO Chunyan, LI Xiaodong, BI Weiwei, et al. Relationship between membrane damage, leakage of intracellular compounds and inactivation of Escherichia coli treated by pressurized CO2[J]. Journal of Basic Microbiology, 2014, 54(8): 858-865. DOI:10.1002/jobm.201200640.
[21] LIN Hongmei, YANG Zhanying, CHEN Linfeng. Inactivation of Leuconostoc dextranicum with carbon dioxide under pressure[J]. The Chemical Engineering Journal, 1993, 52(1): 29-34. DOI:10.1016/0300-9467(93)80047-R.
[22] RAO Lei, WANG Yongtao, CHEN Fang, et al. The synergistic effect of high pressure CO2 and nisin on inactivation of Bacillus subtilis spores in aqueous solutions[J]. Frontiers in Microbiology, 2016, 7: 1-7. DOI:10.3389/fmicb.2016.01507.
[23] Park H S, Choi H J, Kim K H. Effect of supercritical CO2 modified with water cosolvent on the sterilization of fungal spore-contaminated barley seeds and the germination of barley seeds[J]. Journal of Food Safety, 2013, 33(1): 94-101. DOI:10.1111/jfs.12027.
[24] RAO Lei, BI Xiufang, ZHAO Fang, et al. Effect of high-pressure CO2 processing on bacterial spores[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(11): 1808-1825. DOI:10.1080/10408398.2013.787385.
[25] RAO Lei, WANG Yongtao, CHEN Fang, et al. High pressure CO2 reduces the wet heat resistance of Bacillus subtilis spores by perturbing the inner membrane[J]. Innovative Food Science and Emerging Technologies, 2020, 60: 102291. DOI:10.1016/j.ifset.2020.102291.
[26] WANG Weixin, RAO Lei, WU Xiaomeng, et al. Supercritical carbon dioxide applications in food processing[J]. Food Engineering Reviews, 2021, 13(1): 1-22. DOI:10.1007/s12393-020-09270-9.
[27] 侯思涵, 陳计峦, 裴龙英, 等. 超临界CO2对哈密瓜汁中大肠杆菌的杀灭效果研究[J]. 保鲜与加工, 2020, 20(4): 93-97.
[28] Castillo-Zamudio R I, Paniagua-Martínez I, Ortu?o-Cases C, et al. Use of high-power ultrasound combined with supercritical fluids for microbial inactivation in dry-cured ham[J]. Innovative Food Science and Emerging Technologies, 2021, 67: 102557. DOI:10.1016/j.ifset.2020.102557.
[29] Kamihira M, Taniguchi M, Kobayashi T. Sterilization of microorganisms with supercritical carbon dioxide[J]. Agricultural and Biological Chemistry, 1987, 51(2): 7-12. DOI:10.1080/00021369.1987.10868053.
[30] Setlow B, Korza G, Blatt K M S, et al. Mechanism of Bacillus subtilis spore inactivation by and resistance to supercritical CO2 plus peracetic acid[J]. Journal of Applied Microbiology, 2016, 120(1): 57-69. DOI:10.1111/jam.12995.
[31] Silva E K, Alvarenga V O, Bargas M A, et al. Non-thermal microbial inactivation by using supercritical carbon dioxide: synergic effect of process parameters[J]. The Journal of Supercritical Fluids, 2018, 139: 97-104. DOI:10.1016/j.supflu.2018.05.013.
[32] Gonzalez-Alonso V, Cappelletti M, Bertolini F M, et al. Research note: microbial inactivation of raw chicken meat by supercritical carbon dioxide treatment alone and in combination with fresh culinary herbs[J]. Poultry Science, 2020, 99(1): 536-545. DOI:10.3382/ps/pez563.
[33] Ortu?o C, Martínez-Pastor M T, Mulet A, et al. Supercritical carbon dioxide inactivation of Escherichia coli and Saccharomyces cerevisiae in different growth stages[J]. The Journal of Supercritical Fluids, 2012, 63: 8-15. DOI:10.1016/j.supflu.2011.12.022.
[34] Hygreeva D, Pandey M C. Novel approaches in improving the quality and safety aspects of processed meat products through high pressure processing technology: a review[J]. Trends in Food Science and Technology, 2016, 54: 175-185. DOI:10.1016/j.tifs.2016.06.002.
[35] Picart-Palmade L, Cunault C, Chevalier-Lucia D, et al. Potentialities and limits of some non-thermal technologies to improve sustainability of food processing[J]. Frontiers in Nutrition, 2019, 5: 1-14. DOI:10.3389/fnut.2018.00130.
[36] Bhat Z F, Morton J D, Mason S L, et al. Current and future prospects for the use of pulsed electric field in the meat industry[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(10): 1660-1674. DOI:10.1080/10408398.2018.1425825.
[37] Zhuang Hong, Rothrock M J, Hiett K L, et al. In-package antimicrobial treatment of chicken breast meat with high voltage dielectric barrier discharge-electric voltage effect[J]. Journal of Applied Poultry Research, 2019, 28(4): 801-807. DOI:10.3382/japr/pfz036.
[38] Kawasaki S, Saito M, Mochida M, et al. Inactivation of Escherichia coli O157 and Salmonella enteritidis in raw beef liver by gamma irradiation[J]. Food Microbiology, 2019, 78: 110-113. DOI:10.1016/j.fm.2018.10.011.
[39] Taher H, Al-Zuhair S, AlMarzouqui A, et al. Extracted fat from lamb meat by supercritical CO2 as feedstock for biodiesel production[J]. Biochemical Engineering Journal, 2011, 55(1): 23-31. DOI:10.1016/j.bej.2011.03.003.
[40] CUPPINI M, ZENI J, BARBOSA J, et al. Inactivation of Staphylococcus aureus in raw salmon with supercritical CO2 using experimental design[J]. Food Science and Technology, 2016, 36(Suppl 1): 8-11. DOI:10.1590/1678-457x.0038.
[41] CHEN Muahua, SUI Xiao, MA Xixiu, et al. Application of response surface methodology to optimise microbial inactivation of shrimp and conch by supercritical carbon dioxide[J]. Journal of the Science of Food and Agriculture, 2015, 95(5): 1016-1023. DOI:10.1002/jsfa.6783.
[42] 罗亚兰, 张玉斌, 余群力, 等. 超临界CO2处理对鲜牛肉灭菌效果及食用品质的影响[J]. 食品工業科技, 2017, 38(4): 236-241. DOI:10.13386/j.issn1002-0306.2017.04.036.
[43] OECD-FAO. OECD-FAO agricultural outlook 2015[R]. Paris: Organisation for Economic Co-operation and Development, 2015: 1.
[44] Rouger A, Tresse O, Zagorec M. Bacterial contaminants of poultry meat: sources, species, and dynamics[J]. Microorganisms, 2017, 5(3): 50. DOI:10.3390/microorganisms5030050.
[45] Murphy R Y, Marks B P. Effect of meat temperature on proteins, texture, and cook loss for ground chicken breast patties[J]. Poultry Science, 2000, 79(1): 99-104. DOI:10.1093/ps/79.1.99.
[46] JAUHAR S, ISMAIL-FITRY M R, CHONG G H, et al. Application of supercritical carbon dioxide (SC-CO2) on the microbial and physicochemical quality of fresh chicken meat stored at chilling temperature[J]. International Food Research Journal, 2020, 27(1): 103-110.
[47] Jauhar S, Ismail-Fitry M R, Chong G H, et al. Different pressures, low temperature, and short-duration supercritical carbon dioxide treatments: microbiological, physicochemical, microstructural, and sensorial attributes of chill-stored chicken meat[J]. Applied Sciences, 2020, 10(19): 6629. DOI:10.3390/app10196629.
[48] Ferrentino G, Balzan S, Spilimbergo S. Optimization of supercritical carbon dioxide treatment for the inactivation of the natural microbial flora in cubed cooked ham[J]. International Journal of Food Microbiology, 2013, 161(3): 189-196. DOI:10.1016/j.ijfoodmicro.2012.12.004.
[49] Ferrentino G, Balzan S, Spilimbergo S. Supercritical carbon dioxide processing of dry cured ham spiked with Listeria monocytogenes: inactivation kinetics, color, and sensory evaluations[J]. Food and Bioprocess Technology, 2013, 6(5): 1164-1174. DOI:10.1007/s11947-012-0819-4.
[50] Benedito J, Ortu?o C, Castillo-Zamudio R I, et al. Microbial inactivation by ultrasound assisted supercritical fluids[J]. Physics Procedia, 2015, 70: 824-827. DOI:10.1016/j.phpro.2015.08.168.
[51] Morbiato G, Zambon A, Toffoletto M, et al. Supercritical carbon dioxide combined with high power ultrasound as innovate drying process for chicken breast[J]. The Journal of Supercritical Fluids, 2019, 147: 24-32. DOI:10.1016/j.supflu.2019.02.004.
[52] Choi Y M, Bae Y Y, Kim K H, et al. Effects of supercritical carbon dioxide treatment against generic Escherichia coli, Listeria monocytogenes, Salmonella typhimurium, and E. coli O157:H7 in marinades and marinated pork[J]. Meat Science, 2009, 82(4): 419-424. DOI:10.1016/j.meatsci.2009.02.016.
[53] Koubaa M, Mhemdi H, Fages J. Recovery of valuable components and inactivating microorganisms in the agro-food industry with ultrasound-assisted supercritical fluid technology[J]. The Journal of Supercritical Fluids, 2018, 134: 71-79. DOI:10.1016/j.supflu.2017.12.012.
[54] Martínez-Ramos T, Benedito-Fort J, Watson N J, et al. Effect of solvent composition and its interaction with ultrasonic energy on the ultrasound-assisted extraction of phenolic compounds from mango peels (Mangifera indica L.)[J]. Food and Bioproducts Processing, 2020, 122: 41-54. DOI:10.1016/j.fbp.2020.03.011.
[55] 刘艳红, 张莲莲, 陈云, 等. 香菜的有效成分提取、功能及应用研究进展[J]. 中国调味品, 2021, 46(5): 179-184.
[56] 李兆亭. 迷迭香提取物对单增李斯特菌抑菌机理及在冷鲜肉中的应用研究[D]. 海口: 海南大学, 2019: 4-5. DOI:10.27073/d.cnki.ghadu.2019.000987.
[57] 肖琳. 解糖类芽孢杆菌的鉴定及杀灭实验[D]. 广州: 华南理工大学, 2020: 5-7. DOI:10.27151/d.cnki.ghnlu.2020.003943.
[58] HUANG Shirong, LIU Bin, GE Du, et al. Effect of combined treatment with supercritical CO2 and rosemary on microbiological and physicochemical properties of ground pork stored at 4 ℃[J]. Meat Science, 2017, 125: 114-120. DOI:10.1016/j.meatsci.2016.11.022.
[59] Sikin A M, Walkling-Ribeiro M, Rizvi S S H. Synergistic effect of supercritical carbon dioxide and peracetic acid on microbial inactivation in shredded Mozzarella-type cheese and its storage stability at ambient temperature[J]. Food Control, 2016, 70: 174-182. DOI:10.1016/j.foodcont.2016.05.050.
收稿日期:2021-09-24
基金项目:四川白兔优良种质资源扩繁与健康养殖技术示范推广项目(2020JDZH0029);
国家现代农业产业技术体系建设专项(CARS-43-E-2);
重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
第一作者简介:柴利(1994—)(ORCID: 0000-0002-7478-2039),女,硕士研究生,研究方向为肉类科学与酶工程。
E-mail: 191730344@qq.com
通信作者简介:李洪军(1961—)(ORCID: 0000-0002-6835-1822),男,教授,博士,研究方向為肉类科学与酶工程。
E-mail: 983362225@qq.com

