NaCl胁迫处理对苦荞麦芽营养物质含量的影响
蒋变玲,许雪华,尹 琮,陈 琼,韩方凯,徐礼生,段 红
(宿州学院 生物与食品工程学院,安徽 宿州 234000)
现代社会工业化的迅速发展导致生态环境越来越脆弱,尤其在发展中国家,耕地的过渡开垦与集约化经营致使土地盐碱化已成为主要生态环境问题之一,也是影响农作物生长的主要原因之一[1]。目前对于盐胁迫的研究主要集中在盐胁迫条件下植物形态变化、生理生化变化、细胞结构的变化以及耐盐机制等方面[2],而对农作物营养成分含量方面影响的研究则较少,因此研究盐胁迫对于农作物因盐胁迫导致的代谢的紊乱、营养元素的改变十分必要。
苦荞麦又称野南荞、万年荞等,为蓼科荞麦属,味苦性平,营养物质含量丰富,且在我国分布广泛[3];苦荞麦作为药食同源的食物之一,是重要的食品原料。
大量研究表明,萌发能够改善可食性种子中生物活性物质的含量,提高其营养价值[4-8]。苦荞麦籽粒中含有胰蛋白酶抑制剂等抗营养因子,使其较高含量的蛋白质难以被人体消化吸收[9]。萌发可使苦荞麦种子中的蛋白酶抑制剂含量逐渐降低甚至消失,且能够产生易于吸收的氨基酸和脂肪酸[10],从而提高蛋白质的消化吸收率。此外,苦荞麦萌发过程中的蛋白质具有较好的胆酸盐吸附能力,进而促进胆固醇代谢[11]。萌发还可使苦荞中的维生素C、γ-氨基丁酸、D-手性肌醇的含量均有显著增加[12],苦荞麦芽中生物活性成分含量高于苦荞麦籽粒[13]。
目前对于苦荞麦的抗胁迫研究,主要集中在干旱胁迫和盐胁迫方向上[14,15],而对于盐胁迫的苦荞麦芽营养成分的变化则鲜有报道,本实验研究胁迫处理苦荞麦中营养成分变化的影响,为合理利用改良后盐碱地来培育苦荞麦,提高苦荞麦综合价值具有重要意义。
1 材料与方法
1.1 实验仪器与材料
芦丁标准品(色谱纯,上海源叶生物科技有限公司);考马斯亮蓝G-250溶液(AR)、无水葡萄糖(AR)、抗坏血酸(AR)、2,6-二氯靛酚、牛血清白蛋白等(均为国药集团化学试剂有限公司)。
JA5003B型分析天平;UV-5100型紫外可见分光光度计;SX2-4-10高温灰化炉等。
1.2 原材料制备
种子预处理:清水洗净种子表面灰尘→1%H2O2溶液浸泡5min→清水冲洗残留液→25℃蒸馏水泡4h(期间换水一次)→50℃温水中催芽15min→滤纸上沥干水分。
种子萌发处理:将沥干水的种子平铺于放有双层滤纸的培养皿中(50粒/皿),每处理组分别含0、10、20、40、60、80mM NaCl的1/2霍格兰溶液,将种子半浸没,在室温黑暗环境中(湿度75±5%)分别培养2d、4d、6d、8d、10d、12d后采收,期间每天更换培养液一次,采收的苦荞麦芽去壳洗净液氮冷冻后,装于贴好标签的密封袋,置于-80℃冰箱中,留存备用。
1.3 实验方法
1.3.1 黄酮含量的测定
参照万燕等[16]的方法,稍做改进,制备苦荞麦芽待测液。
芦丁标准曲线的绘制和黄酮含量的测定参照张迪等[17]的方法。
总黄酮含量(mg/g)=X×25×V/M
式中:X为测定的质量浓度,mg/mL;V为提取液的总体积,mL;M为样品质量,g;25为测定时定容的体积,mL。
1.3.2 蛋白质含量测定
采用张英强等[18]和Zhuanhua Wang等[19]方法稍加改进,制备蛋白质待测液。
标准曲线的绘制参考杨静华[20]方法。本文所得标准曲线为Y(吸光度值)=0.0063X+0.0613。
X:(蛋白质浓度,μg/mL)
样液测定:准确吸取待测0.2mL,补蒸馏水至1mL,加入5mL考马斯亮蓝染液,混合均匀,于595nm处测量吸光值,计算样品蛋白质的含量。
1.3.3 还原糖含量测定
依照杨泉女等[21]的方法制作还原糖提取液和葡萄糖标准曲线。
标准曲线绘制和样品还原糖测定:本研究所得标准曲线为Y(吸光度值)=0.9085X(葡萄糖质量,μg/mg)-0.1163。
加入待测液1.0mL,按照标准曲线的操作步骤,根据下列公式计算得到试样中还原糖的含量,表示为mg葡萄糖当量/g(mg GE/g)。
还原糖(mg GE/g)=m×V/(M×1)
m—样品中还原糖的质量,mg
V—定容总体积,mL
M—样品质量,g
1—测定时吸取的待测液的体积,mL
1.3.4 Vc含量的测定
样品Vc含量测定:参考李姝晋等[22]的方法。
1.3.5 灰分含量测定
样品灰分测定:按照GB 5009.4-2016[23]。
2 结果与讨论
2.1 盐胁迫对苦荞麦芽中总黄酮含量的影响
由图1可知,不同浓度盐胁迫处理的苦荞麦芽总黄酮的积累模式不同。除萌发2天的40mM NaCl处理组、萌发12天的10mM NaCl和20mM NaCl处理组,其余NaCl胁迫处理的苦荞麦芽总黄酮含量均高于或显著高于对照组(无胁迫处理)。除20mM和40mM NaCl胁迫处理组,其余处理组的总黄酮含量在第6天均显著呈现出一个积累低谷(p<0.05)。对照组总黄酮含量在萌发的前期(2~6d)显著下降(p<0.05),第6~8天含量上升,之后缓慢下降;10mM和40mM NaCl处理组总黄酮变化趋势相似且呈波动式降低;20mM NaCl处理组的总黄酮含量萌发的前期(2~10d)下降缓慢,第10天开始迅速下降;60mM NaCl处理组的苦荞麦芽总黄酮含量变化呈稳定波动状态;而80mM NaCl处理组的苦荞麦芽总黄酮呈倒U型积累模式,前期缓慢上升后期缓慢下降。万世杰[24]研究表明,一定浓度的盐溶液处理胀果甘草子叶受伤组织时能在一定程度促进黄酮含量的形成,并发现有一个恰当的盐溶液浓度是受伤组织正常生长的限定值;当盐溶液浓度低于该值时,受伤组织可通过改善自身的非对称压以提高自身的耐盐性;而当盐浓度高于该值时,由于存在一定的浓度差,造成细胞脱水,使其生长受到阻碍。而类黄酮具有较强的抗氧化能力,在一定的逆境胁迫下,植物可以调节体内抗氧化物质(如类黄酮)含量来减轻或消除由各种胁迫带来的活性氧损伤,这是大多数植物抵抗逆境的有效方式之一,盐胁迫可以通过类似的途径影响苦荞麦芽黄酮的合成。
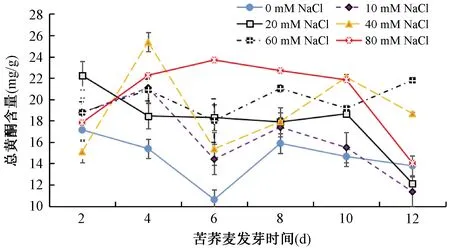
图1 盐胁迫对苦荞麦芽中总黄酮含量的影响
2.2 盐胁迫对苦荞麦芽中蛋白质含量的影响
由图2可知,随着时间的增长,各处理组中苦荞麦芽蛋白质含量总体上呈下降趋势。20mM NaCl处理组的苦荞麦芽蛋白质含量呈缓慢下降趋势;其余处理组蛋白质在苦荞麦芽在萌发2~6天下降显著(p<0.05);对照组、10mM、20mM和40mM NaCl处理组在苦荞麦芽萌发4天后,蛋白质含量变化较小;60mM和80mM NaCl处理组的苦荞麦芽蛋白质含量在萌发6天后随萌发时间的变化较小或变化不显著(p<0.05)。60mM和80mM NaCl胁迫处理2~4天可显著提高或保存苦荞麦芽中蛋白质的含量。盐胁迫发生时,植物会表现出其独特的耐盐生理机制如蛋白质积累等,从而抵抗盐离子带来的危害,低、中浓度钠盐胁迫能够提高植物叶片中渗透调节物质(蛋白质和可溶性糖)的含量[25]。
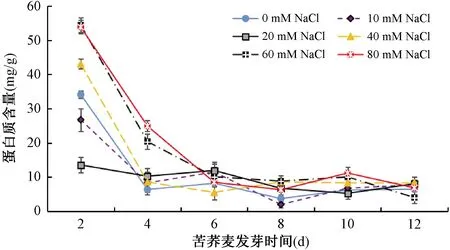
图2 盐胁迫对苦荞麦芽中蛋白质含量的影响
2.3 盐胁迫对苦荞麦芽中还原糖含量的影响
盐胁迫对苦荞麦芽中总还原糖含量的影响如图3所示,对照组和80mM NaCl胁迫处理组的苦荞麦芽总还原糖含量先增高后下降,并在萌发第4天出现还原糖积累峰值,其他时间苦荞麦芽胁迫处理组还原糖含量无显著区别。10mM NaCl处理组的苦荞麦芽总还原糖含量呈缓慢下降后又缓慢上升趋势;萌发时间对20mM NaCl处理组总还原糖含量的影响无统计学意义(p>0.05);40mM和60mM NaCl处理组总还原糖含量变化较为平缓。10mM NaCl处理第2天、20mM NaCl处理第10天、60mM NaCl处理第6和第8天处理组的总还原糖含量显著高于空白组,其余处理组的还原糖含量对比空白组均无显著优势(p>0.05)。问雪丛等[26]发现虎尾草随着盐胁迫时间和胁迫强度的增加,可溶性糖含量显著增加。本研究结果与其报道不一致,推测苦荞麦有着不同抗盐胁迫的途径。
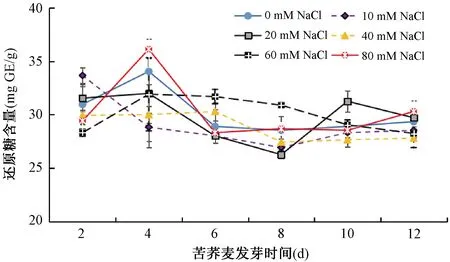
图3 盐胁迫对苦荞麦芽中总还原糖含量的影响
2.4 盐胁迫对苦荞麦芽中Vc含量的影响
盐胁迫对苦荞麦芽中Vc含量的影响如图4所示,随发芽时间的延长各处理组Vc含量总体上呈上升趋势。60mM NaCl处理组和80mM NaCl处理组的苦荞麦芽Vc含量呈缓慢上升趋势;空白对照组的Vc含量在2~12天随发芽时间的延长而显著上升(p<0.05),20mM和40mM NaCl处理组的Vc积累模式较为相似,在萌发第10天有一个积累峰。10mM NaCl处理组的Vc含量在萌发2~10天时间段里均显著高于对照组(p<0.05);其余胁迫处理组的Vc含量均低于或显著低于对照组(4~12天),这表明适宜低浓度盐胁迫对荞麦芽中Vc的产生具有促进作用。王新伟等[27]发现,当植株处于一定的逆境胁迫时能通过Vc的生成降低过氧化损伤,从而提高植株抗逆性。
2.5 盐胁迫对苦荞麦芽中灰分含量的影响
盐胁迫对苦荞麦芽灰分含量的影响如图5所示,随发芽时间的延长灰分总体上呈下降趋势。在萌发第4天,除20mM和40mM NaCl胁迫处理组,其余胁迫处理组的灰分均显著高于对照组;在萌发4~12天,各胁迫处理组(20mM NaCl除外)的灰分均显著高于对照组(p<0.05)。毛桂莲等[28]研究表明,适当浓度的盐胁迫能增加特定时段内植株体内的矿物质元素(灰分的含量)以应对胁迫。
3 结论
本研究结果表明,不同程度的NaCl胁迫对于苦荞麦芽中的不同成分如黄酮、蛋白质、还原糖、Vc、灰分含量的影响不同。因此适当控制苦荞麦生长环境中的NaCl浓度,可获得特定营养成分含量较高的苦荞麦芽,从而提高苦荞麦芽的综合利用价值。

