血培养联合PCT、hs-CRP 在新生儿败血症诊断中的应用
宋春雁
新生儿败血症是细菌或真菌侵入血循环中繁殖生长、产生毒素所致的全身性感染,疾病症状不典型。临床工作中发现,新生儿败血症发病率一直较高,且具有较高的病死率[1]。所以,需要积极进行诊断、治疗。关于新生儿败血症既往主要采取血培养,但耗时长、敏感性低,增加了疾病误诊、漏诊风险,耽误患儿最佳治疗时机[2]。近年来,分子生物学、免疫学等技术的迅速发展,广泛用于各类疾病诊断中,诊断价值理想,提高了疾病的确诊率,有助于临床治疗工作的开展[3]。结合诊断经验,新生儿败血症采取CRP、PCT、血培养联合诊断具有较高的敏感性、特异度,提高了诊断的准确率。
1 资料与方法
1.1 一般资料 选取2019 年7 月~2020 年6 月收治的50 例新生儿败血症患儿作为观察组,其中急性期30 例、缓解期 20 例。另选取同期的50 例健康新生儿作为对照组。观察组:男30 例、女20 例;胎龄36~41 周,平均胎龄(38.50±1.50)周;体质量2200~3930 g,平均体质量(3050.50±350.50)g。对照组:男28 例、女22 例;胎龄37~41 周,平均胎龄(38.80±1.30)周;体质量2250~3950 g,平均体质量(3030.50±320.50)g。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。观察组患儿符合《新生儿败血症诊疗方案》的诊断标准。
纳入标准:医院伦理委员会批准;监护人知情同意参与;临床资料完整。排除标准:合并急性疾病患儿;严重心脑血管病患儿;自身免疫病患儿。
1.2 方法 清晨抽取空腹静脉血5 ml,分离血清后立即送检,PCT 检测使用E411 电化学发光仪器,CRP检测采用日立7180 自动检测仪,血培养采用梅里埃Compact120 细菌鉴定仪。
1.3 阳性标准 PCT≥0.5 ng/ml,CRP≥8 mg/L,血培养标本培养出条件致病菌、导管头培养同种细菌[4]。
1.4 统计学方法 采用SPSS19.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组PCT、CRP 水平比较 观察组急性期、缓解期PCT、CRP 水平均高于对照组,差异有统计学意义(P<0.05)。观察组急性期PCT、CRP 水平均高于缓解期,差异有统计学意义(P<0.05)。见表1。
表1 两组PCT、CRP 水平比较()

表1 两组PCT、CRP 水平比较()
注:与对照组比较,aP<0.05;与缓解期比较,bP<0.05
2.2 两组PCT、CRP、血培养及联合检测阳性率比较观察组PCT、CRP、血培养阳性率以及联合检验阳性率均高于对照组,联合检验阳性率高于单一检验,差异有统计学意义(P<0.05)。见表2。
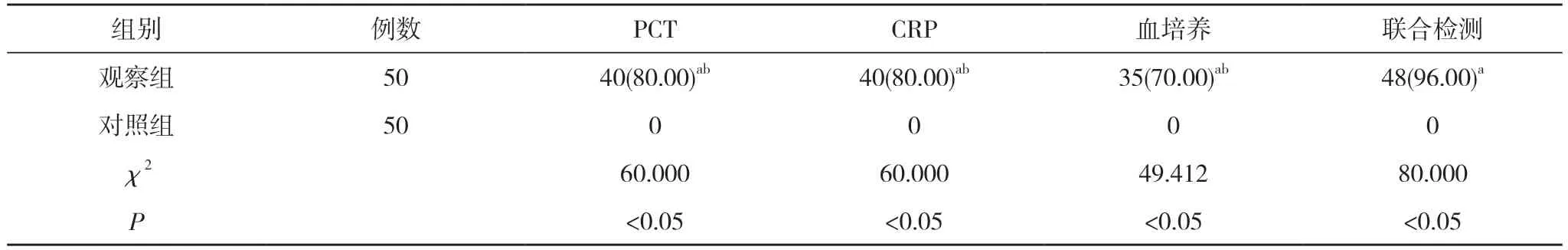
表2 两组PCT、CRP、血培养及联合检测阳性率比较[n(%)]
3 讨论
新生儿败血症一直具有较高的发病率、死亡率,严重影响患儿的身体健康、成长发育,需积极诊断、尽早合理治疗,以提升新生儿的安全性[5]。血培养是诊断新生儿败血症的传统方法,但是检验用时较长,且早期诊断的误诊或漏诊风险也较高[6]。所以,为了提升疾病的检验准确率,主张联合检验手段[7]。血清CRP 是急性时相反应蛋白,炎症因子刺激下由肝脏产生,健康新生儿血清中含量低,但感染性疾病中水平非常高[8]。PCT 是糖蛋白,正常情况下极少释放到新生儿血液中,但感染性疾病中 PCT 水平较高[9]。所以,新生儿败血症无论是CRP 还是PCT 水平均较高,可作为疾病的诊断指标[10]。当然,任何单一指标检测新生儿败血症的诊断都有局限性,联合检测成功提高了检测的敏感性以及准确性[11]。萧翡音[12]研究指出,血清PCT、hs-CRP 检测结果是新生儿败血症诊断的重要指标,联合检测情况下可以提高新生儿败血症检出率,有助于临床早期工作的有效开展,促进新生儿治疗预后。
本文结果显示:观察组急性期、缓解期PCT、CRP水平均高于对照组,差异有统计学意义(P<0.05)。观察组急性期PCT(8.55±3.20)ng/ml、CRP(14.50±4.50)mg/L水平均高于缓解期的(0.52±0.12)ng/ml、(3.75±1.50)mg/L,差异有统计学意义(P<0.05)。观察组PCT、CRP、血培养阳性率以及联合检验阳性率均高于对照组,联合检验阳性率高于单一检验,差异有统计学意义(P<0.05)。
综上所述,PCT、hs-CRP、血培养检测诊断新生儿败血症价值理想,提高了疾病的检出效率,促进早期治疗、提升预后。

