分泌型磷蛋白1对肝癌患者预后及分级辅助诊断的价值
鞠东玲,侯雯莉,王振国,侯世科,胡金朋
(1.武警特色医学中心 军人全科医学科,天津 300162;2.武警特色医学中心 研究部,天津 300162)
肝癌是全球最常见的癌症死亡原因,我国肿瘤登记数据显示肝癌在恶性肿瘤发病中位列第4位,死亡中位列第2位[1-2]。癌症的本质是基因突变,每种类型的癌症都有许多独特的表观遗传和遗传变异[3]。探索肿瘤发展过程及癌症表达谱,为了解疾病的分子基础以用于患者的潜在诊断和治疗靶标提供宝贵见解[4]。分泌的磷蛋白1(SPP1),也称为骨桥蛋白(OPN),是一种整合素结合蛋白,可从各种类型的细胞(包括巨噬细胞,内皮细胞和破骨细胞)中分泌出来。在人类中,SPP1由6个内含子和7个外显子组成,并编码在4号染色体(4q13)上[5]。 SPP1涉及多个生理和病理过程。最近的研究报道,SPP1与肿瘤生长、粘附和侵袭显著相关,并且在肺癌[6]、结肠癌[7]、乳腺癌[8]、前列腺癌[9]、胰腺癌[10]和肝细胞肝癌[11]中过表达。SPP1的表达水平与肿瘤的分期和恶性程度相关,这表明SPP1可能是几种癌症的诊断和预后生物标志物。
1 资料与方法
1.1 一般资料及生存曲线比较 从包含TCGA数据网站(http://www.linkedomics.org)下载肝癌患者数据集TCGA_LIHC RNASeq和TCGA_LIHC Clinical,筛选出同时包含生存时间数据信息和CXCR4基因表达数据的患者共343例,比较基因表达水平与年龄、种族及放疗状况的相关性。按照SPP1表达水平由低到高排序,将排在前50%的172例患者设为高表达组,年龄(57.96±13.76)岁,剩余171例患者设为低表达组,年龄(60.43±12.42)岁,并绘制两组患者生存曲线,两组患者年龄没有差异。同时选择2016年8月至2020年8月我院接收的57例肝癌患者为实验组,平均年龄(59.25±12.31)岁,对照组为25例本院近期健康体检者,平均年龄(58.33±10.57)岁,两组患者年龄没有差异。本实验符合并通过本院伦理审批,批准号:20160703。
1.2 SPP1在不同肿瘤分期中的比较 根据肿瘤的病理学分期及TNM分期,将患者分别归入相应的各组,比较SPP1基因在不同分期中的相对表达水平。
1.3 SPP1相关基因筛选 利用Omisc软件,将检测的所有基因表达水平逐一与SPP1表达水平进行Pearson相关性检验,根据相关系数选取与SPP1表达水平相关性最高的50个基因,并绘制基因热图。
1.4 血清蛋白检测 肝癌患者及健康体格检查者均在晨起、空腹时采集上肢静脉血5 mL。采用低温离心机(艾本德5427R)3 000 r/min,离心10 min,取上清。按照试剂说明书采用ELISA法检测OPN(Abcam公司ab214050)和甲胎蛋白(Alpha fetoprotein,AFP)(abcam公司ab108838)。
1.5 Child-Pugh 分级 按评分值分级:A 级5~6 分,B 级7~9 分,C 级≥10 分,见表1。
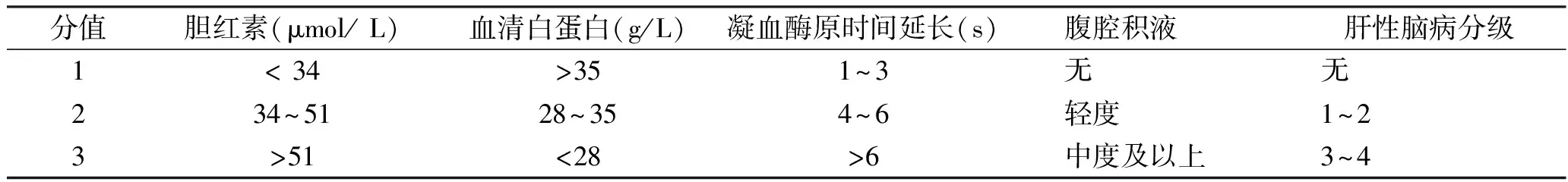
表1 Child-Pugh 分级评分标准

2 结果
2.1 SPP1表达差异对生存时间的影响 SPP1高表达组患者的中位生存时间低于SPP1低表达组,差异有统计学意义(712 d vs 1 327 d,P<0.05,见图1)。
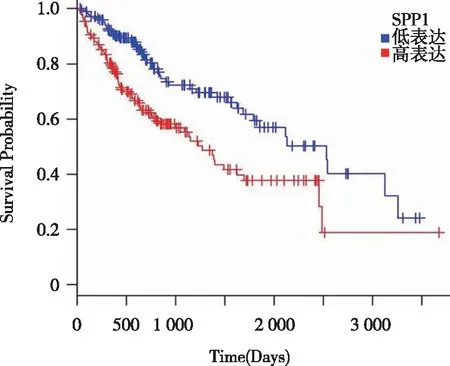
图1 两组患者生存曲线比较
2.2 不同分期患者SPP1表达差异 根据病理分期分组, 4组间SPP1表达水平差异有统计学意义(F=5.238,P<0.05),其中Ⅰ期患者SPP1表达水平显著低于Ⅱ~Ⅳ期的患者,Ⅳ期SPP1表达水平高于Ⅰ~Ⅲ期患者,差异均有统计学差异(P<0.05,见图2A)。根据T分期分组, 4组间SPP1表达水平差异有统计学意义(F=6.215,P<0.05),其中T1期患者SPP1表达水平显著低于T2~T4期患者,T4期SPP1表达水平高于T1-3组,差异均有统计学差异(P<0.05,见图2B)。
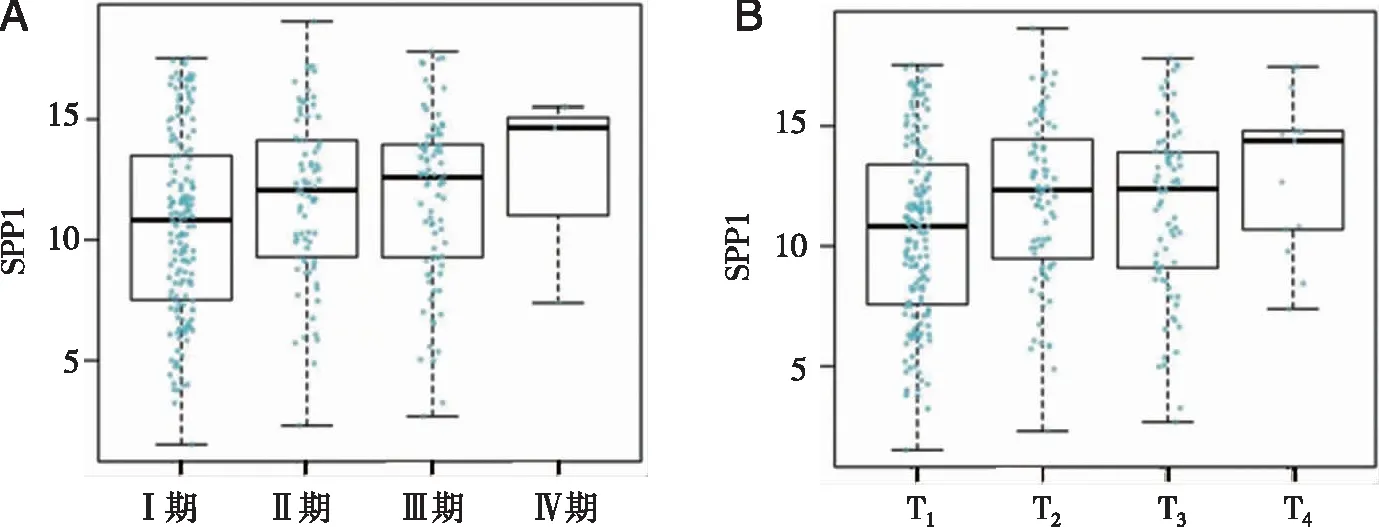
A:SPP1病理分期比较,a:与Ⅰ 期比较,P<0.05;b:与Ⅳ期比较,P<0.05;B:SPP1的T分期比较,a:与T1期比较,P<0.05;b:与T4期比较,P<0.05。图2 不同病理分期患者SPP1表达水平差异
2.3 SPP1相关基因的筛选 在检测到的19 366个基因中,有10 285个基因与SPP1相关(P<0.05,见图3A),选取与SPP1表达正相关系数最高的前50个基因,并绘制基因热图(见图3B);通过文献检索这50个基因中有42个基因与肿瘤相关,其中与SPP1最相关的葡糖胺(N乙酰)转移酶3(Glucosaminyl (Nacetyl) transferase 3,GCNT3)和膜联蛋白A2(Annexin A2,ANXA2)均与肝癌相关[12-13]。
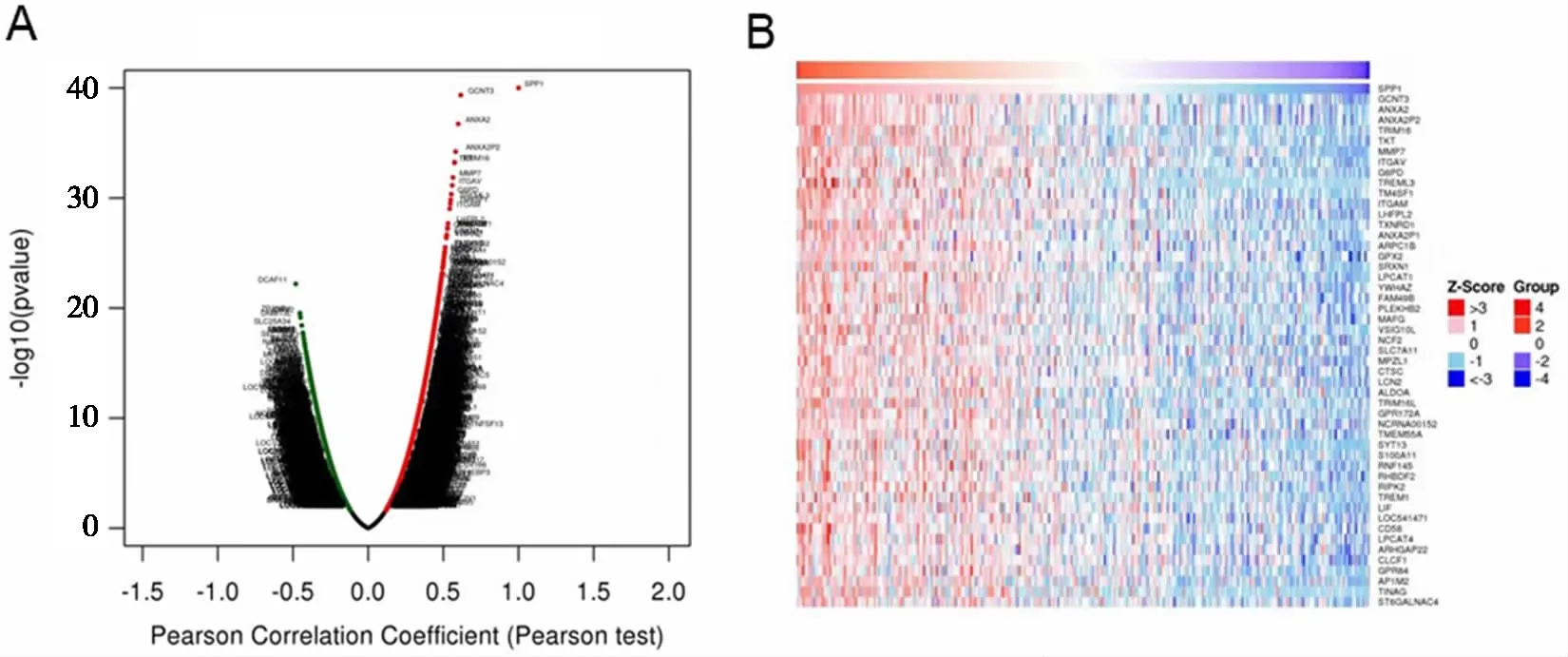
A:SPP1与各基因的相关性分析结果;B:与SPP1表达相关系数最高的前50个基因。图3 SPP1相关基因筛选结果
2.4 组间血清指标比较及相关分析 两组患者SPP1和AFP组间差异有统计学意义(P<0.05)。SPP1表达水平均与AFP正相关(r=0.514,P<0.05,见表2)。

表2 肝癌组与对照组检测指标比较
2.5 不同Child-Pugh分级肝癌患者SPP1比较 随着Child-Pugh 分级的递增,SPP1逐渐增高,在C 级达到最高水平,组间差异有统计学意义(P<0.05),且两两比较差异均有统计学意义(P均<0.05,见表3)。

表3 不同Child-Pugh分级组间SPP1比较
2.6 肝癌患者SPP1及AFP的ROC 曲线 SPP1的ROC 曲线下面积为0.894(95%CI:0.807~0.982),当诊断界值确定为135.5μg/L 时,SPP1诊断肝癌的灵敏度为92.0%,特异性为60.7%;AFP 的ROC 曲线下面积为0.799(95%CI:0.694~0.903),当界值确定为18.38μg/L 时,AFP 诊断肝癌的灵敏度为92.0%,特异性为58.9%;GP73 和AFP 联合检测的ROC 曲线下面积为0.944(95%CI:0.903~0.985),联合诊断的灵敏度为97.6%,特异性为71.4%(见图4)。
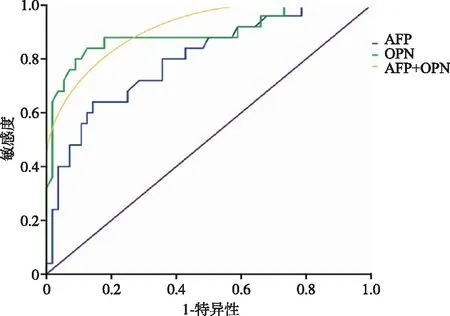
图4 SPP1及AFP诊断肝癌的ROC曲线
3 讨论
迄今为止,人们对SPP1在癌症发展和转移中的详细功能和作用知之甚少。因此,本研究就SPP1在肝癌中的预后、诊断价值和表达模式展开分析。在缺乏明确的机理研究的情况下,我们无法仅根据表达水平将特定基因定义为肿瘤促进/抑制基因,但是,利用广泛的致癌数据库可为研究人员提供对这些基因的分子机制的更深入理解。对SPP1与各种肿瘤预后之间关系的分析表明,SPP1在乳腺癌、前列腺癌、结肠癌、头颈癌、肝癌、肺癌和食道癌中表达上调[6-11]。并且高水平的SPP1基因表达与这些癌症的不良预后有关。据报道,SPP1可增强癌细胞的存活,血管生成和炎症反应[14],同时通过促进上皮到间充质细胞转移过渡[15]。这些研究在一定程度上说明SPP1促进肿瘤的进展。
本研究发现GCNT3和ANXA2与SPP1表达水平的相关系数最高,其中GCNT3基因是参与粘蛋白生物合成的N-乙酰氨基葡萄糖转移酶家族成员。众所周知,GCNT3的异常表达会促进多种人类癌症的进展[16]。Liu等[12]研究通过人肝癌细胞系、原位异种移植瘤和临床组织样本证明了GCNT3上调与肝癌转移相关的证据。差异转录的糖基因可能是新药物的潜在靶点,也可能作为预测肝癌转移的潜在生物学标志物。ANXA2主要定位于细胞膜或细胞质,参与多种细胞过程[17-18]。在肝癌中,ANXA2的表达不仅与肿瘤大小和分化程度相关,还与其他癌症的发展有关,如乳腺癌、透明细胞肾细胞癌、结直肠癌、肺癌等。STAT3是调控肝癌进展的另一个关键分子,通过磷酸化持续激活,诱导肝损伤[19]。ANXA2/STAT3的直接相互作用促进癌细胞的增殖和侵袭,而ANXA2的Tyr23磷酸化依次激活STAT3的潜在分子机制[17,19]。一项相关研究确实表明,STAT3阻断全细胞肝癌疫苗可以诱导细胞和体液免疫应答对抗肝癌。此外,一些研究表明,STAT3与其他蛋白(如己糖激酶2、Jab1/Csn5)的相互作用可能导致癌症进展[20-21]。
为进一步分析SPP1对肝癌的诊断分析的作用,本研究分析了SPP1血清表达蛋白OPN与肝癌诊断指标AFP的相关性,以及对肝癌Child—pugh评分的影响。结果表明SPP1表达蛋白OPN不仅与AFP呈正相关,还与Child—pugh分级密切相关,可以作为Child—pugh分级参考指标。肝炎会导致肝硬化和肝癌的发展,肝硬化患者的最新scRNA-Seq分析[22]和肝癌免疫学[23]揭示SPP1在炎症细胞亚群中表达增加。OPN在肝纤维化中起关键作用,因为它通过依赖TGF-β的机制激活HSC并诱导I型胶原沉积[24]。重组OPN可以激活肝癌细胞,并增强其侵袭性和伤口愈合潜力[25]。还有研究表明,OPN是肝癌的前瞻性血清生物标志物,在对12项研究的荟萃分析中,血清OPN的ROC曲线下诊断HCC的面积要比AFP高[26]。此外,OPN与肝癌患者预后不良相关,多项研究表明,手术切除后的患者血清OPN与总体不良状态和无病生存率以及较高的肝癌分期和肿瘤大小之间存在相关性[26]。并且本研究还发现OPN联合AFP对肝癌、肝硬化患者的敏感性明显高于单独AFP检测。
综上所述,SPP1可能作为新型的辅助诊断肝癌、肝硬化的血清学标志物,还有助于肝癌早期诊断并为分阶段化护理策略提供参考。

