丹参酮ⅡA 注射液联合大黄制剂对急性肾损伤小鼠氧化应激凋亡的影响
王 敏,邢竹兰
(南京市高淳中医院,江苏 211300)
急性肾损伤(acute kidney injury,AKI)是重症医学科较为常见的一种严重性疾病,患者死亡率高达70%。其中感染、创伤、肾灌注不足以及药物中毒等均可能导致AKI 的发生[1-2]。AKI 的发病机制十分复杂,全身的炎症反应综合征是诱发休克和机体多功能器官损害的重要病理生理过程[3]。但是目前有关AKI 的治疗仍无有效措施,因此,积极寻求AKI 有效防治途径显得尤为迫切。本研究通过采用盲肠结扎穿孔(cecal ligation and perforation,CLP)方法制备脓毒症诱导的小鼠AKI 模型,探究丹参酮ⅡA 注射液联合大黄制剂对小鼠AKI 损伤的影响及其作用机制。
1 材料与方法
1.1 实验动物 雄性,周龄6~8 周,体质量18~20 g,C57 BL/6 小鼠由河北医科大学实验动物中心提供[SCXK(冀)2019-0006],该实验通过河北医科大学动物实验伦理委员会审核批准。
1.2 实验药物与试剂 丹参酮ⅡA 磺酸钠注射液(上海第一生化药业公司,规格:2 ml∶10 mg,批号H31022558);大黄制剂(大黄 1.5 g、黄芪 2.0 g、菊花1.5 g、丹参 1.0 g、甘草 1.5 g、茯苓 1.5 g、川芎 1.0 g)水煮至 20~30 ml,含药浓度:0.5 g/ml,放置于 4 ℃,低温保存4 周;HE 染色试剂盒(江苏碧云天公司);TUNEL 染色试剂盒(江苏碧云天公司);超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成有限公司)。
1.3 主要实验仪器 全自动生化分析仪(美国贝克曼库尔特,型号:AU5800);酶标仪(赛默飞世尔,型号:SAF-680T);高速离心机[赛默飞世尔科技(中国)有限公司,型号:Micro17R]。
1.4 急性肾损伤模型制备 利用盲肠结扎穿孔(CLP)构建脓毒症诱导的小鼠急性肾损伤模型。沿小鼠腹部正中线做1 cm 左右的切口,找到盲肠并在盲肠根部采用4 号线结扎盲肠,18 号静脉穿刺针贯穿盲肠并挤出肠内少许内容物,操作完成后将盲肠还纳入腹腔,缝合手术切口,之后腹腔注射氯化钠注射液抗休克。假手术组小鼠除去对盲肠结扎和穿刺针穿孔,其余操作均与模型组小鼠操作一致。小鼠手术后3 d,造模成功标志:小鼠精神倦怠、腹胀,剖腹后可见腹腔有血性或者脓性分泌物并且出现盲肠肿胀发黑等。以上现象表明小鼠造模成功[4]。并于造模成功后1 d 进行分组给药处理。
1.5 给药处理 按照随机数字表法分为:假手术组(Sham)、模型组(Model)和丹参酮ⅡA 注射液联合大黄制剂治疗组(TM)。Sham 小鼠自由饮水饮食;Model组小鼠腹腔注射给予10 ml/kg 氯化钠注射液3 d,2次/d;丹参酮ⅡA 注射液联合大黄制剂治疗组小鼠给予丹参酮ⅡA 注射液10 ml/kg 腹腔注射和2 ml/kg的大黄制剂灌肠处理3 d,2 次/d,每次间隔12 h。以上各组小鼠每组各10 只,随机选取6 只进行后续实验。
1.6 标本收集 Sham 组小鼠麻醉后取血液样本2~3 ml。CLP 诱导小鼠AKI 成功3 d 后取小鼠血液样本2~3 ml。丹参酮ⅡA 注射液联合大黄制剂治疗组小鼠治疗3 d后于最后一次给药12 h 后,取小鼠血液样本2~3 ml。3 000 r/min 离心 10 min,取上清,并放置于-20 ℃冰箱保存。试剂盒和全自动生化分析仪测定血清BUN和Cr 含量。
1.7 苏木素-伊红(HE)染色 给予丹参酮ⅡA 注射液联合大黄制剂治疗3 d 后将各组小鼠处死,并分离肾脏组织,并按照试剂盒说明书进行HE 染色观察小鼠肾脏组织形态学变化。
1.8 TUNEL 染色检测细胞凋亡 按照TUNEL 染色检测试剂盒说明书对各组小鼠肾脏肾脏组织细胞凋亡进行检测。以肾脏组织出现绿色荧光颗粒判定为阳性。
1.9 肾脏组织氧化应激相关指标检测 取同等质量的各组小鼠肾脏组织研磨成组织匀浆,BCA 法测定各组蛋白质总浓度后分别通过酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA) 检 测SOD 和 MDA 含量。
1.10 统计学分析 采用SPSS 20.0 软件进行试验相关数据统计分析。所有数据采用表示,多组之间比较采用ANOVA 分析方法,两组间差异的比较采用t 检验方法,P<0.05 表示差异有统计学意义。
2 结果
2.1 丹参酮ⅡA 注射液联合大黄制剂对小鼠肾组织形态及功能的影响 Sham 组小鼠肾小球结构清晰,肾小管上皮细胞完整,肾间质无充血以及炎症细胞浸润,无明显损伤。Model 组小鼠肾小管上皮细胞肿胀、管腔狭窄、肾间质水肿并伴有炎症细胞浸润。TM 组小鼠肾脏组织上述现象明显减轻(图1)。与Sham 组比较,Model 组小鼠 BUN 和 Cr 含量显著增加(P<0.01)。与Model 组比较,TM 组小鼠BUN 和Cr 含量显著降低(P<0.05 或 P<0.01),见表 1。
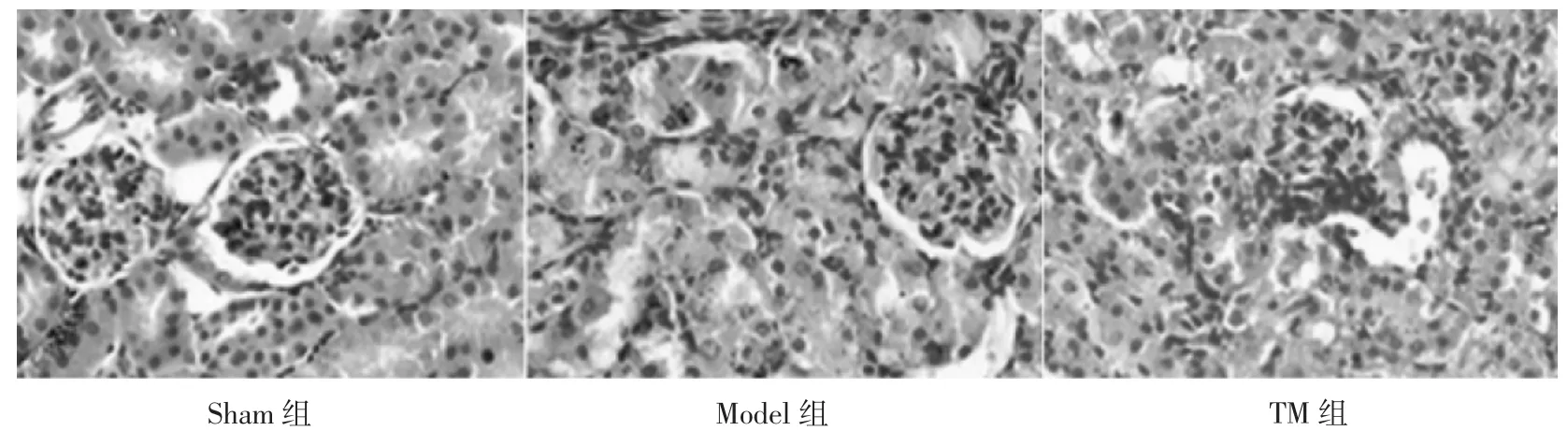
图1 各组小鼠肾脏组织形态学变化(200×)
表1 各组小鼠 BUN 和 Cr 水平变化(,n=6)

表1 各组小鼠 BUN 和 Cr 水平变化(,n=6)
与 Sham 组比较,**P<0.01;与 Model 组比较,#P<0.05,##P<0.01。
组别BUN(mmol/L)Cr(μmol/L)Sham 组 6.70±1.06 86.60±12.50 Model 组 45.22±5.09** 730.44±78.66**TM 组 34.55±4.09## 640.35±54.88#
2.2 丹参酮ⅡA 注射液联合大黄制剂对小鼠肾组织细胞氧化应激和凋亡的影响 TUNEL 染色显示,Model 组小鼠肾脏组织可见明显的绿色荧光深颗粒,表明有大量的细胞凋亡。TM 组小鼠肾脏组织细胞凋亡程度显著降低(图2)。与Sham 组小鼠比较,Model组 MDA 含量显著增加(P<0.01),SOD 水平显著降低(P<0.01)。与 Model 组比较,TM 组 MDA 含量显著降低(P<0.01),SOD 水平显著升高(P<0.01),见表 2。

图2 各组小鼠肾脏组织细胞凋亡情况(200×)
表2 各组小鼠 MDA 和 SOD 水平变化(,n=6)
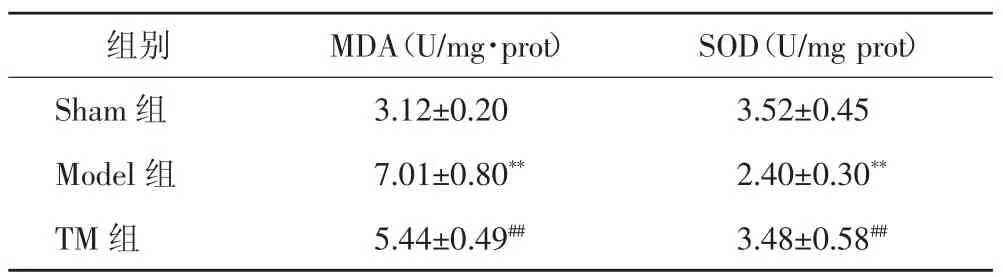
表2 各组小鼠 MDA 和 SOD 水平变化(,n=6)
与 Sham 组比较,**P<0.01;与 Model 组比较,##P<0.01。
组别 MDA(U/mg·prot) SOD(U/mg prot)Sham 组 3.12±0.20 3.52±0.45 Model 组 7.01±0.80** 2.40±0.30**TM 组 5.44±0.49## 3.48±0.58##
3 讨论
小鼠CLP 模型是脓毒症的经典模型,被广泛应用于脓毒症的机制研究[5]。脓毒症可以诱发机体的多功能脏器的损害,其中AKI 是脓毒症诱发的最严重的并发症,致死率极高[6]。盲肠穿孔导致肠道微生物渗出,释放内毒素,进而促进炎症因子大量释放,最终引起全身性的炎症反应。本研究首先通过CLP构建小鼠AKI 模型。结果显示,Sham 组小鼠肾小球结构清晰,肾小管上皮细胞完整,肾间质无充血以及炎症细胞浸润,无明显损伤。Model 组小鼠肾小管上皮细胞肿胀、管腔狭窄、肾间质水肿并伴有炎症细胞浸润。TM 组小鼠肾脏组织上述现象明显减轻。以上研究证实丹参酮ⅡA 注射液联合大黄制剂能够对CLP 诱导的小鼠AKI 具有保护作用。以往研究证实丹参酮ⅡA 能够通过抑制炎症因子释放和氧化应激水平,从而减轻脓毒症大鼠急性肾损伤[7]。另外,大黄制剂能够通过调节免疫功能从而改善急性肾损伤患者临床症状[8]。
血清中BUN 和Cr 是肾功能的重要检测指标,而血清中其水平主要是反映肾小球滤过功能[9]。AKI 时肾小球滤过率显著降低,进而导致血清中BUN 和Cr含量的升高。以往文献报道,在CLP 诱导的AKI 模型中,降低BUN 和Cr 水平能够有效减轻肾脏损伤[10]。本研究通过丹参酮ⅡA 注射液联合大黄制剂治疗组小鼠3 d。结果发现,与Model 组小鼠比较,TM 组小鼠血清中BUN 和Cr 水平均显著降低,表明丹参酮ⅡA注射液联合大黄制剂能够改善AKI 症状。氧化应激性细胞凋亡是脓毒症诱发AKI 的重要分子机制。在CLP 诱发的脓毒症合并AKI 小鼠模型中活性氧(reactive oxygen species,ROS)水平显著升高,凋亡蛋白caspase3 表达显著升高,Bcl-2 表达显著降低。而通过抑制剂清除ROS 可以有效降低肾脏组织炎症和细胞凋亡,进而改善 AKI 肾脏损伤[11]。因此,通过降低肾脏组织细胞氧化应激细胞凋亡能够有效改善AKI 损伤。本研究发现,与Sham 组比较,Model 组MDA 含量显著增加,SOD 水平显著降低,小鼠肾脏组织可见明显的绿色荧光深颗粒。与Model 组小鼠相比,给予丹参酮ⅡA 注射液联合大黄制剂能够增加肾脏组织SOD,降低MDA 含量,降低细胞凋亡。
综上所述,丹参酮ⅡA 注射液联合大黄制剂对CLP 诱导的AKI 具有保护作用,其作用机制可能是通过降低BUN 和Cr 水平,抑制细胞氧化应激凋亡。但是有关丹参酮ⅡA 注射液联合大黄制剂对AKI 保护作用的具体分子机制仍需要进一步研究。

