共载吴茱萸碱及磷酸氯喹复方脂质体的制备及乳腺癌抗癌效果初步研究*
杨成莉,文志鹏,李明,郑志昌
550000 贵阳,贵州医科大学附属医院 药剂科
2020年全球乳腺癌新发病例高达226万例,已成为威胁女性健康的第一大癌[1]。化疗仍然为其主要治疗方法之一,但效果不尽理想,原因之一是缺乏适当的载体将化疗药物准确、高效地输送至癌症部位发挥杀死癌症细胞的作用。因此,研究优良载体以包载化疗药物实现有效递送,对提高化疗药物治疗作用具有重要意义[2]。
吴茱萸碱(evodiamine,EVO)为色胺吲哚类生物碱,是中药吴茱萸的主要活性成分[3-4]。现代药理学研究结果表明,其可调控NF-κB、P53蛋白表达,具有抗癌作用[5]。Zhu等[6]研究发现EVO能用于抑制ER阳性/阴性乳腺癌细胞的增殖。磷酸氯喹(chloroquine,CQ)具有抑制细胞自噬的作用使它成为抗肿瘤的热点,普遍认为其是通过阻断自噬体与溶酶体融合过程发挥自噬抑制机制的;除此之外,CQ能调控抑瘤蛋白P53,增强化疗药物抗癌活性[7-8]。已有研究表明,在化学药物治疗晚期,基于细胞自我修复机制,肿瘤细胞过度激活自噬机制,进行受损细胞自体修复,降低化疗效果[9]。因此,联合使用自噬抑制剂,抑制肿瘤细胞晚期自噬上调,或可起到协同抗肿瘤的效果。
基于以上理论研究基础,本研究拟将磷酸氯喹与吴茱萸碱用于联合抗肿瘤。但是,EVO是脂溶性药物,水溶性小,体内生物利用度低;而CQ为抗疟疾药物,对正常组织细胞也有较强的杀伤作用。因此,如何将EVO、CQ高效准确地递送入肿瘤部位成为本研究所要解决的关键问题,而药物载体的设计为其带来契机。为了增加药物在癌症血管部位的累积,目前最常用的制剂学手段是设计纳米给药系统,实现化疗药物靶向递送[9-10]。脂质体是由类脂双分子层形成的微型泡囊体,可同时将亲水及亲油的物质包载于其中,故本研究拟将CQ及EVO共同包载于脂质体内,制备吴茱萸碱及磷酸氯喹复方脂质体,作用于乳腺癌细胞,利用两者均具有抗癌活性药理作用,协同杀死肿瘤细胞,使治疗作用更加迅速、高效。
1 材 料
1.1 仪器
SW-CJ-2F超净工作台(苏净集团安泰公司),BB15细胞培养箱(美国Thermo 公司),IX73-U倒置荧光显微镜(日本Olympus公司),ELX800通用酶标仪(美国Bio-tek公司),RE-2000A旋转蒸发仪(上海亚荣生化仪器厂),G16W高速离心机(长沙湘智离心机仪器有限公司),超声波细胞破碎仪(宁波新芝生物科技股份有限公司),720型紫外分光光度计(北京普析通用仪器有限公司),超声波细胞破碎仪(宁波新芝生物科技股份有限公司)。
1.2 试剂
胆固醇(cholesterol,CHOL;批号:111618-200301,美仑生物)、氢化大豆卵磷脂(lecithin hydrogenated,HSPC;批号:525600-2130493-01,美仑生物)、吴茱萸碱(批号:PS0075-0025,成都普思生物科技有限公司)、磷酸氯喹(批号:100421-200401,索莱宝生物试剂有限公司)、四甲基偶氮唑蓝(MTT,批号:CO41004,美国Sigma公司),二甲基亚砜等常规试剂(DMSO,分析纯,天津市科密欧化学试剂有限公司)。
1.3 细胞株
人体胚胎肾细胞HEK293由四川大学生物治疗国家重点实验室友情提供,人乳腺癌细胞MCF-7购自武汉普诺赛生命科技有限公司。
2 方 法
2.1 含量测定方法
2.1.1 测定波长 精密称取干燥至恒重的EVO及CQ原料药0.25 mg及5 mg,加1 mL甲醇溶解后,置于100 mL溶量瓶中,加蒸馏水稀释至刻度,摇匀,制成质量浓度为2.5 μg/mL的EVO及2.5 μg/mL的CQ对照品溶液。以蒸馏水为空白溶剂对照,在200~600 nm范围内进行波长扫描,结果表明在EVO在λ=225 nm,CQ在λ=343 nm处有最大吸收峰[11-12];分别取破乳后的空白脂质体溶液,破乳后EVO-CQ-Lips脂质体溶液同法扫描,结果表明样品溶液同样在225 nm及343 nm处分别有最大吸收,而空白脂质体溶液在该两个波长处无吸收,说明辅料和溶剂对药物测定没有干扰。
2.1.2 标准曲线绘制 精密称取一定质量的EVO并用容量瓶精密配置浓度为1.0、1.5、2.0、2.5、3.0 μg/mL。用720型紫外分光光度计在λ=225 nm测定其吸光度(A值),以吸光度A值对浓度(C)线性回归,得回归方程:A=0.1744C+0.0504(R2=0.9991),结果表明EVO质量浓度在1.0~3.0 μg/mL范围内与吸光度线性拟合度较好。
精密称取一定质量的CQ并用容量瓶精密配置浓度为10.0、15.0、20.0、25.0、30.0 μg/mL。用720型紫外分光光度计在λ=343 nm测定其吸光度,以吸光度A值对浓度C线性回归,得回归方程:A=0.0212C+0.0962(R2=0.9994),结果表明CQ质量浓度在1.0~3.0 μg/mL范围内与吸光度线性拟合度较好。
2.1.3 精密度实验 日内精密度:分别对EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)于一天内平行测定5组吸光度,计算吸光度的相对标准偏差(relative standard deviation,RSD)(%),EVO、CQ吸光度的日内精密度RSD<5.0%,结果表明EVO、CQ的日内精密度良好。
日间精密度:分别对EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)于1、2、3、4、5天内平行测定5组吸光度,计算RSD(%),EVO、CQ吸光度的日内精密度RSD<5.0%,结果表明EVO、CQ的日内精密度良好。
2.1.4 加样回收率实验 采用加样回收试验法进行回收率计算,具体操作方法如下:分别取不同浓度EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)各1.0 mL与已知含量样品溶液浓度0.5 mL进行混合,进行回收率(%)的计算,加样回收率(%)=(实测值-已知量)/理论加入量×100%。结果测得EVO、CQ的回收率(%)在95%~105%之间,本法测定EVO、CQ的包封率准确度良好。
2.2 EVO-CQ-Lips的制备
2.2.1 EVO-Lips的制备 采用乳化溶剂挥发法结合薄膜分散法制备EVO-Lips,按处方比例称取EVO、HSPC、CHOL,用适量有机溶剂超声溶解后加入20 mL圆底烧瓶中,在减压旋转蒸发仪上进行旋蒸除去有机溶剂氯仿使其形成稳定的脂质体膜。将制备好的脂质体膜加入1.5 mL的硫酸铵缓冲溶液进行水合1 h,水合1 h后转移至4 mL EP管中,用超声波细胞破碎仪超声(变幅杆先用ddH2O超声30 s,再通无水乙醇超声30 s,超声脂质体时按处方设置超声功率、超声时间、时间设置为超声5 s停顿5 s)。
2.2.2 EVO-CQ-Lips的制备 硫酸铵梯度法[13]:超声完成后加入到透析袋中用PBS溶液(pH 7.4)进行透析12 h,透析介质为0.01 mol PBS缓冲液1 L。透析12 h后加入200 μL CQ储备液(浓度为50 mg/mL)65 ℃在恒温水浴锅上孵育30 min,即可得到EVO-CQ-Lips。
2.2.3 EVO-CQ-Lips处方筛选 按照上述方法,以脂质体中EVO、CQ粒径、外观形态、包封率载药量为指标,对影响因素包括乳化有机溶剂、脂质配比、硫酸铵溶液浓度、超声功率采用单因素结合正交设计进行处方筛选。
2.3 EVO-CQ-Lips表征
2.3.1 粒径分布考察 利用马尔文激光散射粒度仪测定EVO-CQ-Lips的粒径、多分散系数(polydisperity index,PDI),取1 mg/mL的EVO-CQ-Lips的样品溶液,加入粒径比色皿及电位杯中进行检测,25 ℃下,重复测定3次。并且重复3次平行实验。
2.3.2 外观形貌测定 采用磷钨酸负染法[14]:按最优处方制备EVO-CQ-Lips,双蒸水重悬后,滴至专用铜丝上,静置风干后,再滴加2%(w/v)磷钨酸负染2 min,于透射电子显微镜下观察其外观形态。
2.3.3 包封率测定 采用超速离心法测脂质体包封率,取制备好的脂质体混悬液,于0.8 μm滤头过滤除去未包封于脂质体的EVO及CQ,将过滤后的脂质体溶液加入1.5 mL离心管中,以13 000 rpm离心90 min,收集脂质体,加入适量甲醇超声破乳,用 PBS 稀释定容至适当浓度后测定吸光度,计算脂质体中药物含量为WEVO及WCQ,设总投药量为MEVO,MCQ。按下式计算包封率:EE%=WEVO/CQ/MEVO/CQ×100%。用甲醇消解EVO-CQ-Lips,使其释放出已经包封的EVO及CQ,采用紫外分光光度计在[λmax(EVO)=225 nm和λmax(CQ)=343 nm]分别测定EVO、CQ的包封率,根据测出的粒径和包封率筛选出最优处方。超速离心法加样回收率考察: 精密称取EVO、CQ原料于量瓶中,甲醇溶解后,加蒸馏水稀释成浓度EVO为1.0、2.0、3.0 μg/mL,CQ为10.0、20.0、30.0 μg/mL的溶液,分别取不同质量浓度药物溶液 0.1 mL 与 0.2 mL 空白脂质体混匀,同上方法离心处理加入到超滤管中,离心超滤后收集滤液,稀释后测定吸光度,计算回收率。
2.3.4 EVO-CQ-Lips稳定性及体外释放研究 稳定性:按最优处方制备脂质体8份,均分为A、B两组,A组静置于4 ℃、B组静置于室温条件下,于制备好脂质体后的0、0.5、1、2、4、8、16、28、32日时用粒度仪测定其粒径(nm)。体外释放:最优处方制备脂质体在1 mL PBS溶液(A组用pH 4.0、B组用pH 7.4)重悬后放置于37 ℃、120 rpm的恒温摇床中。在预设时间点(0 h、0.5 h、2 h、4 h、6 h、18 h、1 d、2 d、4 d、7 d、14 d、21 d、28 d)将释放介质全部取出,并立即补以预热的相同体积对应pH的新鲜释放介质。采用UV-vis 法在225 nm、343 nm波长处测定样品中的EVO及CQ的含量,计算各样品累计释放率并以释放率及对应时间制作释放曲线。
2.4 EVO-CQ-Lips体外毒性研究
以人肾胚细胞HEK293细胞为正常细胞研究模型,采用MTT法检测EVO-CQ-Lips对正常细胞杀伤作用。具体来说,取对数生长期的HEK293细胞以每孔4 000个的密度接种于96孔细胞培养板中,放入CO2孵箱24 h后吸弃原有培养基,然后依次加入系列浓度药EVO-CQ-Lips培养基溶液200 μL,同时加入全培养基作为空白对照组,继续培养48 h后,加入20 μL MTT溶液(5 mg/mL),于4 h后从孵箱中取出96孔板中,将其液体吸出,加入150 μL的二甲基亚砜溶液后立即用酶标仪于570 nm测定其吸光值。
2.5 EVO-CQ-Lips细胞体外抗肿瘤活性研究
2.5.1 MTT检测EVO-CQ-Lips对MCF-7细胞增殖抑制作用 采用MTT法测定EVO-CQ-Lips体外抗MCF-7增殖作用。取对数生长期的MCF-7细胞以3500个/孔接种于96孔板中,放入CO2孵箱24 h后吸弃原有培养基,然后依次加入系列浓度药EVO-CQ-Lips以及其对应浓度的游离EVO和CQ,以及游离EVO联合CQ药物培养基溶液200 μL,同时加入全培养基作为空白对照组,继续培养48 h后,加入20 μL MTT溶液(5 mg/mL),于4 h后从孵箱中取出96孔板中,将其液体吸出,加入150 μL的二甲基亚砜溶液后立即用酶标仪于570 nm测定其吸光值。
2.5.2 细胞活死染色对MCF-7细胞毒性作用考察 取对数期生长MCF-7细胞,以8×104/孔接种于24孔细胞培养板,24 h后加入终浓度梯度的EVO-CQ-Lips的纳米粒细胞培养液0.05、5、100 μM。每个浓度设置三个复孔,同时加入全培养基作为空白对照组,24 h后加入配制好的Calcein-AM/PI染液。37℃孵育30 min,吸弃染色工作液,终止孵育,加入10 μL抗荧光淬灭封片液,复以细胞爬片,中性树脂封片,于490 nm激发波长下观察黄绿色活细胞,并于545 nm处激发波长下观察红色的死细胞。
3 结 果
3.1 EVO-CQ-Lips最优处方确定
3.1.1 乳化溶剂筛选 采用乳化溶剂挥发法结合薄膜分散法制备脂质体,首先对乳化溶剂进行筛选,选择成膜较好且均匀,真空减压旋蒸不起泡的溶剂作为处方溶剂,乳化溶剂筛选结果见表1。结果表明,以氯仿作为成膜溶剂为最优选项。
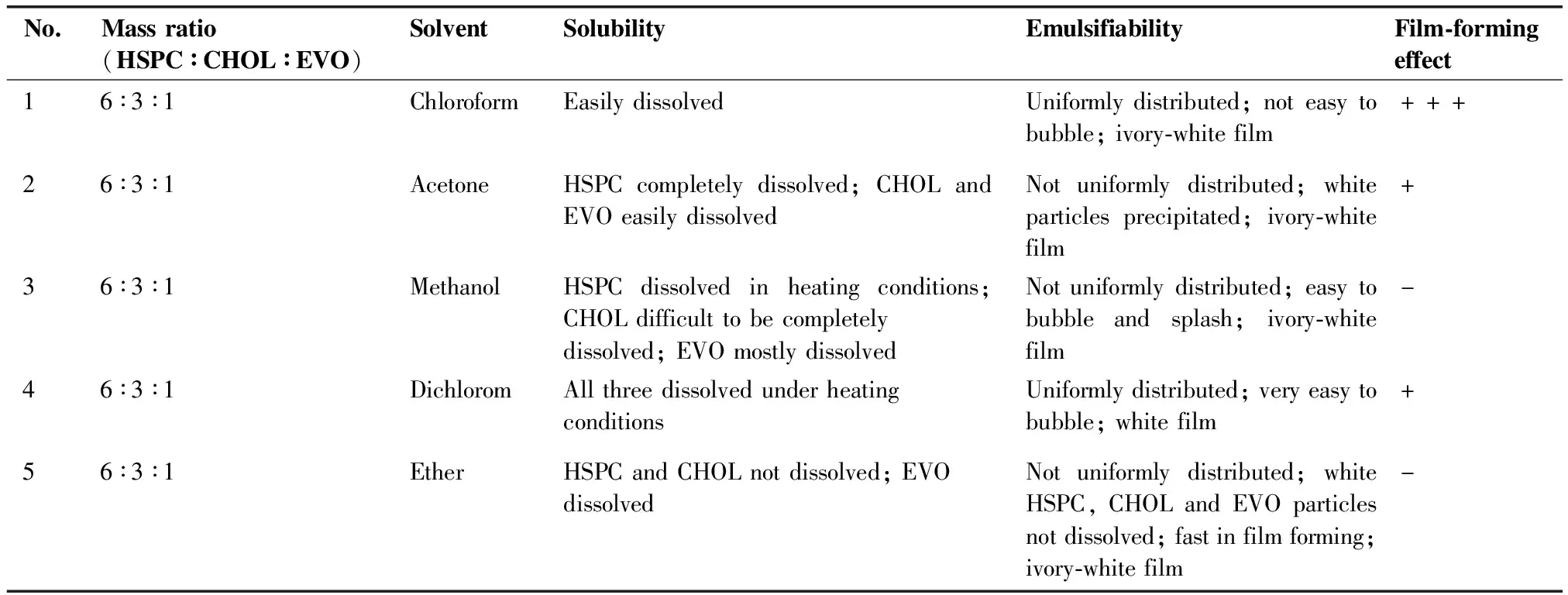
表1 处方溶剂筛选
3.1.2 最优处方比例筛选及结果 通过单因素处方筛选方法,以氢化大豆卵磷脂∶胆固醇∶吴茱萸碱(HSPC∶CHOL∶EVO)比例、超声功率(%)、硫酸铵浓度(pH 4.5)为影响因素,探讨其对胆固醇和氢化大豆卵磷脂影响粒径(nm)、包封率(%)的影响。以基本处方HSPC∶CHOL∶EVO取6∶3∶1、硫酸铵浓度(pH 4.5)3 M、超声功率40%为基准,孵育温度65 ℃、超声时间3 min为固定值,结果如表2所示。
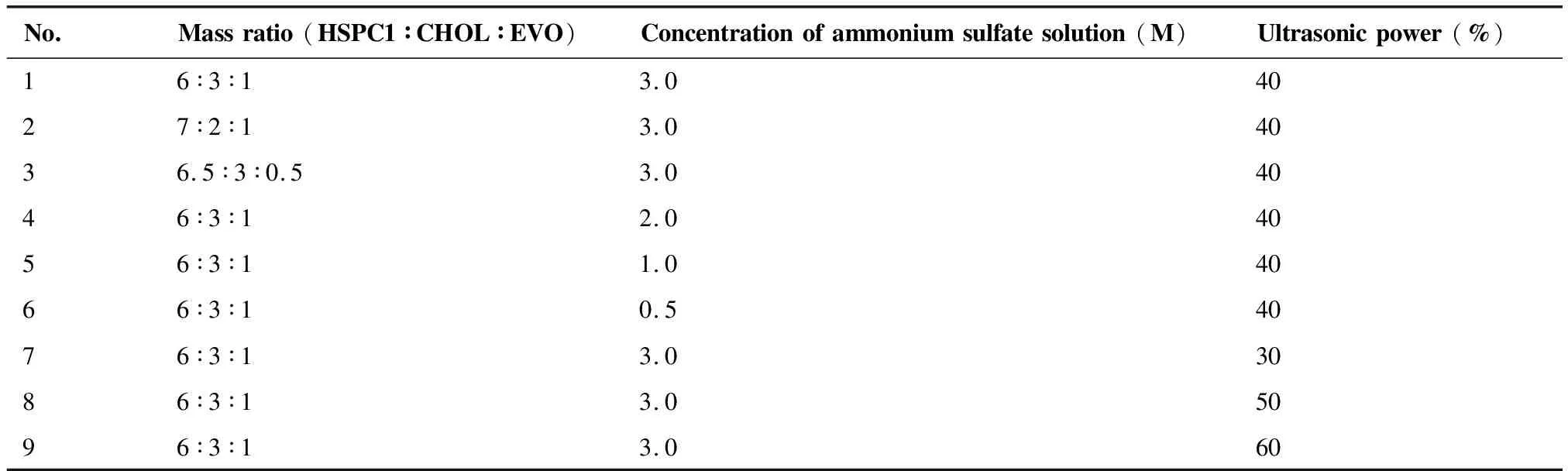
表2 处方筛选指标
以氯仿为处方溶剂、按处方比例制备了1~9个处方的EVO-CQ-Lips,测定其粒径(nm)、PDI、EVO包封率(EE%)、CQ包封率(EE%),结果如表3所示。
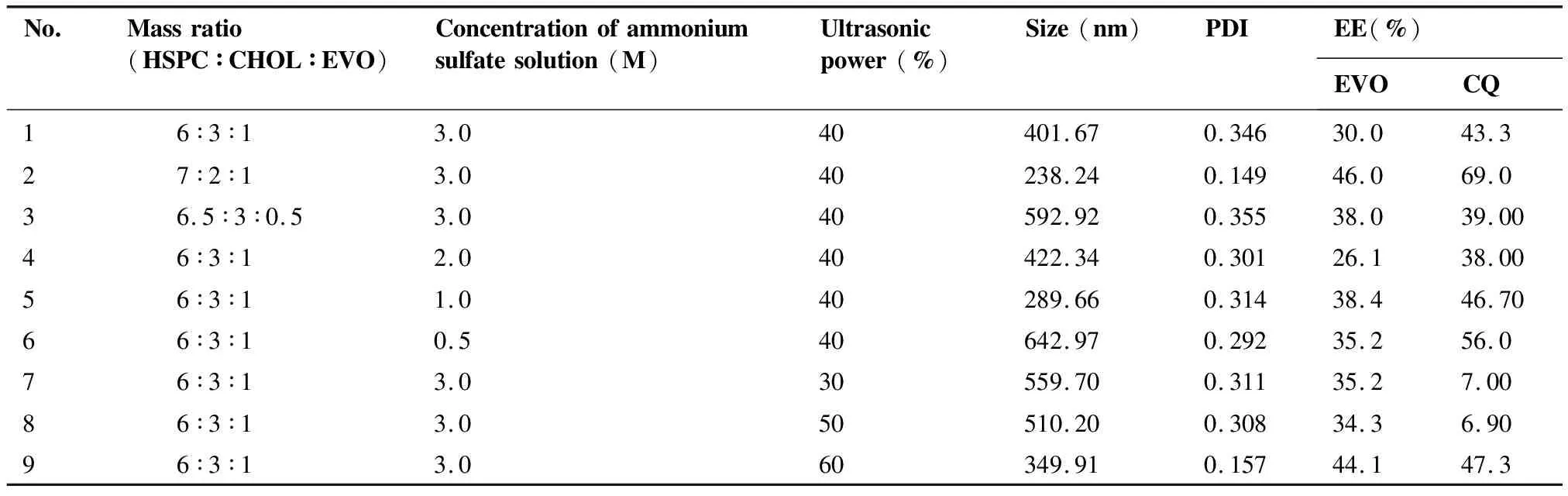
表3 处方筛选
综合以上9个处方的结果可见,我们选择了HSPC∶CHOL∶EVO为7∶2∶1、硫酸铵浓度(pH)为1 M、超声功率为40 %为最优处方配比,所制备最优处方制备纳米粒,粒径、电位及包封率如表4。

表4 最优处方纳米粒特征
3.2 EVO-CQ-Lips表征
3.2.1 EVO-CQ-Lips的形态粒径及分布测定 粒径分布:采用粒度仪测定其粒径(nm)及分布,粒度分布如图1所示。由结果可见,最优处方所制备EVO-CQ-Lips粒径在(170±6.24)nm,其粒度分布较为均匀,PDI为0.21±0.05。TEM形态考察:透射电子显微镜下观察其外观形态。结果如图2所示。
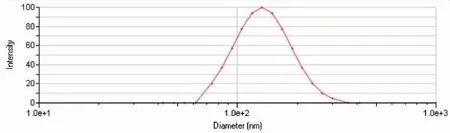
图1 最优处方的粒径(nm)
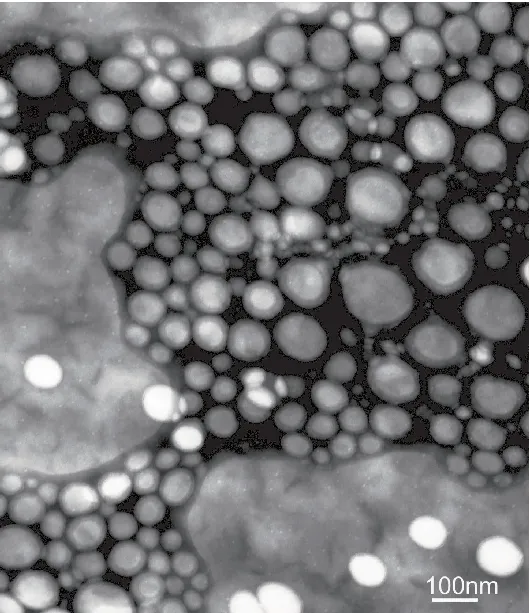
图2 EVO-CQ-Lips的TEM
由图可见,EVO-CQ-Lips呈光滑类球形且分散较不均匀,EVO-CQ-Lips由于包裹了一层胆固醇和大豆磷脂酰胆碱成分,故呈不规则类球形;由于外壳连接一层CQ亲水层,可见一层颜色较深的阴影层,因胆固醇含量较高,形态较稳定。
3.2.2 EVO-CQ-Lips中EVO、CQ包封率测定 EVO的超滤离心法平均回收率可达97.4%,CQ可达98.1%,且RSD<5%,因此包封率的测定可采用超速离心法。所测得包封率为EE(EVO)%=60.03%,EE(CQ)%=76.31%。
3.3 EVO-CQ-Lips稳定性及体外释放研究
3.3.1 稳定性考察 按最优处方制备脂质体8份,均分为A、B两组,A组静置于4 ℃、B组静置于室温条件下,于制备好脂质体后的0、0.5、1、2、4、8、16、28、32日时用粒度仪测定其粒径(nm)。粒径(nm)的稳定性结果如图3所示。
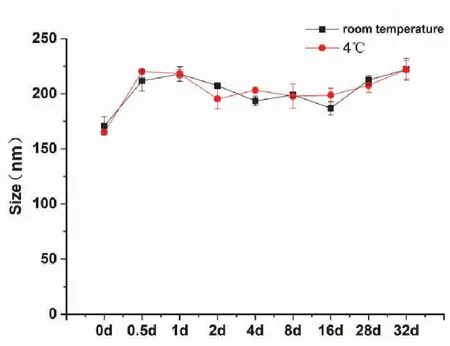
图3 EVO-CQ-Lips 储存稳定性考察(N=3)
最优处方脂质体在4 ℃和25 ℃条件下0~2 d时粒径(nm)较为稳定,在2~8 d时有所波动但粒径(nm)变化并不大,可能是因为90 plus PALS粒度仪趋于稳定,因而EVO-CQ-Lips在4℃和室温储存0~32 d稳定性都较为良好。
3.3.2 体外释放结果考察 最优处方制备脂质体在1 mL磷酸盐缓冲盐溶液(A组:pH 4.0;B组:pH 7.4)重悬后放置于37 ℃、120 rpm的恒温摇床中。在预设时间点(0 h、0.5 h、2 h、4 h、6 h、18 h、1 d、2 d、4 d、7 d、14 d、21 d、28 d)。释放率曲线结果如图4所示。
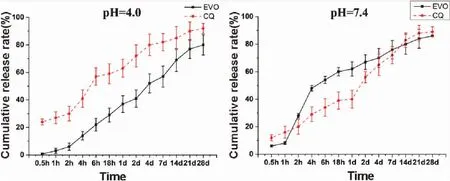
图4 EVO及CQ在不同pH条件下释放率比较(N=3)
体外释放结果显示在低pH时,CQ较EVO释放快,而pH接近中性时两者释放速率相当,释放率均能达到80%以上。
3.4 EVO-CQ-Lips体外毒性研究
纳米粒细胞毒性检测结果见图5。由图可见,随着纳米粒浓度增大,对HEK293细胞的抑制率升高,但是直到浓度增大到50 μM,细胞抑制率仍然低于20%,细胞存活率高于80%。因而,纳米粒对正常细胞毒性较低,可较为安全地应用。
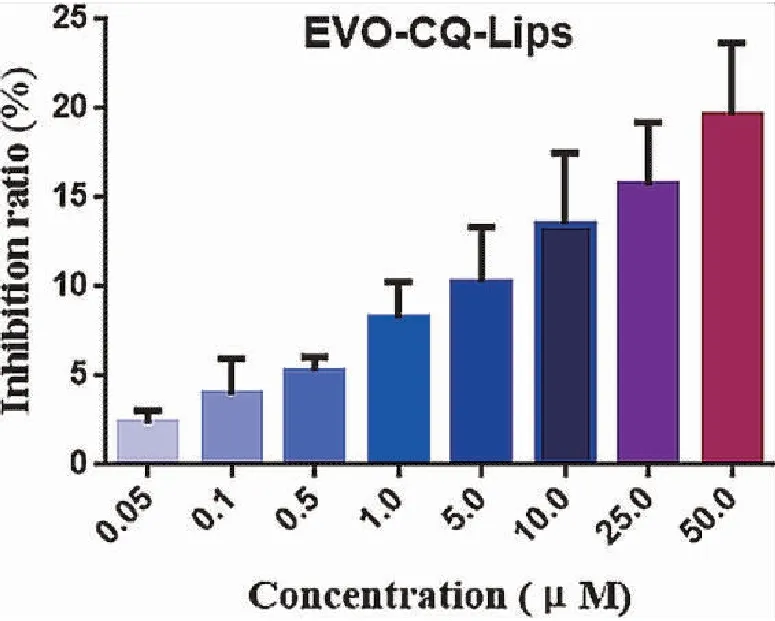
图5 EVO-CQ-Lips毒性考察
3.5 EVO-CQ-Lips细胞体外抗肿瘤活性研究
结果如图6所示,图A显示游离EVO对MCF-7细胞的生长有抑制作用,且当EVO浓度达到100 μM时,抑制率达到68%作用,由图B显示了游离CQ通过增强自噬对MCF-7细胞的生长也有一定抑制作用,且浓度在92 μM时,抑制率接近30%。图C将联合EVO以及EVO-CQ-Lips对应浓度CQ对MCF-7的抑制作用进行考察,结果显示尽管在高浓度时联合CQ对EVO的抑制作用没有显著影响,但是在较低浓度时,抑制作用较EVO单药有显著提高。图D显示EVO-CQ-Lips对MCF-7细胞的生长抑制作用显著高于游离CQ联合EVO组,差异具有统计学意义(P<0.05),并且在EVO为50 μM时,抑制作用即达到80%以上,并且EVO-CQ-Lips能达到EVO及CQ的协同递送,更有利于体内应用,结果如表5所示。
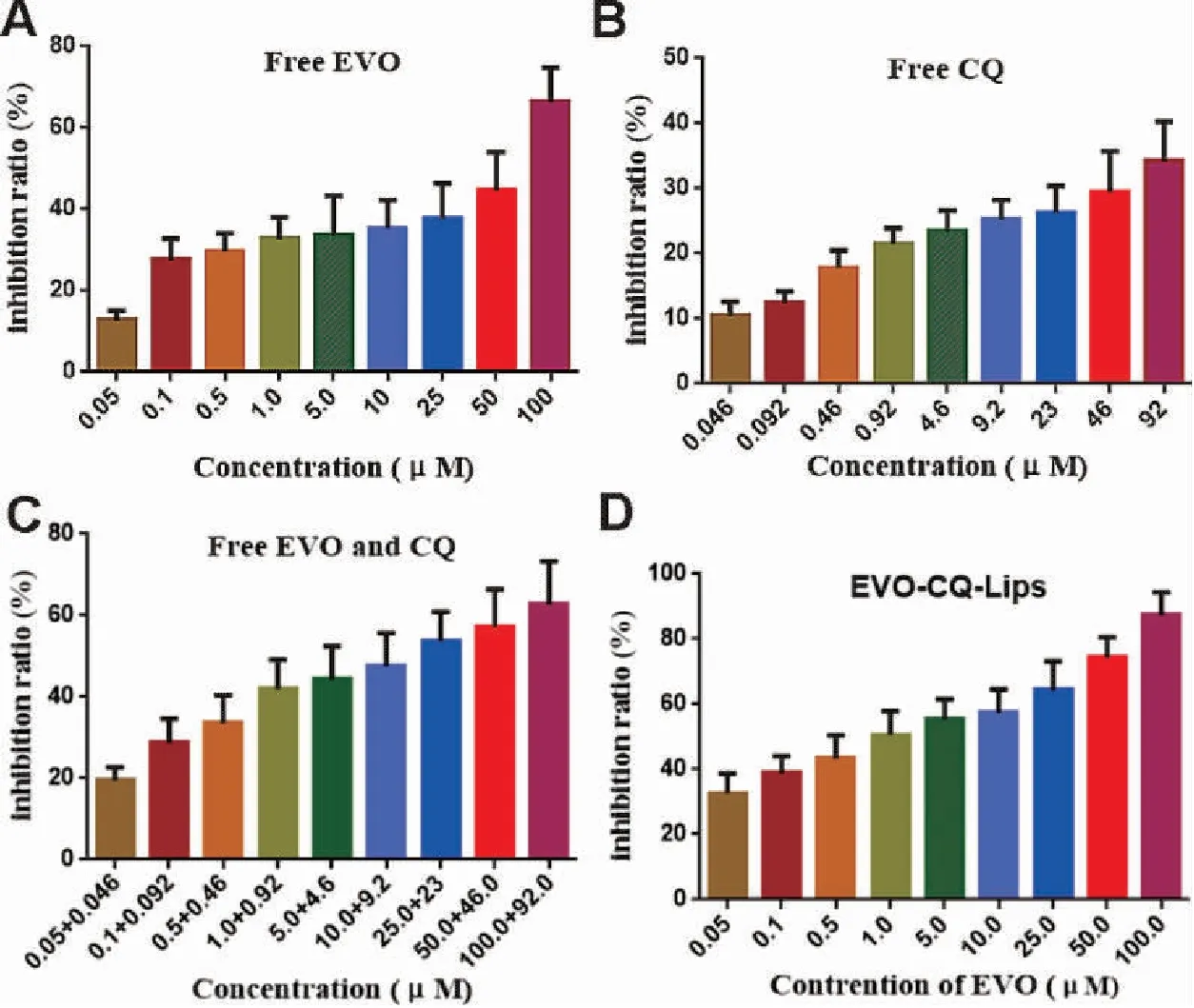
图6. MCF-7细胞长抑制率图(N=6)
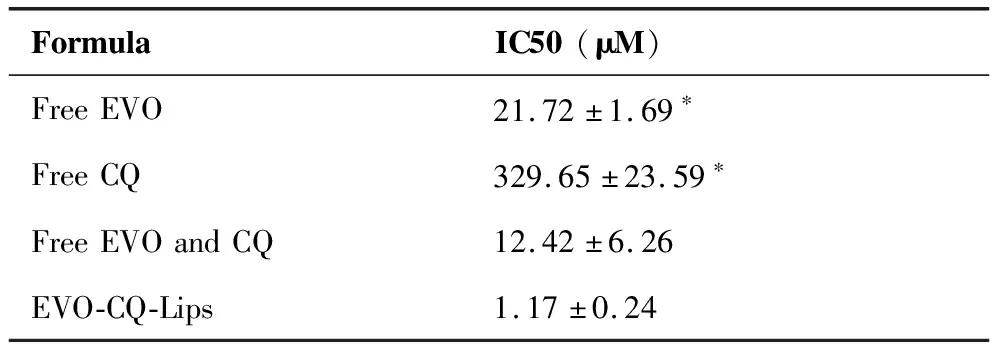
表5 游离EVO、游离CQ及EVO-CQ-Lips对乳腺癌细胞的IC50值(N=5)
结果表明,EVO-CQ-Lips较游离EVO及CQ具有更强的体外乳腺癌增殖抑制作用,可能与脂质体包载后显著提高药物溶解性有显著关系。
3.6 细胞活死染色结果
由图7可见,随着纳米粒药物浓度增加,钙黄绿素着色细胞量显著减少,表明活细胞急剧减少,而PI着色的凋亡细胞核荧光逐渐增强,表明死细胞数量显著增加。因而表明纳米粒对MCF-7细胞具有显著的杀伤作用。
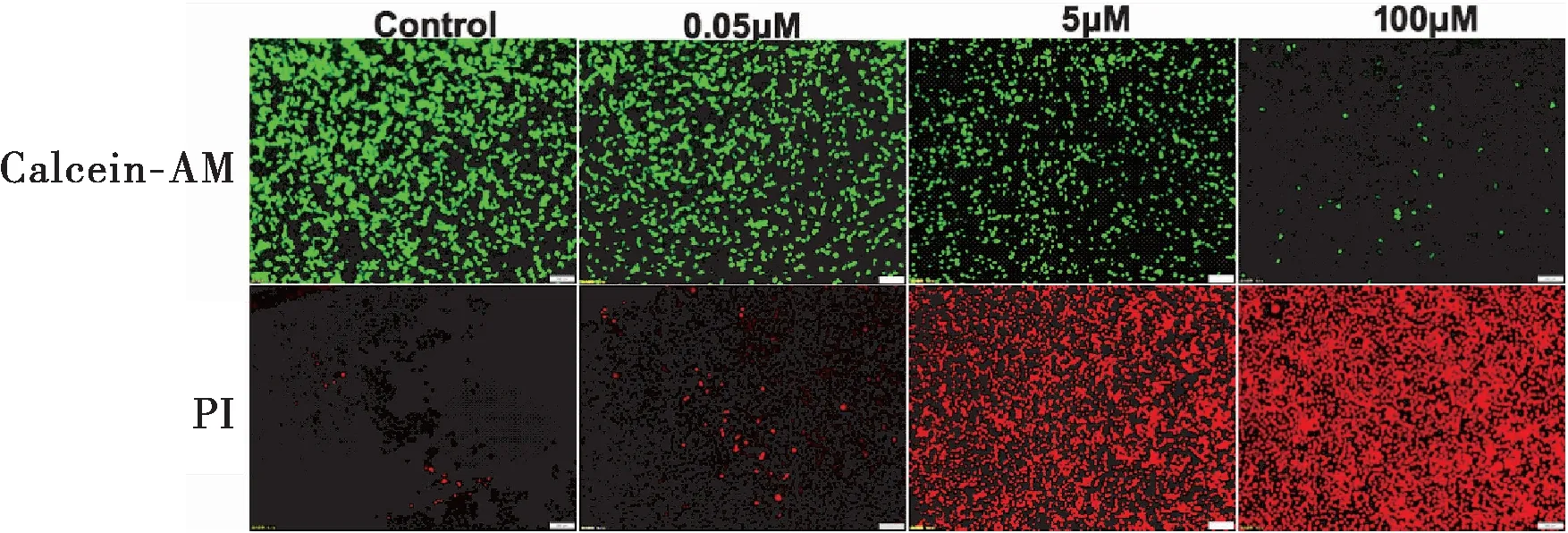
图7 不同浓度EVO-CQ-Lips对MCF-7细胞活死染色结果
4 讨 论
吴茱萸碱EVO具有保护心脏、抗炎、镇痛、抗老年痴呆等药理活性[15-16],现代药理学研究结果则表明EVO具有抗癌作用[17]。现在普遍认为自噬在肿瘤发生发展中起促进和抑制的双重作用,在晚期肿瘤细胞中自噬过度激活,抑制氧化应激,启动细胞损伤修复作用,影响抗癌效果[18-19]。磷酸氯喹具有抑制细胞自噬的作用使它成为抗肿瘤治疗研究的热点[20-21]。
由于吴茱萸碱是难溶性药物,水溶性低,体内生物利用度低,磷酸氯喹为水溶性药物,但是其对正常细胞有一定损伤作用。故将其制备成脂质体利用其被动靶向修饰作用可以显著提高吴茱萸碱生物利用度及降低磷酸氯喹毒性。
本研究采用薄膜分散法制备载吴茱萸碱脂质体,再通过硫酸铵梯度法将酸性磷酸氯喹主动包载于载吴茱萸碱脂质体内,制备共载吴茱萸碱及磷酸氯喹的复方脂质体。通过处方优化所制备最优处方粒径为(170±6.24)nm,EVO的包封率为59.22%±4.52%、载药量6.59%±1.38%,CQ的包封率为76.29%±1.02%、载药量10.03%±0.31%;外观形态由于脂质体囊泡而非实体纳米球,故为不光滑类球形,体外稳定性及释放性能良好;乳腺癌细胞体外增殖抑制试验显示该复方脂质体较单独使用同浓度游离药物对肿瘤细胞具有良好的杀伤效果。并且由人肾胚细胞HEK293毒性研究结果显示,纳米粒对正常细胞毒性较低,可在体内实现安全递送。因此本研究成功制备载吴茱萸碱及磷酸氯喹脂质体,并获得良好的体外抑瘤效果。该脂质体可共同包载CQ及EVO,提高两者生物利用度,并且由于其粒径<200 nm,可通过肿瘤高通透滞留效应,将EVO及CQ被动靶向递送于肿瘤部位,有望在体内进一步获得优异的治疗效果,值得进一步研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

