同侧小体积肾及肾上腺肿瘤一期手术16例体会
高翔, 刘佳文, 冯登元, 谭若芸, 易小敏
小体积肾肿瘤(small renal mass,SRM)是指肿块最大径4 cm以内的肾肿瘤[1]。随着影像学技术的进步和人民健康意识的增强其检出率逐年增加。SRM最大径与恶性肿瘤占比密切相关;最大径<1 cm的SRM恶性占比为53.8%,而最大径3 cm~4 cm的SRM恶性肿瘤占比高达80.1%;尽管最大径3 cm~4 cm SRM中的恶性肿瘤占比较高,但其3年的转移风险仅为2%[2]。肾部分切除术已成为SRM的主要术式,患者术后10年生存率甚至优于开放手术时代的根治性肾切除术;腹腔镜下肾部分切除手术的肿瘤学预后与根治性肾切除手术无差异[3]。因此,腹腔镜下肾部分切除手术逐渐成为SRM的首选治疗方式。文献报道1%~7%的患者在完善肾肿瘤影像学检查时发现同侧肾上腺肿瘤,其中无功能肿瘤占比约75%,有功能肿瘤约21%,仅4%提示肾上腺恶性肿瘤[4]。当影像学检查发现肾肿瘤合并同侧肾上腺肿瘤时,既往着重考虑肾癌伴肾上腺转移并按晚期肾癌进行治疗,我们发现部分患者实为肾肿瘤合并非转移性肾上腺肿瘤。本文回顾分析南京医科大学第一附属医院收治的同侧SRM合并肾上腺肿瘤一期行后腹腔镜肾及肾上腺部分切除手术患者的临床资料,报道如下。
1 资料与方法
1.1 临床资料 2010年9月至2021年11月我院泌尿外科共收治16例同侧SRM合并肾上腺肿瘤患者,均一期行后腹腔镜肾部分及肾上腺部分切除手术,其中男性6例,女性10例;年龄(30.0~73.0)岁,平均年龄(54.2±12.6)岁;BMI(21.0~35.7)kg/m2,平均(26.4±3.9) kg/m2。患者临床资料详见表1。
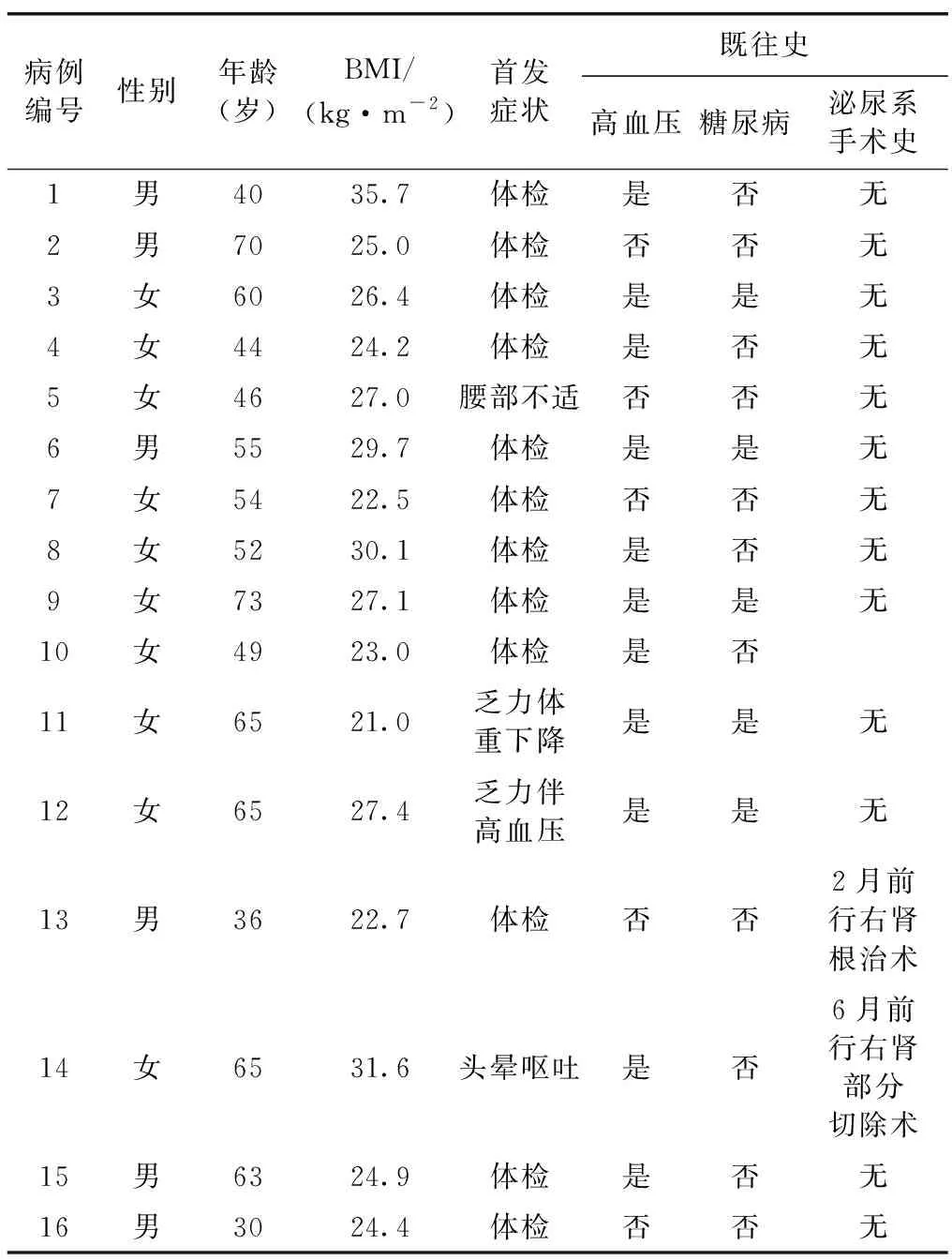
表1 同侧小体积肾肿瘤合并肾上腺肿瘤患者的临床资料
1.2 方法 收集患者实验室检查结果及影像学资料。记录肾及肾上腺肿瘤位置、大小、手术用时、术中出血量、术中输血量、术后住院时间、手术中转情况、并发症情况、术后病理,术后随访观察有无复发及转移。
2 结果
2.1 实验室及影像学检查 所有患者完善血常规、血生化及肾上腺功能等实验室检查,肿瘤位于左肾14例,右肾2例;肾上极7例,肾中极4例,肾下极4例,1例多发;肾肿瘤直径(0.9~4.0)cm,平均(2.4±1.0)cm;肾上腺肿瘤直径(1.00~4.00)cm,平均(2.0±1.0)cm;术前肌酐(41.2~109.9)μmol/L,平均(63.3±19.4)μmol/L。肾肿瘤及肾功能情况见表2。典型的同侧肾及肾上腺肿瘤CT影像及病理见图1。
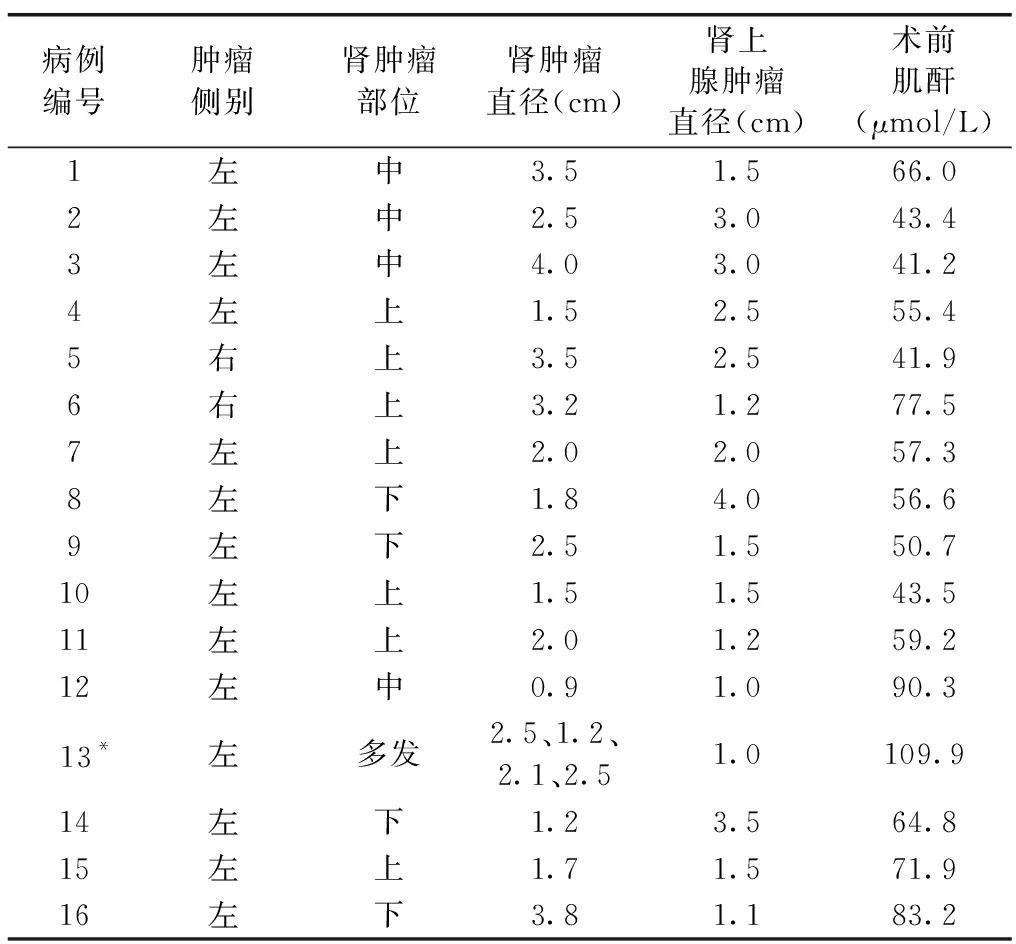
表2 同侧小体积肾肿瘤合并肾上腺肿瘤患者的肿瘤及肾功能情况

1A:泌尿系CT平扫见左侧SRM合并肾上腺肿瘤;1B:泌尿系CT增强动脉期见强化;1C:泌尿系CT增强静脉期强化减退(细箭头示左肾上腺肿瘤,粗箭头示左肾肿瘤);1D:肾上腺肿瘤术后病理为肾上腺皮质腺瘤(HE染色×200);1E:肾肿瘤为肾极性倒置的乳头状肿瘤(HE染色×200)图1 同侧肾及肾上腺肿瘤影像及病理资料(病例15)
2.2 手术及随访情况 16例患者均顺利行一期后腹腔镜肾及肾上腺部分切除手术,无中转开放手术,无输血,其中3例行机器人辅助手术。手术时间(60.0~202.0)min,平均(135.8±41.5)min;术中出血量(20.0~300.0)ml,平均(127.5±93.0)ml;术后住院(4.0~17.0)d,平均(7.0±3.5)d;术后肌酐(44.5~116.6)μmol/L,平均(71.0±20.0)μmol/L。例1患者因术后发热致住院时间延长,血尿培养未见明确病原菌;围手术期无严重并发症发生。16例肾肿瘤病理中12例透明细胞癌,1例嫌色细胞癌,1例极性倒置的乳头状肾肿瘤,2例肾错构瘤。16例肾上腺肿瘤病理中15例皮质腺瘤,1例嗜铬细胞瘤。肾透明细胞癌合并肾上腺皮质腺瘤最常见,占比68.75%。门诊随访1~90个月,平均22个月,行B超或CT检查,均无复发或转移,见表3。
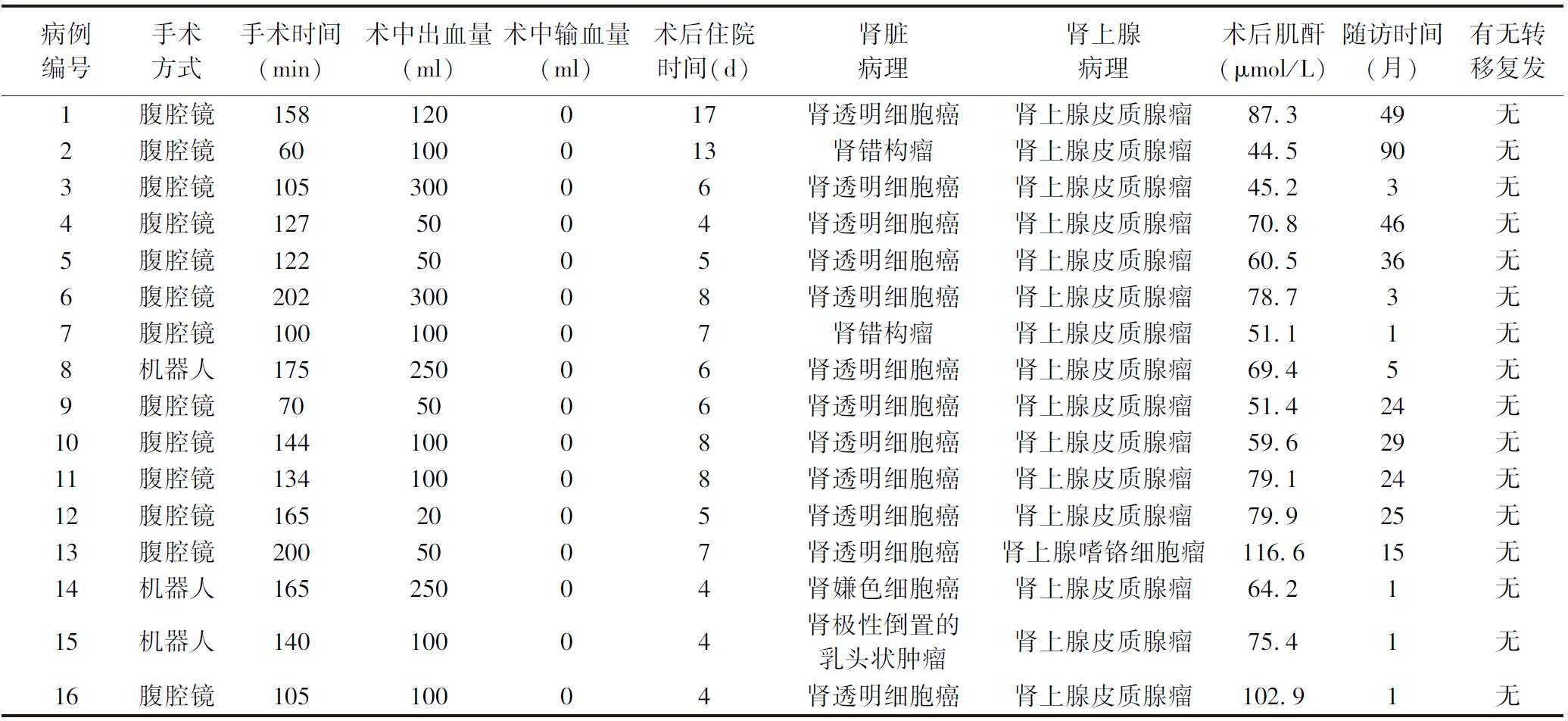
表3 同侧小体积肾肿瘤合并肾上腺肿瘤患者的手术及随访结果
3 讨论
肾肿瘤合并肾上腺肿瘤临床较为少见,应注意结合患者病史及影像学检查分析肾上腺肿瘤是否为肾癌转移,但肾癌仅是肾上腺转移性肿瘤的第4大来源,且现有观点认为非肾上极的肾癌行根治性肾切除手术时,可保留同侧肾上腺[5-6]。国内外均有研究显示合并同侧肾癌的肾上腺肿瘤多为肾上腺的原发良性肿瘤[7-8]。肾肿瘤最大径<4 cm及增长速度<0.5 cm/年时,其转移风险较低。接受主动监测的70例SRM患者随访3年的数据显示,肿瘤增长速度仅0.25 cm/年;其中1/3患者肿瘤直径无变化,也未见肿瘤转移[9]。同时出现SRM与肾上腺肿瘤的可能原因为二者胚胎发育起源不同;中胚层起源的肾上腺皮质与间介中胚层起源的后肾发育成为肾脏的过程中,除位置毗邻外,两者的血液及淋巴液回流并无明显交通,SRM较低的转移风险也使其不易出现肾上腺转移[7]。本研究结果显示肾肿瘤合并肾上腺肿瘤时,肾上腺肿瘤可为原发良性肿瘤,对于这类患者是否同时进行外科干预值得探讨。
肾上腺肿瘤外科治疗的指征包括肾上腺恶性肿瘤、有功能的肾上腺肿瘤及直径>3 cm的无功能肾上腺偶发瘤[10],后腹腔镜肾上腺肿瘤切除术已成为肾上腺肿瘤治疗的首选。由于肾上腺肿瘤多为良性肿瘤,完整切除肿瘤即可达到良好的治疗效果;肾上腺肿瘤行腹腔镜肾上腺部分切除与肾上腺全切的对比分析结果表明两者疗效等同,而肾上腺部分切除的患者无需进行激素替代治疗[11]。肾上腺肿瘤行肾上腺部分切除术有利于保留残留肾上腺内分泌功能,减少术后出现内分泌功能紊乱和终身激素替代的风险[12]。有报道显示寂静性肾上腺嗜铬细胞瘤的影像学表现不典型且无明显症状,易被误诊为无功能腺瘤[13]。少数的良性肾上腺肿瘤也有恶变潜能。王俭等[14]报道1例52岁男性患者因右肾上腺肿瘤行肾上腺肿瘤切除术,病理为皮质腺瘤;术后一年半因复查内分泌功能异常,查MRI示右侧肾上腺区多发结节,再次手术切除后病理为肾上腺腺癌。因此,我们认为对于影像学检查发现的肾肿瘤合并肾上腺肿瘤患者,即使肾上腺功能检查提示为无功能腺瘤,也应与肾肿瘤一期手术切除并密切随访。后腹腔入路手术对肠道干扰小,术后胃肠道功能恢复快,泌尿外科医生较为熟悉,是同期手术的理想术式[15]。同期进行的肾上腺手术既可明确肿瘤病理类型,也可减少因肾上腺肿瘤继续进展而需再次手术处理的风险;这类患者再次手术时难选后腹腔入路,因后腹腔入路的肾部分切除手术破坏解剖层次及术区粘连,明显增加肾上腺肿瘤切除的手术难度和风险。
SRM多因例行体检或伴随疾病行影像学检查发现,患者常无明显不适症状,可选治疗方式有主动监测、外科手术及消融治疗。2019年Andrews等的研究结果显示,1 422例SRM接受肾部分切除手术患者5年无病存活达97.4%,而180例射频消融为94.5%,187例冷冻消融为93.4%[16]。腹腔镜手术具有创伤小、并发症少、住院时间短、恢复快的特点[6]。在腹腔镜肾部分切除手术成熟开展的医疗中心,SRM常推荐行腹腔镜保留肾单位手术治疗。对于特殊类型肾肿瘤及重度肥胖患者,如孤立肾肾肿瘤、肾内型肿瘤或肾门部肿瘤或伴静脉癌栓的肾肿瘤,普通腹腔镜手术处理难度较大,而机器人辅助腹腔镜手术拥有较大优势。达芬奇机器人3D视野清晰、图像多倍放大、机械臂操作稳定且灵活,具有人手无法比拟的多向自由活动度,在肾肿瘤切除及肾脏创面缝合中相比普通腹腔镜手术更为精准可靠,可减少肾脏热缺血时间、最大限度保护残留肾功能、缩短住院时间[17-18],尤其适用于特殊类型肾肿瘤或BMI>30 kg/m2的肥胖患者[19]。本研究中的2例BMI>30的肥胖患者行机器人辅助腹腔镜手术效果满意。
腹腔镜下肾和肾上腺的一期手术仅有数篇文献报道。Schwartz等[20]介绍3例腹腔镜肾上腺切除术联合肾脏手术——肾切除手术、肾囊肿切除术和肾肿瘤冷冻消融治疗。Panek等[21]报道1例72岁女性发现SRM合并同侧肾上腺肿瘤,患者顺利行腹腔镜肾部分及同期肾上腺切除手术,术后4 d出院,术后病理示肾癌及肾上腺皮质腺瘤。Sharma等[22]报道1例62岁女性发现左肾复杂囊肿(BosniakⅡF)及左肾上腺肿瘤,行机器人辅助一期后腹腔镜手术,手术耗时120 min,术后3 d出院,术后病理为出血性肾囊肿及肾上腺皮质腺瘤。 Gul等[23]报道一例42岁女性肾上腺嗜铬细胞瘤侵犯肾上极肾实质,完善术前准备后患者顺利完成机器人辅助肾部分切除及肾上腺切除手术。Maurya等[24]将腹腔镜下肾上腺切除、肾根治性切除及输尿管切开取石的单一术式与联合术式进行对比,结果显示肾及肾上腺联合手术组与肾脏手术的手术耗时接近,术中出血及术后恢复均无差异,麻醉监测患者的呼气末CO2水平也无差异,肾及肾上腺同期手术的优点在于单次麻醉和一次住院处理两种病变,且并没有明显增加手术难度。我院收治的16例肾肿瘤合并肾上腺肿瘤患者,均顺利行后腹腔镜肾部分联合肾上腺部分切除术,手术出血少,围手术期无严重并发症,术后长期随访无转移及复发,这表明一期后腹腔镜肾及肾上腺部分切除手术安全有效。
综上所述,笔者认为对同侧SRM合并肾上腺肿瘤的患者,可一期行后腹腔镜肾及肾上腺部分切除手术,一期手术并未明显增加手术难度,手术安全有效,还可减轻患者因肾上腺肿瘤未处理引发的思想负担,但术后需注意严密随访。本研究存在一定局限性,为回顾性研究,例数偏少,缺乏对照,缺乏远期生存随访。

