尼妥珠单抗联合TP方案诱导化疗并序贯同期放化疗治疗局部晚期鼻咽癌的疗效、不良反应及预后因素
吕科友 刘肃静 李红伟 马 照 姜 伟 徐 波 宋轶鹏
1 滨州医学院 山东 烟台 264003; 2 烟台毓璜顶医院放疗科 山东 烟台 264000;3 潍坊市立医院 山东 潍坊 261023;4 青岛大学医疗集团临朐医院放疗科 山东 潍坊 262600
鼻咽癌是起源于鼻咽粘膜上皮的恶性肿瘤,对放射线敏感,早期单纯行放疗即可实现临床治愈。由于其发病隐匿,患者就诊时多已处于中晚期[1]。目前,以放疗为基础的放化疗联合靶向及免疫的综合治疗是局部晚期鼻咽癌的重要治疗模式,而诱导化疗能够创造更好的放疗条件,并可降低转移的风险[2]。贝叶斯网络荟萃分析[3]调查了三种常用诱导化疗方案TPF(多西紫杉醇,顺铂和5-氟尿嘧啶)、TP(多西紫杉醇和顺铂)、PF(顺铂和5-氟尿嘧啶)的疗效和毒性,结果表明TPF、TP和PF方案成为最佳诱导方案的概率分别为49.61%、47.45%和1.57%。TPF方案比TP方案增加了粘膜反应,比PF方案增加了血液毒性的发生率。因此,本研究选用高效、低毒的TP方案作为诱导化疗方案。分子生物学研究发现,表皮生长因子受体(EGFR)在鼻咽癌中属于高表达[4],鼻咽癌细胞膜上的 EGFR 可越过传统信号通路,直接转运入细胞核,促进鼻咽癌的发生、发展[5-6]。近年来,特异性强、副反应轻的靶向药物尼妥珠单抗成为治疗局部晚期鼻咽癌的热点。然而,目前尼妥珠单抗联合诱导化疗治疗局部晚期鼻咽癌的文献报道甚少,与TP方案联合诱导治疗的研究尚未见报道。鉴于此,本研究应用尼妥珠单抗与TP方案组成联合诱导治疗方案,与TP方案比较,探讨其在治疗局部晚期鼻咽癌的疗效、不良反应及预后因素。
1 资料与方法
1.1 病例选择 病例来源于烟台毓璜顶医院2017年1月至2020年6月收治的局部晚期鼻咽癌患者。入选标准:①年龄18~70岁;②原发灶活检首次病理诊断为鼻咽鳞癌;③临床分期为Ⅲ~Va期(鼻咽癌UICC/ AJCC分期)(2017年第8版);④KPS评分≥70分;⑤预计总生存期大于6个月;⑥签署知情同意书。排除标准:①既往诊断为恶性肿瘤或合并其它恶性肿瘤病史;②既往接受过放疗、化疗或靶向治疗;③存在放疗、化疗禁忌证;④对治疗方案中任意药物存在过敏;⑤治疗前存在肝肾功能异常,血象异常,或合并其它器质性病变;⑥孕妇或处于哺乳期;⑦有远处转移的患者;⑧有不可控制的感染者;⑨有精神疾病或依从性差的患者。最终符合标准的局部晚期鼻咽癌患者68例。
1.2 治疗方法 符合标准的鼻咽癌患者分为两组。观察组:接受尼妥珠单抗联合TP方案诱导化疗(尼妥珠单抗注射液200 mg,静脉滴注,每周1次;多西他赛根据患者体表面积按75 mg/m2给量,静脉滴注紫杉醇脂质体135 mg/m2,静脉滴注,每3周1次;奈达铂80 mg/m2,静脉滴注顺铂75 mg/m2,静脉滴注,每3周1次)。对照组:接受TP方案诱导化疗(多西他赛75 mg/m2,静脉滴注紫杉醇脂质体135 mg/m2,静脉滴注,每3周1次;奈达铂80 mg/m2,静脉滴注顺铂75 mg/m2,静脉滴注,每3周1次)。诱导治疗2或3次后,行顺铂化疗(顺铂40 mg/m2,静脉滴注,每周1次,共6次)加同期的调强放疗(IMRT)。所有患者的IMRT治疗,根据磁共振(MRI)确定肿瘤范围,在增强CT上勾画靶区、计划设计。采用6MV X射线调强放疗技术,逆向调强计划设计并优化放疗方案。放疗剂量:原发肿瘤(PGTVnx)69.96 Gy~71.28 Gy/33f、颈部淋巴结(PGTVnd)66 Gy/33f,可见病灶+上颈淋巴引流区(PTV1)60.06 Gy/33f,下颈淋巴引流区(PTV2)50 Gy~52.8 Gy/33f,每周5次,共6~7周。根据放射治疗协作组 (RTOG) 0615 RTOG 0225 的要求进行危及器官限制剂量和计划评估。
1.3 评价标准 按实体瘤疗效评价标准 (RECIST 1.1版)进行评价,具体标准如下:完全缓解(CR),所有靶病灶消失,全部病理淋巴结短直径必须减少至<10 mm,至少维持4周(总反应评价时原升高的肿瘤标志物必须恢复正常);部分缓解(PR),靶病灶直径总和减少至少30%,至少持续4周;疾病进展(PD),靶病灶直径总和增加至少20%,或出现新病灶;疾病稳定(SD),靶病灶减小没达到PR,增加的程度也没达到PD水平,介于两者之间。总有效率(RR)=(CR+PR)例数/总例数×100%。在治疗结束后1个月进行影像学检查(CT或MR)评价肿瘤消退情况,之后第1、2年复查频率3个月1次,第3、4、5年复查频率6个月1次,第6年开始复查频率1年1次。参照RTOG急性、晚期放射反应评分标准进行放疗急性、晚期不良反应评价;按照美国国立癌症中心(NCI-CTC 3.0版)常见毒性标准观察记录,分为0~IV级。
1.4 随访 采用门诊复查、病例回顾、电话询问联合方式随访,截止日期为2021年3月31日,随访时间 9个月至50个月,中位随访时间23个月。其中观察组2例失访,对照组3例失访,共5例失访。
1.5 统计学方法 采用SPSS 21.0软件进行数据分析,定性资料之间差异比较采用卡方检验,理论频数小于5的采用Fisher确切概率法。采用Kaplan-Meier生存曲线分析两组患者的OS、PFS。以Cox回归模型进行多因素分析。检验水准α=0.05。
2 结果
2.1 临床资料 共纳入68例局部晚期鼻咽癌患者,其中观察组32例、对照组36例。所有患者年龄为18~70岁,中位年龄53岁;男51例,女17例,男∶女=3∶1;Ⅲ期33例,Ⅳa期 35例;非角化鳞癌22例,未分化鳞癌3例,低分化鳞癌31例,其它分化鳞癌12例;诱导治疗2周期的11例,3周期的57例。两组患者的年龄、性别、临床分期、病理类型、诱导治疗周期数等基线特征差异均无统计学意义,具有可比性。见表1。
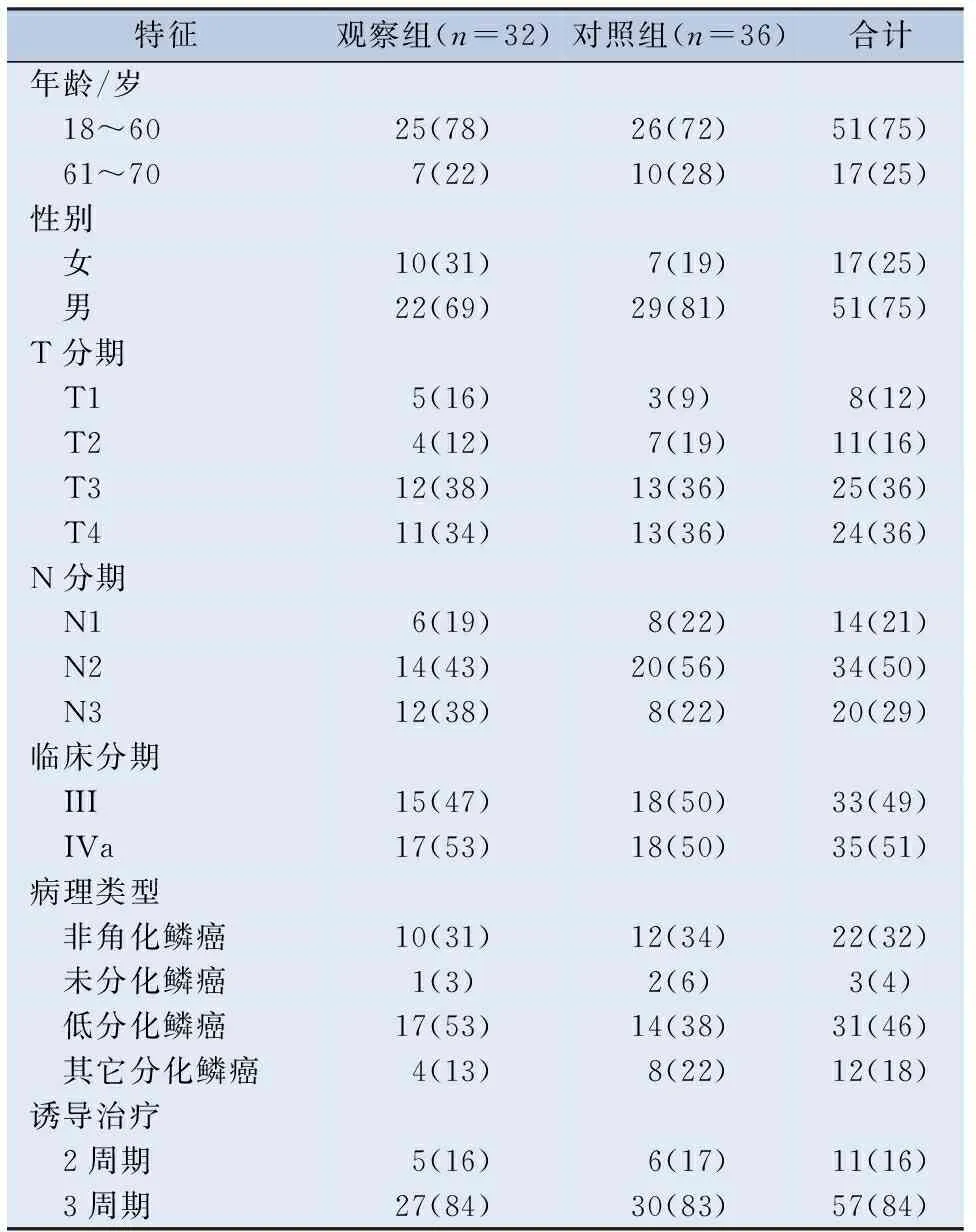
表1 两组患者临床特征参数比较/[n(%)]
2.2 近期疗效
2.2.1 诱导治疗后原发灶疗效评价 观察组原发灶CR 2例,PR 25例,原发灶有效率84.4%(CR+PR);对照组原发灶CR0例,PR 27例,原发灶有效率75.0%。诱导治疗后原发灶疗效两组比较,差异无统计学意义(P=0.34),见表2。
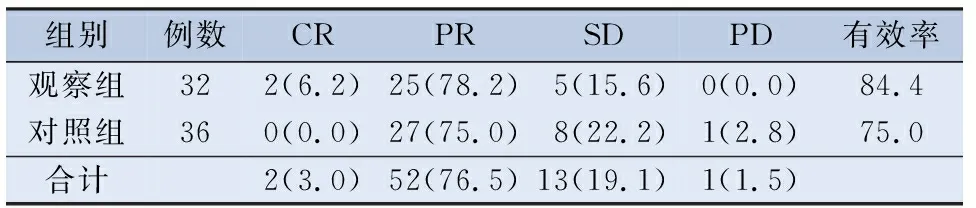
表2 诱导化疗后原发灶疗效比较/[n(%)]
2.2.2 诱导治疗后颈部淋巴结疗效评价 观察组颈部淋巴结CR 1例,PR 28例,颈部淋巴结有效率90.6%(CR+PR);对照组颈部淋巴结CR 0例,PR 25例,颈部淋巴结有效率70.0%。颈部淋巴结有效率高于对照组,差异有统计学意义(P=0.031),说明观察组治疗方式对颈部淋巴结有较高的缓解率。见表3。
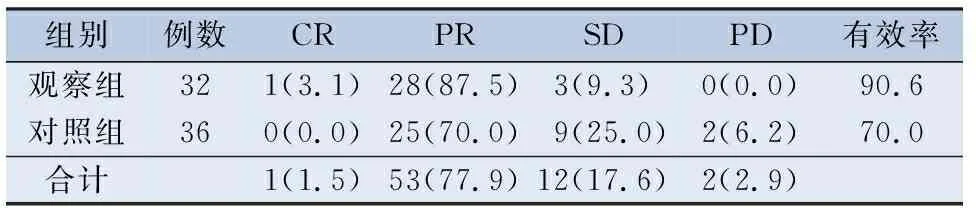
表3 诱导化疗后颈部淋巴结疗效比较/[n(%)]
2.2.3 诱导治疗后近期总体(原发灶和颈部转移淋巴结)疗效评价 观察组CR 1例,PR 28例,有效率90.6%(CR+PR);对照组CR 0例,PR 27例,有效率75.0%。诱导治疗后近期总体疗效两组比较,差异无统计学意义 (P=0.092)。见表4。
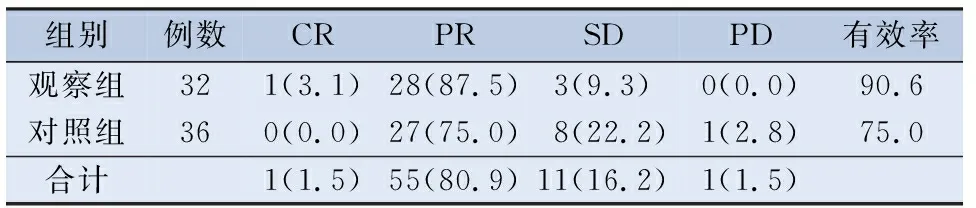
表4 诱导化疗后总体疗效比较/[n(%)]
2.2.4 全程治疗完成后总体疗效评价 观察组CR 19例,PR 10例,有效率90.6%(CR+PR/总例数);对照组 CR 18 例,PR 11例,有效率80.6%。全程治疗完成后总体疗效两组比较,差异无统计学意义(P=0.408)。见表5。
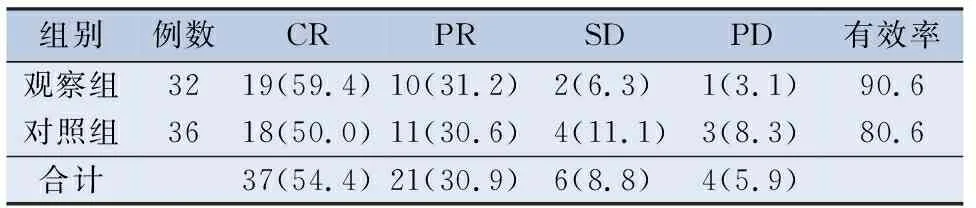
表5 全程治疗完成后总体疗效比较/[n(%)]
2.3 不良反应 患者的不良反应主要为诱导治疗阶段产生的恶心呕吐、白细胞降低、皮疹、肝功能异常等,两组差异无统计学意义(P均大于0.05),见表6。这表明,联合尼妥珠单抗诱导治疗未明显增加不良反应。同期放化疗阶段,两组患者恶心呕吐、白细胞降低、血小板降低、肝肾功能异常、口腔黏膜炎、放射性皮炎、口干、听力下降、张口受限对比,两组差异也无统计学意义(P均大于0.05),见表7。
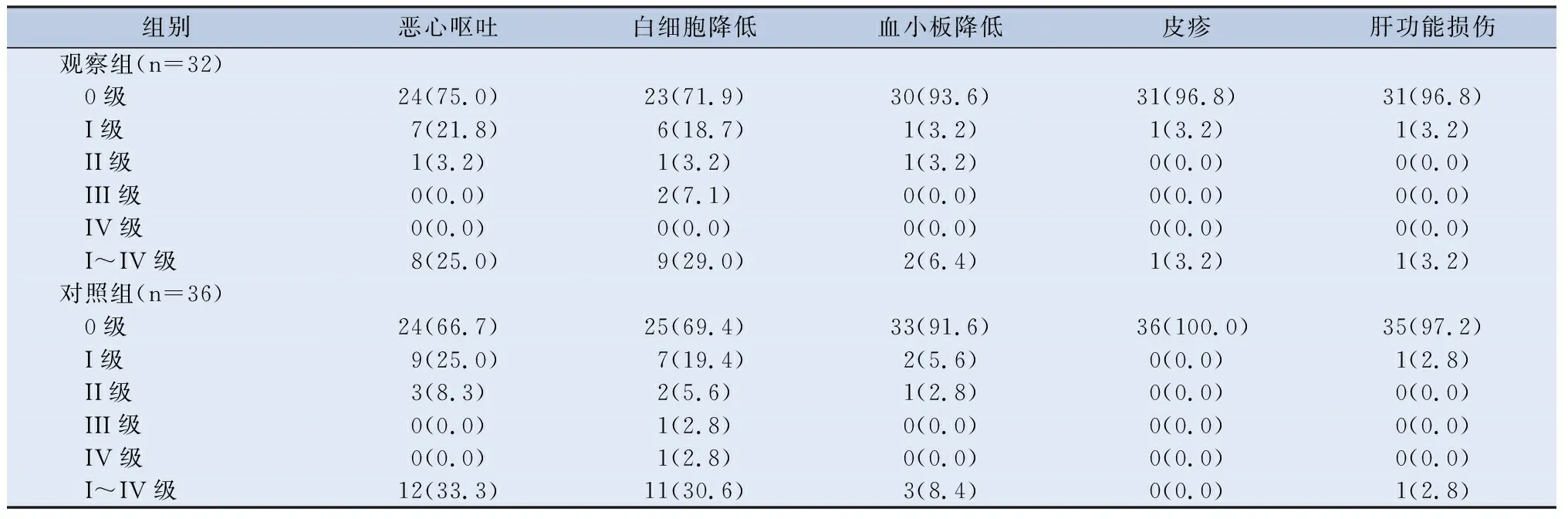
表6 诱导化疗阶段毒副反应对比/[n(%)]
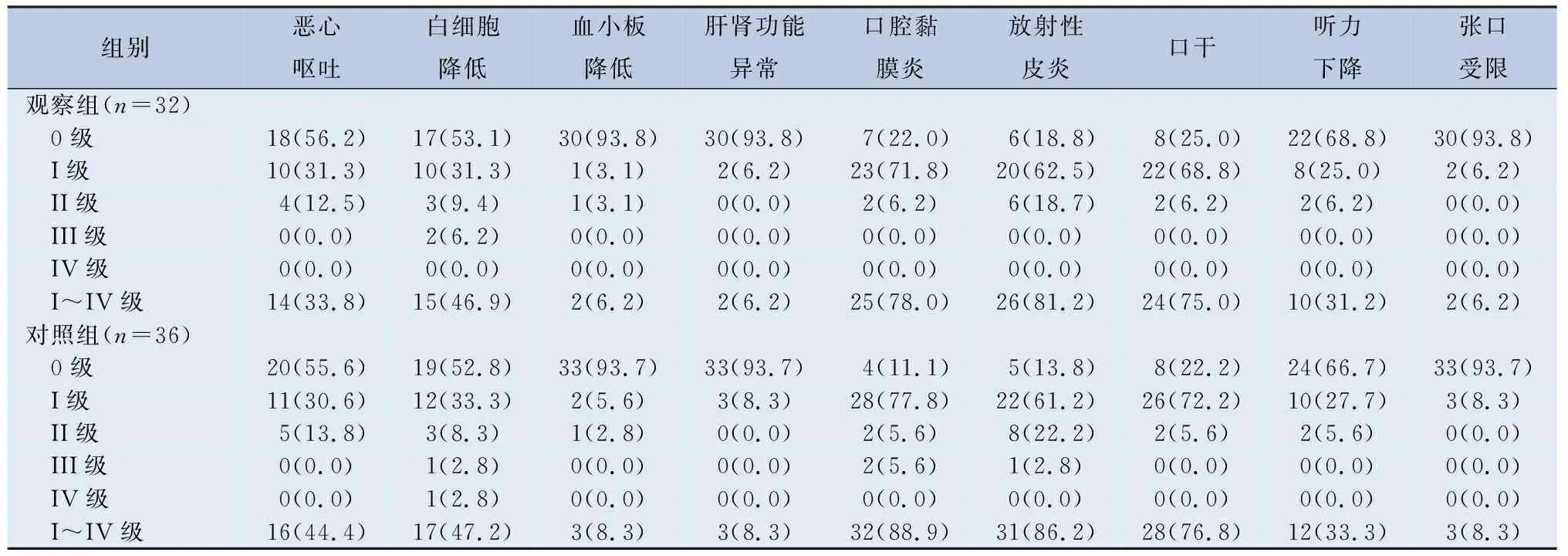
表7 同期放化疗阶段及远期毒副反应对比/[n(%)]
2.4 远期疗效
2.4.1 两组患者生存情况分析 截至随访统计时间,观察组死亡1例,对照组死亡4例,其余均生存。两组患者生存曲线整体比较Log Rank单因素分析,χ2=0.598,P=0.439,差异无统计学意义。见图1。
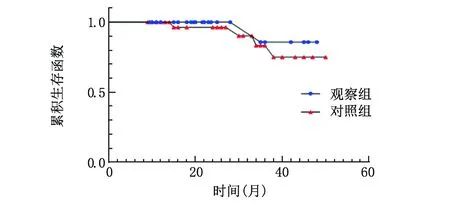
图1 两组患者生存情况比较
2.4.2 两组患者无进展生存情况分析 观察组共4例进展,其中2例复发(包括原发灶或颈部淋巴结复发),1例肺转移,1例骨转移;对照组共10例进展,其中4例复发,3例肺转移,3例骨转移。对两组患者无进展生存曲线整体比较的Log Rank(mantel-cox)单因素分析,χ2=2.237,P=0.135,差异无统计学意义。见图2。
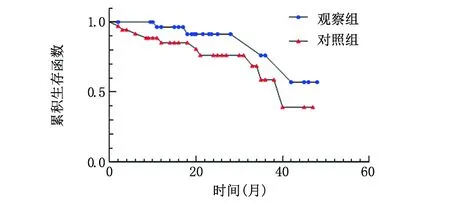
图2 两组患者无进展生存情况比较
2.4.3 影响局部晚期鼻咽癌预后的多因素分析 以局部晚期鼻咽癌患者预后为因变量,性别、年龄、临床分期、治疗方式、诱导周期数为自变量,对两组局部晚期鼻咽癌患者的无进展生存时间进行Cox多因素回归模型分析。结果发现,局部晚期鼻咽癌Ⅳa期患者发生疾病进展的风险是Ⅲ期的3.844倍,未加尼妥珠单抗治疗的患者发生疾病进展的风险是加尼妥珠单抗的3.857倍。这表明,临床分期较晚(Ⅳa期)和治疗中未加尼妥珠单抗是局部晚期鼻咽癌发生发展的独立危险因素。见表8。

表8 影响局部晚期鼻咽癌患者预后的多因素分析
3 讨论
鼻咽癌是我国广东珠三角区域最为常见的恶性肿瘤。据WHO国际癌症研究机构(International Agency for Cancer,IARC) 数据显示,全世界约40%的患者发生在中国,且大部分在确诊时已出现颈部淋巴结或血行转移[7-8]。由于鼻咽癌对放疗敏感,早期普遍采用以放疗为主的治疗方案[9],局部晚期鼻咽癌单纯放疗效果欠佳,5年生存率仅为35%左右,推荐采用放化疗为主的综合治疗[10]。
目前,诱导化疗、同期放化疗、辅助化疗、靶向治疗等在局部晚期鼻咽癌的临床治疗中应用越来越广泛[11-13]。多项研究[14-15]表明,诱导化疗联合放疗可显著降低局部晚期鼻咽癌局部复发以及远处转移的风险,可获得长期生存。还有研究[16]发现,诱导化疗联合同期放化疗,既能减轻放疗毒副反应,也显著提高5年疾病特异性生存期(DSS)、无局部复发生存时间(LRFS)、无区域复发生存时间(RRFS)、无远处转移生存时间(DMFS)。诱导化疗作为放疗前使用的化疗,可杀灭潜在的亚临床转移灶,并减轻肿瘤负荷,与放疗后辅助化疗相比,具有更好的顺应性[17]。
尼妥珠单抗是一种IgG1人源化单克隆抗体,针对阻断与其配体结合的EGFR胞外区,具有独特的药效学特性,可以长期治疗患者,且毒性低,基于其临床疗效,尼妥珠单抗已被古巴和国外批准用于治疗不同的上皮性肿瘤[18]。2009年尼妥珠单抗进入NCCN头颈部肿瘤指南中国版。有学者[19]对730 例采用综合治疗的局部晚期鼻咽癌患者回顾性研究发现,联合使用了尼妥珠单抗的184 例患者5年总生存率明显提高。另有多中心研究[20]显示,与单纯放疗比较,尼妥珠单抗联合放疗显著提高了局部晚期鼻咽癌患者的总生存率。
综上,对于局部晚期鼻咽癌,观察组诱导治疗具有更好的颈部淋巴结缓解率,且在诱导治疗和同期放化疗阶段不良反应未明显增加,安全性较高;治疗方式和临床分期是影响局部晚期鼻咽癌预后的独立因素。由于本研究纳入的病例数相对较少,结果可能会存在偏倚。其次,本研究随访时间相对较短,两组之间的生存差异未能显著突出,需要更长时间的随访以明确其远期疗效。

