非梗阻性无精子症患者睾丸显微取精技术新探11例
仕治达 陶国振 伍玲园 盛连兵 董芳地 杨慧军 邱毅
男性不育症中无精子症约占5%~10%[1-2]。 来自美国的调查数据显示,无精子症中60%为非阻塞性无精子症(non-obstructive azoospermia,NOA)[3]。随着卵细胞胞质内单精子注射(intracytoplasmic sperm injection,ICSI)的广泛使用,显微切开睾丸取精术 (Microdissection testicular sperm extraction,M-TESE)也愈发成为NOA的主要取精方式,并使许多男性NOA不育患者使用M-TESE结合ICSI-IVF生育了自己生物学子女。最近研究报道[4-5],通过 M-TESE 可显著提高NOA 患者手术获精概率。目前山东地区显微取精病例报道较少,本文就这方面病例报告如下。
资料与方法
1.临床资料:2018 年1~12月在山东省妇幼保健院生殖医学中心接受M-TESE的NOA 患者共 11例,11例男性不育症患者年龄22~37岁,平均年龄(32.4±4.5)岁;不育年限2~10年,平均(5.2±3.1)年,其中睾丸发育不良5例,克氏综合征2例,Y染色体AZFc、d缺失1例(sy254、sy255、sy145、sy152),睾丸炎(病毒性腮腺炎并双侧睾丸炎)并微结石1例,隐睾术后1例(双侧隐睾,15岁手术),特发性无精子症(睾丸大小正常)1例。患者至少3次精液常规检查并离心沉淀镜检未发现精子,性激素水平、精浆生化、睾丸体积测量(模型法及B超)等检验检查提示为非梗阻性无精子症患者。且排除不射精,逆行射精及未经治疗的低促性腺激素综合征。手术及ICSI方案均获得山东省妇幼保健院生殖医学伦理委员会批准;所有患者术前均签署手术知情同意书。
2.睾丸B超:B超探查双侧睾丸、精索及附睾等。使用彩色三维B超诊断系统,7.5MHz探头探查睾丸、附睾及精索等。睾丸体积(cm3)的计算公式=0.52×长径(cm)×宽径(cm)×厚径(cm)。
3.生殖内分泌激素测定:空腹,常规抽静脉血2 mL。分离血清,即将血样置于37℃水浴箱30 min,待测血液完全凝固后再取出,1 500 rpm/min离心15 min分离血清。取300 uL血清上机,采用化学发光法检测血清卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成激素(luteinizing hormone,LH)、睾酮(testosterone,T),FSH、LH、T试剂购自BECKMAN COULTER公司。
4.术前用药及M-TESE操作:患者术前常规治疗1~2个生精周期,hCG 2 000 iU加HMG 75 iU,3 d一次肌注,加他莫昔芬50 mg每天两次。手术中采用硬膜外麻醉。取阴囊前壁正中切口,逐层切开至睾丸白膜。手术显微镜下放大6倍观察,在睾丸表面无血管区沿睾丸赤道轴切开白膜,显露生精小管。手术显微镜放大6~20倍观察,逐层、分区寻找外观饱满、粗大、乳白色半透明或不透明的生精小管。用显微镊子取出,放入培养液中送胚胎实验室。在体视镜下切碎后,于倒置显微镜下( × 400)寻找精子,精子获得率( sperm retrieval rate,SRR=成功取精例数/总手术例数)。部分患者(包括M-TESE找到精子的患者及未找到精子的患者)取睾丸组织送病理学检查。4-0可吸收线间断缝合睾丸白膜,还纳睾丸并依次缝合阴囊壁。
5.睾丸组织病理学:M-TESE手术中剪取睾丸组织,2%戊二醛和3%多聚甲醛的混合物固定,包埋在甲基丙烯酸乙二醇酯(GMA)中,切片,并用苏木精和曙红(HE)染色。
6.ICSI-IVF-ET:本中心在建立稳定的体外受精胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)基础上,采用控制性超排卵方案并使用显微操作系统,对M-TESE获取精子NOA患者行ICSI术治疗。
7.统计学处理:应用 SPSS17.0 统计软件,采用t检验分析比较手术前后性激素变化。P<0.05为差异有统计学意义。
结果
1. 睾丸B超及组织学观察:B超睾丸体积平均(8.7±6.9)cm3;1例患者B超睾丸内见散在强回声光团,考虑微小结石(图1A),病理切片见白色微小结石(图1B),曲细精管可见少量精原细胞及较多的精母细胞,中心部可见极少量精子细胞,曲细精管见多灶性钙化。M-TESE未见精子者睾丸组织切片内也未见生精细胞及精子,仅见支持细胞(图2A);M-TESE发现精子者,睾丸组织学观察到萎缩的曲细精管,尚有小部分生精细胞(图2B)。
2. M-TESE结果:11 例NOA患者,5例患者成功M-TESE取精,SRR=45.5%。病因分类统计,发现睾丸发育不良3例,睾丸炎并微结石1例 ,AZFc、d 区缺失1例。取精术后3 d出院,11例患者均未发生阴囊皮肤感染、血肿、睾丸萎缩、术后勃起功能下降等并发症。M-TESE结果见表1。
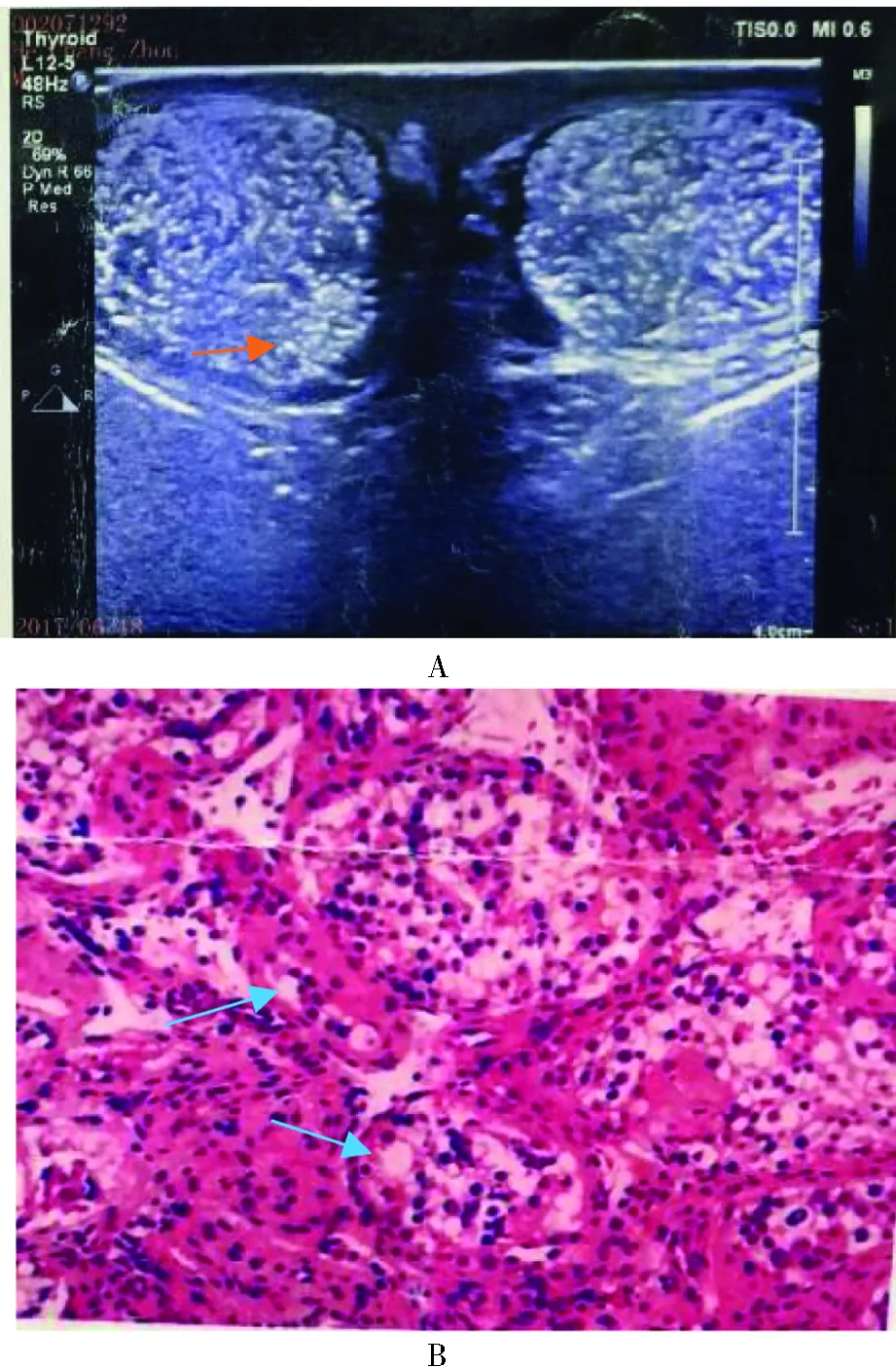
A:睾丸B超,红色箭头所指白色强光团为睾丸微结石;B:睾丸病理,蓝色箭头所指为睾丸微结石(HE染色,放大10×10)。图1 睾丸B超及病理结果
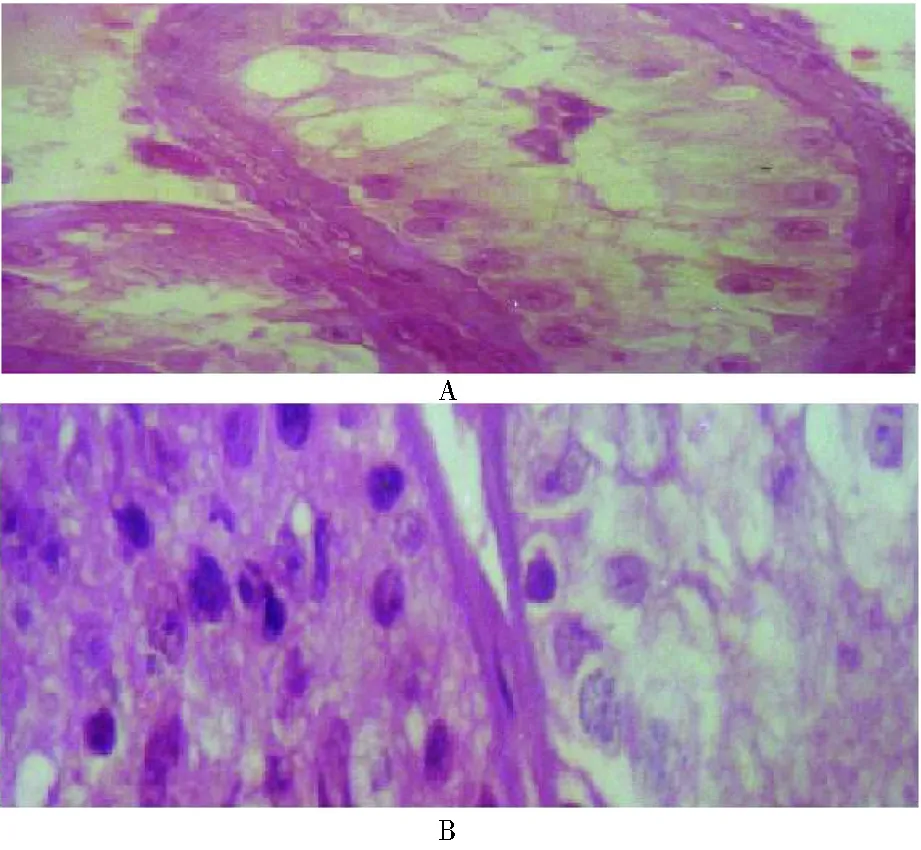
A:睾丸生精功能缺失,曲细精管内仅见支持细胞(OSCS),未见生精细胞及精子;B:部分曲细精管内可见少量生精细胞。图2 睾丸病理(HE染色,高倍10×40)
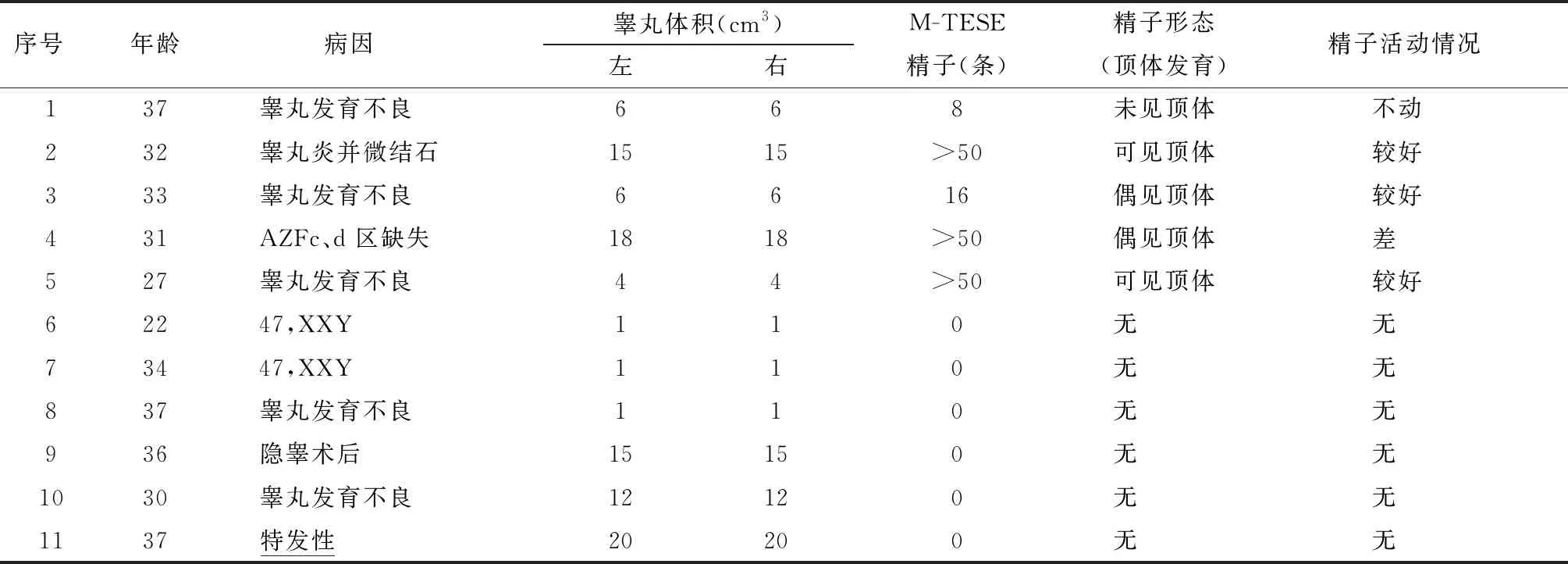
表1 NOA 患者M-TESE情况
3.M-TESE 获得精子患者配偶 ICSI-IVF结果:M-TESE 获取精子的5例患者中,平均获卵数16个,正常受精数9个,可利用胚胎数6个。5例患者均使配偶怀孕,1例AZFc、d 区缺失患者配偶孕3月胚胎停育(未进行胚胎染色体及AZF基因检测),1例睾丸发育不良患者配偶孕1月自然流产(未进行胚胎染色体及基因检测),其余3例患者配偶成功生育4名胎儿,胎儿产前诊断均未见异常。见表2。
4.手术前后生殖内分泌激素变化:FSH、LH、T术后6个月较术前未见明显改变,见表3。
获得精子与未获得精子患者FSH、LH、T差异均无统计学意义,见表4。

表2 NOA 患者M-TESE获精子ICSI情况及妊娠结局(n=5)

表3 NOA患者行睾丸显微取精术前后体内激素水平的变化
讨论
目前认为,NOA发病主要由睾丸生精功能障碍引起的精子发生缺陷,是男性生殖医学中的常见病和疑难病[6]。近年来,随着显微取精技术的发展,认为睾丸生精功能具有局灶性和不均一性。在显微镜放大下观察曲细精管的质量差异,寻找可用精子;联合ICSI-IVF-ET,实现NOA患者孕育具有自己生物学后代的愿望成为现实。本研究11例无精症不育患者,M-TESE后5例取出精子,占45.5%,均获得妊娠,妊娠率100%;2例自然流产;3例成功生育健康婴儿(4胎),正常生育率60%。由于获取精子太少,精子形态及顶体发育未进行相关染色检查,只是在高倍显微镜下判断。
目前,NOA患者M-TESE模式主要包括两种:第一,非同步手术,男方先行显微取精手术,发现精子,冷冻保存,女方取卵日使用解冻的精子,ICSI助孕治疗。第二,同步显微取精备供精,即女方取卵日当天,男方行M-TESE,为预防取精失败,建议精子库供精备用。取到精子,联合ICSI助孕治疗;取不到精子,行供精-体外受精助孕治疗。本中心目前开展的是同步显微取精备供精。目前对于同步或非同步手术,国内外研究结果存在争议,2018年Vij等[7]对男性非梗阻性无精子研究认为,新鲜的精子与解冻的精子对体外受精成功率的影响差异没有统计学意义。
NOA患者在手术之前,为帮助其做出最有利于自己的治疗方案,M-TESE术前的SRR预测尤为重要。近期,国外的研究[7-10]报告了NOA患者M-TESE获精率为40%~65%。国内研究[4,11-13]报告NOA患者M-TESE治疗的SRR为36%~44.4%,国内SRR取精率低的主要原因考虑为患者经门诊TESE术后镜检及病理未见精子,然后尝试性行M-TESE寻找可用精子。而国外多数为诊断为NOA后直接行M-TESE。本研究M-TESE获精率为45.5%,这些患者术中见睾丸少量曲细精管发育较好,睾丸病理组织切片可见少量生精细胞。而M-TESE未获精者睾丸曲细精管极度萎缩,透明样变,病理组织切片仅见支持细胞(OSCS),无生精细胞及精子。
诊断性检查评估SRR除包括全面的临床病史、体格检查,还应该包括性激素中总睾酮(T)和促卵泡激素(FSH)、染色体、Y染色体AZF微缺失的检测,部分患者需要睾丸组织研磨后镜检和病理活检的检查[14]。Bryson等[15]分析了1 127例NOA患者,根据睾丸体积大小分为<2 mL、2~10 mL、>10 mL三组,精子获得率分别为55%、56%和55%。Plotton等[16]发现睾丸体积≤2 mL与睾丸>10 mL组患者的SRR差异没有统计学意义。本研究5例睾丸发育不良患者,3例取到精子,SRR为45.5%,考虑可能与病例数较少有关。Ramasamy等[17]分析了792例NOA患者,按FSH水平分为4组,即<15 U/L、15~30 U/L、31~45 U/L和>45 U/L,其精子获得率分别为51%、60%、67%和60%。Amer等[18]对比1 395例M-TESE患者,高FSH不能预测NOA患者的SRR。国内外多中心研究证实尽管睾丸体积以及性激素FSH、LH、T水平是预测睾丸生精功能的重要指标,但均不能有效地预测M-TESE能否找到精子[18]。
NOA患者的明确病因可作为显微取精的有效预测指标,无论是先天性的Klinefelter综合征、Y染色体AZF微缺失还是继发性的睾丸炎、睾丸扭转。毛加明等[19]研究分析非嵌合型克氏综合征患者的精子获得率为39.8%,AZFc缺失患者精子获得率为62.4%,隐睾导致的NOA,其精子获得率为64.1%。国内外学者报道[20-21]Klinefelter综合征患者可以将显微取精作为首选;Y染色体AZF微缺失患者中,AZFc缺失获精率较高,但是合并AZFa或AZFb缺失的不建议行M-TESE;睾丸炎、隐睾术后的NOA患者术中可见多数曲细精管小管纤细、透明、无张力,少数具有生精功能的曲细精管则是粗大、饱满、富有张力的局灶团,容易显微镜下术中鉴别;特发性NOA患者睾丸大小正常,术中生精小管均一,饱满,张力性好,与具有生精功能正常的曲细精管难以区别。本研究显微取精有明确病因的5例,两例克氏综合征均未找到精子,考虑与病例较少以及患者睾丸体积太小(1 cm3)相关。Zhang等[22]研究159例克氏综合征患者,平均体积未到4 cm3,睾丸体积与获精率无相关性。双侧隐睾术后患者未找到精子,考虑与患者25岁行睾丸下降手术有一定相关性。AZFc、d区缺失1例以及睾丸炎后严重睾丸微结石1例M-TESE均获取到精子。
NOA伴有严重睾丸微石症行显微取精手术目前国内未见报道。国内外的研究[23-24]报告了睾丸微石症与不育相关,是引起精液质量下降的原因之一。本研究1例患者,术前B超示严重睾丸微石症,行睾丸穿刺细胞学检查,镜检未见精子,穿刺病理示有极少量精子细胞,曲细精管见多灶性钙化,M-TESE后获取精子,ICSI-IVF-ET成功生育健康儿。Richenberg等[25]研究这种病例的发病机制考虑两个方面,即一、睾丸炎引起睾丸内吞噬细胞无法将生精小管管壁变性、脱落的细胞碎屑吞噬,使其聚集于生精小管,羟基磷灰石沉积于其上引起钙质沉积,胶原纤维样物质聚集、包绕形成微结石;二、睾丸微结石造成精液质量下降的机制可能是生精小管内的微结石导致其阻塞,影响睾丸血流及生精小管功能,进一步影响精子的产生及活动能力。
睾丸穿刺活检病理结果对精子获得率也有一定的预测作用。Amer等[8]研究1 395例NOA患者病理分析生精功能降低为100%,精母细胞停滞为60.8%,初级精母细胞停滞率为25.5%,次级精母细胞停滞率为27.9%,管状硬化为33.8%,唯支持细胞综合征为29.6%。Abdel等[26]研究M-TESE在生精低下患者中的SRR为81%~100%,在精子成熟障碍患者中为36.4%~75%,在唯支持细胞综合征患者中的SRR为22.5%~41%。此外,每个NOA患者的伴侣也应该进行系统的检查评估,以准备使用ICSI进行辅助生殖。
NOA患者在M-TESE手术之前建议咨询专业生殖男科医师,以寻求内源性睾酮治疗原发性睾丸功能衰竭。一项多中心研究表明,使用氯米芬、hCG、HMG联合治疗NOA患者,SRR为57%,高于未经治疗的34%,Hussein等[27]报告使用枸橼酸氯米芬,通过优化睾丸内睾酮水平,提高M-TESE取精率。本研究11例患者,术前用药方案是hCG 2 000 iU加HMG75 iU,3 d一次肌注,加他莫昔芬50 mg每天两次,治疗1~2个生精周期。Vij等[7]建议hCG 1 000~3 000 iU,每周给药两到三次,鼻内滴注,3~6个月。 如果在6个月内精液未见精子,则增加HMG 75 iU,每周两次至三次,鼻内滴注,3个月,精液未见精子,则再增加HMG 75 iU。如果精液中没有找到精子,这种给药方案可以延长至6个月以上。
目前,已经有许多的临床研究报道指出,M-TESE可能会对患者本身造成一定的影响,但是较传统的穿刺取精,术后的急性期和长期的并发症发生率低。研究报道M-TESE术后1 个月的血清睾酮水平较术前有明显的下降[21],术后6个月有所恢复,术后1年基本恢复到术前状态。本研究患者术后激素变化未见明显差异,考虑样本量较少,同时11例患者均只行单侧M-TESE,对患者性激素影响较少。M-TESE作为临床刚开始的技术,相对保守,在今后的治疗中,如果一侧睾丸内未找到精子,需要进行对侧睾丸M-TESE。
总之,NOA患者行显微取精以前,建议行诊断性评估及咨询,明确手术的风险以及取精率的可能性。应严格掌握手术指征并慎重选择术式。此外,手术医师需要经过显微操作训练,并配备显微手术设备,同时需要泌尿男科与生殖医学科的多学科合作。

