经腹入路腹腔镜在原发性腹膜后肿瘤切除术中的应用研究
厉学民 於敏 周海华 李仓 程俊峰 俞世安
腹膜后肿瘤是一类少见的腹膜后间隙软组织肿瘤,主要病理类型包括神经纤维瘤、副神经节瘤、嗜铬细胞瘤、脂肪肉瘤、恶性淋巴瘤以及恶性纤维组织细胞瘤等。除恶性淋巴瘤外,大多数腹膜后肿瘤的治疗以手术切除为主[1]。由于腹膜后肿瘤位置较深,开腹手术通常需要较大切口才能暴露清楚,患者创伤大、术后恢复较慢。而随着腹腔镜技术的提高,腹腔镜手术逐步应用于原发性腹膜后肿瘤的治疗。本文对经腹入路腹腔镜在原发性腹膜后肿瘤切除术中的应用价值作一探讨,现报道如下。
1 对象和方法
1.1 对象 选取2014年8月至2019年12月浙江大学医学院附属金华医院收治的行经腹入路腹腔镜腹膜后肿瘤切除术患者21例,其中男11例,女10例,年龄 24~68(50.0±10.3)岁。纳入标准:(1)临床诊断为原发性腹膜后肿瘤患者;(2)一般资料完整者。排除标准:继发性腹膜后肿瘤患者。本研究经医院医学伦理委员会批准,所有患者及家属均知情同意。
1.2 患者主要临床表现及影像学检查所见 患者因腹痛5例、腹胀2例、腰痛1例就诊,余13例因体检发现腹部肿物而就诊。术前均行腹部B超、增强CT或MRI检查,其中1例典型腹膜后神经鞘瘤患者术前腹部CT检查见图1,肿瘤位于下腔静脉后方、腹主动脉右侧、脊柱前方;1例典型腹膜后巨大淋巴管瘤患者术前腹部CT检查见图2,肿瘤包绕2/3右肾、完全包绕右肾血管和输尿管上段,与下腔静脉、右肾上腺关系密切。

图1 1例典型腹膜后神经鞘瘤患者术前腹部CT检查所示
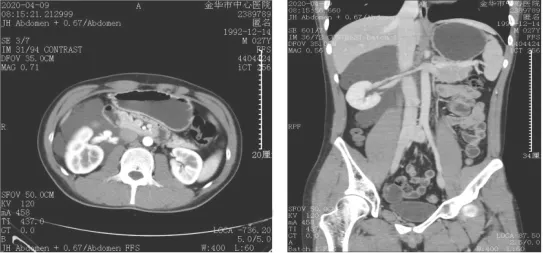
图2 1例典型腹膜后巨大淋巴管瘤患者术前腹部CT检查所示
1.3 方法 所有患者均采取气管插管全麻经腹入路,取仰卧位。脐周穿刺建立CO2气腹,并放置第1个穿刺器(Trocar),气腹压力维持在 13~15 mmHg(1 mmHg=0.133 kPa),此后再根据肿瘤的位置不同安置3~4个Trocar。对于腹膜后右上及右下区域肿瘤,采用Kocher切口游离十二指肠及胰头,并游离结肠肝曲和升结肠,向中线翻转,有时需要同时分离肝周韧带并抬起右肝。左侧腹膜后肿瘤需切开胃结肠韧带,游离结肠脾曲,并在脾脏下极分离脾肾韧带,将脾脏和胰尾上移或翻向中线,显露左侧腹膜后间隙。下腹部的腹膜后肿瘤采取头低足高位,将小肠及其系膜向头侧翻起暴露。肿瘤显露后,采用超声刀或电钩逐步游离肿瘤,夹闭切断肿瘤滋养血管。分离肾脏水平以下的腹膜后结构时需避免损伤输尿管,必要时可术前或术中留置输尿管支架。对于紧邻大血管的腹膜后肿瘤,可先逐步分离肿瘤周围组织,将与血管相连部分留到最后处理,可将血管鞘膜及肿瘤一并切除。对于体积较大的囊性肿瘤,可抽出部分囊液,缩小肿瘤体积后再沿肿瘤边缘完整切除。切除的肿瘤置入取物袋内后取出,创面严密止血,蒸馏水或0.9%氯化钠溶液冲洗后,放置腹腔引流管1根。
2 结果
术中见肿瘤长径3~16 cm,术后肿瘤病理学诊断为良性18例,分别为淋巴管瘤5例、神经鞘瘤4例、Castleman病2例、节细胞神经瘤1例、成熟畸胎瘤1例、副神经节瘤1例、异位嗜铬细胞瘤1例、良性囊性黏液性肿瘤1例、腹膜后囊肿1例、血管脂肪瘤1例;恶性3例,分别为高分化脂肪肉瘤2例,神经内分泌肿瘤1例。此外,有6例患者的肿瘤毗邻重要血管和脏器(包括腹主动脉、下腔静脉、肾静脉、胰体尾脾)。21例患者均顺利完成经腹入路腹腔镜原发性腹膜后肿瘤切除术,其中2D腹腔镜下手术15例,3D腹腔镜下手术6例。手术时间平均为130 min,术中出血量平均为125 ml,术后住院时间平均为7 d。术后并发胃排空障碍1例、乳糜漏1例,经对症处理后好转,无围手术期死亡病例。21例患者均获得术后随访,随访时间为3~64个月,至随访截止时间(2020年3月)均无肿瘤复发。
3 讨论
原发性腹膜后肿瘤的传统治疗以开腹手术切除为主。随着腹腔镜技术的发展,腹腔镜手术为腹膜后肿瘤的治疗提供了新的选择。Chung等[2]总结了25例开腹切除与腹腔镜原发性腹膜后肿瘤切除术的对比研究,认为腹腔镜原发性腹膜后肿瘤切除术是可行的,其手术效果与开腹相当。但腹膜后肿瘤部位深,周围解剖关系复杂,有的肿瘤毗邻大血管,完整切除困难,因此腹腔镜腹膜后肿瘤切除的手术难度较大。在原发性腹膜后肿瘤切除术中,术前影像学检查和血管重建技术明确肿瘤本身与毗邻器官和血管的关系,是手术是否能够顺利进行的关键[3]。原发性腹膜后肿瘤的腹腔镜手术可分为经腹与经腹膜外入路。本研究21例原发性腹膜后肿瘤患者均采用经腹入路的腹腔镜手术。笔者认为应根据肿瘤部位、大小、性质、肿瘤与周围组织、脏器、重要血管间的毗邻关系以及术者本身熟悉的路径来选择合理的腹腔镜手术入路。
关于原发性腹膜后肿瘤行腹腔镜下切除的适应证,牟一平等[4]认为直径≤6 cm的腹膜后良性肿瘤较为适合腹腔镜手术。高晓杰等[5]认为,腹腔镜手术适用于体积较小、与周围大血管分界清楚的腹膜后实性肿瘤及大部分囊性肿瘤;而体积较大、与周围大血管紧密粘连的腹膜后实性肿瘤,可于腹腔镜下完成探查和部分周围组织游离,然后根据术中情况取合适辅助切口或中转开腹;注意切忌在不能保证R0切除时盲目追求微创。笔者认为腹膜后肿瘤即便体积较大但若未侵犯周围器官和血管,且包膜完整、边界清楚,只要能够在充分的操作空间进行也适合腹腔镜手术。肿瘤切除后可通过延长切口至肿瘤短径取出,避免了开腹手术的大切口及持续拉钩对腹壁的损伤。因此,腹腔镜手术损伤小,术后疼痛轻,患者可较早下床活动和恢复进食,有效降低肺部感染和切口并发症发生率。至于是否需要中转开腹手术要根据术中肿瘤与周围组织的粘连程度、术中出血、术中快速冷冻切片检查报告等情况来决定,若报告提示恶性,肿瘤太大超过10 cm有肿瘤破裂、播散风险,术中大出血,或难以在腹腔镜下完成操作时应及时考虑中转开腹手术[6]。本组无中转开腹病例。术中笔者常规行快速冷冻切片检查,如为恶性肿瘤且切缘阳性,则追加切除范围,必要时中转开腹手术。腹腔镜原发性腹膜后肿瘤切除术在体型肥胖的患者中优势更加明显,因为肥胖患者的腹膜后肿瘤在行开腹手术时显露极为困难,而腹腔镜具有高清放大功能,可在狭小空间内清楚显露局部结构,尤其是血管解剖,有助于精细分离,可明显减少损伤周围组织。此外腹腔镜本身具有探查的优势,对肿瘤无法切除或需明确肿瘤性质的病例,可于腹腔镜下行活组织病理学检查,明确诊断后指导下一步治疗,避免不必要的开腹探查。
本组有6例肿瘤毗邻重要血管和脏器,均采用3D腹腔镜下顺利完成手术。Ahn等[7]报道了20例腹膜后肿瘤的腹腔镜切除,均为良性肿瘤,并发症发生率为10%,其中1例中转开腹,是由于肠系膜上静脉属支血管出血所致,因此他们认为肿瘤邻近大血管可显著增加手术时间和手术风险。笔者体会:(1)术前CT血管造影术(CTA)检查对于明确肿瘤的血供以及是否侵犯大血管有重要意义,腹膜后肿瘤一般不浸润血管,但随着瘤体的不断增大,会对临近血管造成压迫,使之移位及大量侧支血管形成,术中在腹腔镜下解剖分离和处理这些血管成为能否完整切除肿瘤的关键。(2)肿瘤如有假包膜,尽量在包膜外分离,减少切缘阳性的可能;应尽量先分离肿瘤周围结构,做到先易后难,将与血管相连部分留到最后处理。(3)腹腔镜手术的视野比开腹手术更清晰,尤其是3D腹腔镜可清楚显示某些开腹状态下的视觉死角,并能近距离观察肿瘤与周围血管及组织脏器的三维关系,完成对血管、组织结构的精准解剖。(4)遇到术中出血,可先用纱布填塞压迫,大部分患者待肿瘤切除后出血会自行停止,对于纱布填塞无效的血管活动性出血,可用5-6个0的prolene线缝合修补止血。本组术中平均出血量仅为125 ml,较Strauss等[8]报道的低很多,得益于术野的良好显露、精准解剖、精细操作和娴熟的腹腔镜下缝合止血技术。
总之,在掌握娴熟的腹腔镜操作技巧的基础上,通过术中精细操作,经腹入路腹腔镜原发性腹膜后肿瘤切除术是安全、可行的,具有微创、有效、术后恢复快等优点。

