基于生物信息学检测NSUN2 基因在胶质瘤中的表达及临床意义
张 群,田秋思,唐铖铖,冯 光,路宏朝
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723000;2.三二〇一医院神经外科,陕西 汉中 723000)
人脑胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,预后差,其中以多形性胶质瘤(glioblastoma multiforme,GBM)恶性程度最高,患者总生存时间仅10~15 个月[1]。人脑胶质瘤的发病机制非常复杂,具体机制仍不清楚。相关基因表达异常在人脑胶质瘤尤其是NSUN2 的发生、发展中起着至关重要的作用[2]。因此,筛选人脑胶质瘤特异且敏感的差异表达基因有助于认识人脑胶质瘤,同时有利于人脑胶质瘤的早期诊断和精准治疗。5-甲基细胞嘧啶(m5C)通过RNA 代谢调节,特别是RNA 稳定性、RNA 导出RNA、mRNA 翻译和RNA 处理参与肿瘤的发生[3,4]。NOP2/Sun 结构域家族成员2(NSUN2)也被称为MYC 诱导的SUN 结构域含蛋白(Misu),是催化m5C 形成的主要m5C 修饰酶。根据免疫组化学(IHC)分析,NSUN2 在各种肿瘤中均高度表达,包括食管、肝脏、胰腺、子宫颈、肾、胃、甲状腺和乳腺癌[5-8]。研究表明[4],NSUN2 通过与其3'-UTR 中的m5C 修饰位点结合稳定HDGF癌基因的mRNA 来促进膀胱癌的进展。然而,关于NSUN2 在神经胶质瘤中的作用的研究还很少。本研究使用癌症基因组图谱(the cancer genome atlas,TCGA)数据集分析NSUN2 基因在正常脑组织与GBM 中的表达差异,以及NSUN2 与GBM 患者临床病理特征的相关性,旨在为深入研究GBM 的靶向治疗提供思路。
1 资料与方法
1.1 数据来源 从TCGA(https:/lcancergenome.nih.gov/)数据库下载GBM 的mRNA 表达谱数据,包含1150 例正常脑组织和689 例GBM 组织,同时下载对应的患者临床资料,采用R 软件和Perl 语言预处理数据。
1.2 数据集筛选和差异表达分析 剔除TCGA 数据集中临床病理参数不完整及缺乏预后随访资料的样本,仅保留同时包含临床参数和生存数据的样本,利用Wilcoxon 秩和检验确定NSUN2 基因在正常脑组织和GBM 组织中的表达差异,采用R 软件(3.5.2)的“limma”软件包完成差异分析并绘制差异散点图[9]。
1.3 生存分析与临床相关性分析 根据样本中NSUN2 基因表达的中位值将NSUN2 分为高表达组和低表达组,采用R 软件的“survival”软件包进行生存分析,采用“survminer”软件包绘制生存曲线,单因素和多因素Cox 风险模型分析临床参数与GBM 预后的关系,并计算风险比(hazard ratio,HR)。
1.4 基因集富集分析 采用CSEA 软件(4.0.2)(http:/lsoftware.broadinstitute.org/gsea/index.jsp)进行富集分析。采用CSEA 网站的MsigDB 数据库获取c2.cp.kegg.v7.0.symbols.gmt 数据集,设置分析置换次数为1000 次,显著富集基因集需满足以下条件:错误发现率(false discovery rates,FDR)<0.25,P<0.05。
1.5 mRNA 和蛋白质表达验证实验 选取符合纳入和排除标准9 例胶质瘤组织与癌旁正常组织标本作为本实验的验证对象。纳入标准:在西安交通大学附属三二〇一医院明确诊断为GBM 的患者;IBM为18.5~25 kg/m2;年龄20~65 岁。排除标准:存在严重的心、肺、肾等严重的内科合并症;临床资料不完整。按照Trizol 试剂说明书提取细胞总RNA 后,采用逆转录试剂盒(Accurate)进行RNA 逆转录实验。逆转录后的cDNA 用于进行实时荧光定量实验,以小鼠GAPDH 作为内参。同时,选取的5 例患者标本所制作的5 组GBM 组织和癌旁组织的石蜡切片,将5 组患者胶质瘤与癌旁标本通过三步法进行NSUN2 作为一抗的免疫染色,观察免疫染色后的阳性结果的表达,本实验采用DAB 染色,阳性结果显色为黄褐色。其中一抗采用Cell Signaling Technology 的NSUN2 兔源多克隆抗体。引物序列见表1。

表1 各蛋白基因引物序列
1.6 统计学方法 采用SPSS 22.0 软件对数据进行统计学分析,符合正态分布的计量资料用()表示,组间比较采用配对t检验;计数资料以(%)表示,组间比较采用χ2检验,采用单因素和多因素Cox 回归分析挑选预后相关因子,相关性分析采用皮尔森相关分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 NSUN2 在GBM 组织中的表达情况 NSUN2 在GBM 组织中的表达高于正常脑组织,差异有统计学意义(P<0.05)﹐见图1。
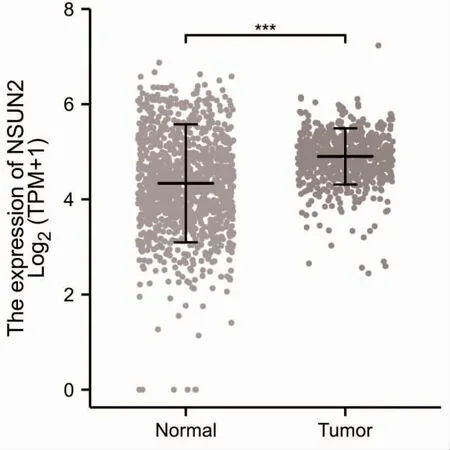
图1 NSUN2 在GBM 组织中的表达情况
2.2 NSUN2 表达情况与GBM 患者临床病理特征的关系 NSUN2 表达与GBM 患者预后呈负相关,见图2。不同年龄、临床分期、TP53 分型的GBM 患者NSUN2 表达比较,差异有统计学意义(P<0.05),不同性别的GBM 患者NSUN2 表达比较,差异无统计学意义(P>0.05),见图3。单因素Cox 回归分析显示,NSUN2 mRNA 的高表达、WHO 分级、应答深度、1p/19q 杂合性缺失以及IDH1 基因野生型可降低患者的总生存期,性别与患者预后无关;将上述有统计学意义的因素纳入多因素的Cox 回归模型分析,结果显示治疗结果、IDH1 基因野生型和年龄是患者总生存期的独立影响因素,见表2。
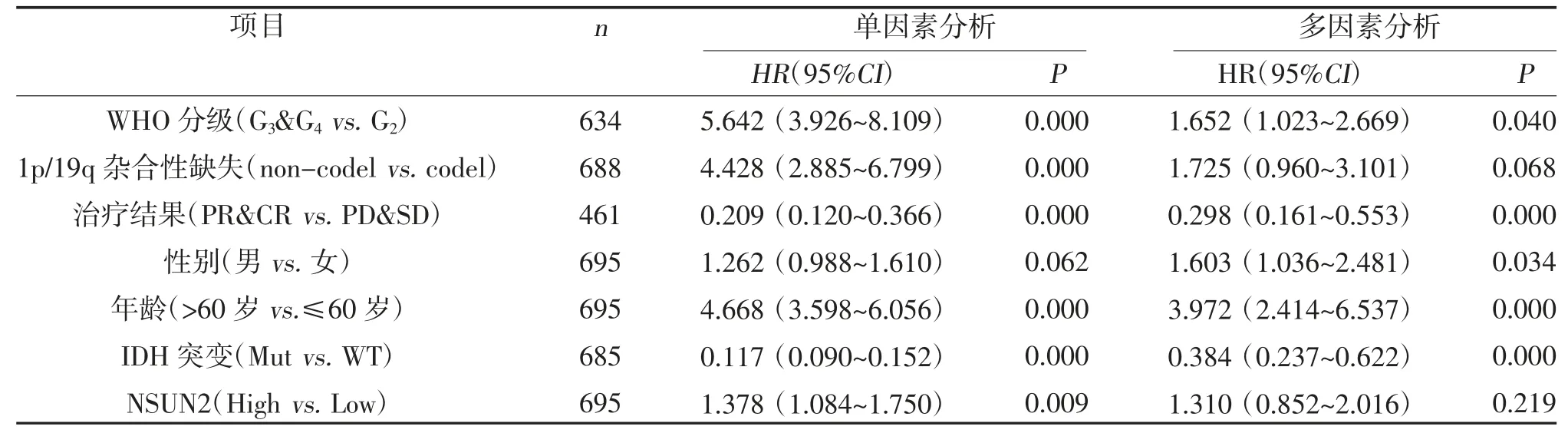
表2 GBM 预后影响因素的单因素、多因素Cox 回归分析

图2 NSUN2 基因mRNA 表达与GBM 患者预后的相关性
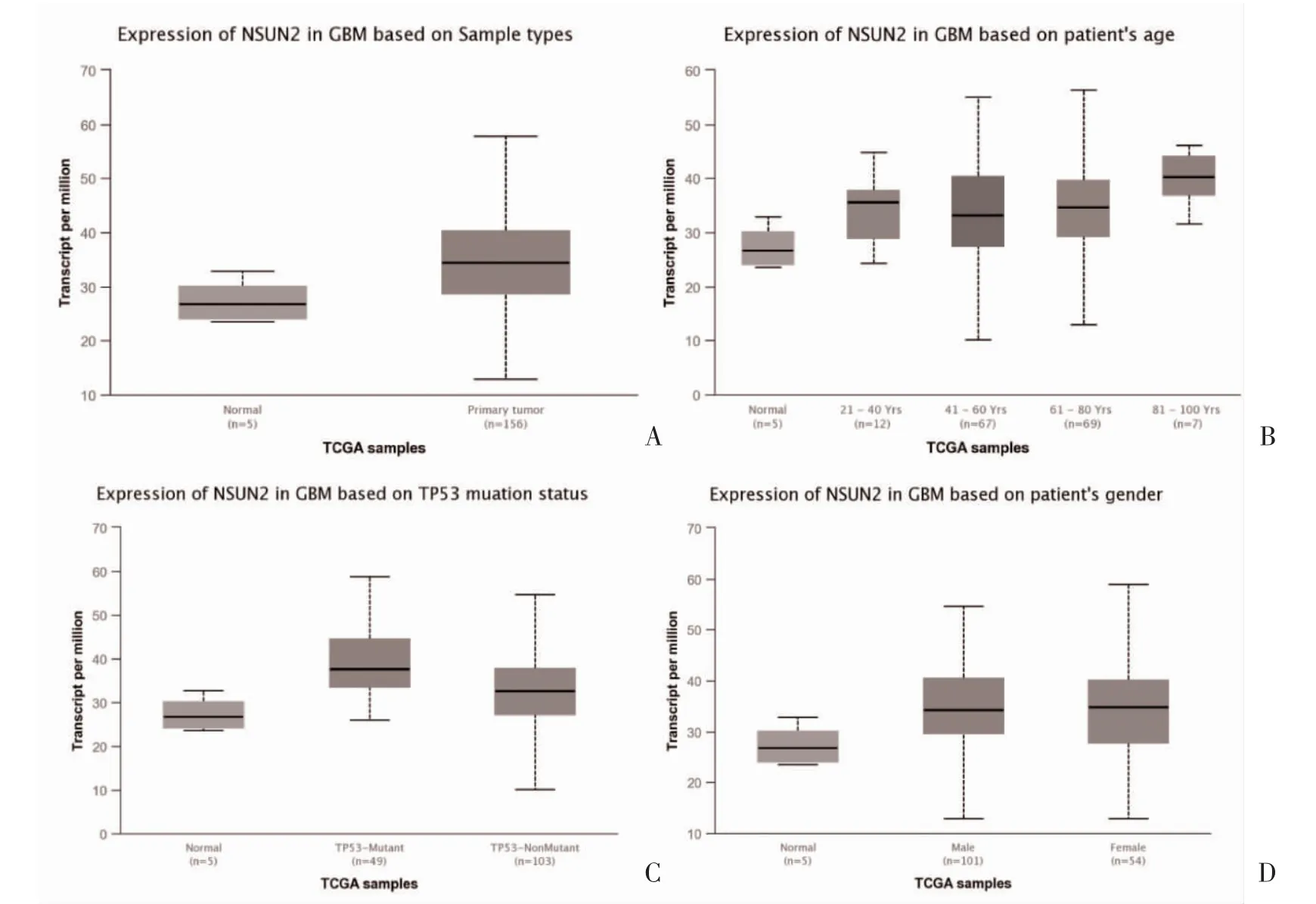
图3 NSUN2 表达与临床病理特征的关系
2.3 基因集富集分析 GSEA 分析结果表明,NSUN2基因高表达组GBM 样本主要富集于视网膜母细胞瘤、合成蛋白、整合素、反应性胶原形成信号通路,见图4。

图4 NSUN2 相关富集基因集
2.4 NSUN2 mRNA 在GBM 组织中的表达情况q-PCR实验显示,NSUN2 mRNA 的表达在GBM 组织中上调,见图5,其中NSUN2 mRNA 在GBM 组织中的表达量高于癌旁组织,差异有统计学意义(P<0.05)。IHC 实验结果显示,NSUN2 在GBM 组织呈中等程度的胞核阳性,且NSUN2 mRNA 在GBM 组织的表达水平高于癌旁组织,见图6。

图5 NSUN2 mRNA 在GBM 组织和癌旁组织的表达比较
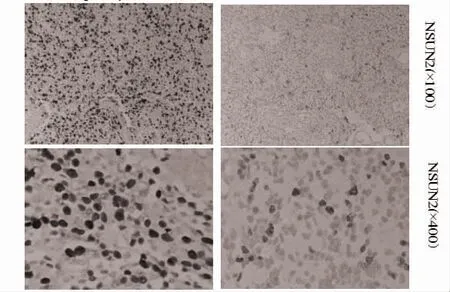
图6 NSUN2 蛋白在GBM 组织和癌旁组织的表达比较
3 讨论
本研究显示,NSUN2 在GBM 中的表达高于癌旁组织组,NSUN2 高表达组的总生存期低于低表达组(P<0.05),提示NSUN2 高表达是GBM 患者预后的危险因素。另外,本研究采用qPCR 技术和IHC 实验验证了胶质瘤组织中NSUN2 表达上调。有报道显示,包括NSUN2 在内的几种RNMT 的表达在DNA拷贝数和mRNA 表达之间具有正相关性,并且与乳腺癌患者的更高级别侵袭性亚型和不良预后相关[10]。在皮肤癌中,NSUN2 的表达缺失与恶性肿瘤的增加相关[11]。在卵巢癌中,NSUN2 低表达和IGF2 高表达的患者具有较差的总体和无疾病进展生存率,因此NSUN2/IGF2 信号已被确定具有预后生存价值[12]。另有研究发现,NSUN2 在头颈部鳞状细胞癌(HNSCC)中的表达上调约2 倍,这与患者的总生存期缩短和较高的死亡率风险相关[13]。此外,NSUN2 高表达与HNSCC 中的T 细胞活化相关,NSUN2 低表达患者的T 细胞活化评分与死亡率之间存在正相关,这表明HNSCC 中NSUN2 表达可作为免疫检查点的标志物[14]。有研究明确了NSUN2 在胃癌中的作用,发现NSUN2 通过以m5C 依赖的方式抑制细胞周期蛋白依赖性激酶p57Kip2,在体外和体内促进癌细胞增殖[15]。这些研究均证明了NSUN2 在肿瘤中的重要作用,但NSUN2 在胶质瘤中的作用还需要进一步阐明。
本研究中,单因素和多因素Cox 的分型显示,NSUN2 和病理分级在GBM 中是两个独立预后因子。在与GBM 患者临床特征关系的研究中发现,不同年龄、病理分级﹑性别以及肿瘤分期的GBM 患者NSUN2 表达均有差异。进一步对NSUN2 高低表达组进行差异分析,并对所得的差异基因进行功能富集﹐发现差异基因主要和整合素及蛋白聚糖相关通路有关,这也提示蛋白代谢可能参与GBM 的发生发展。蛋白质合成是所有细胞的基本过程,但其在发育、干细胞和癌症中的精确调控作用尚不清楚。研究显示,NSUN2 在m5C 转录后甲基化转移RNA(TRNA)是一种新的抑制蛋白质合成的机制[16,17]。NSUN2 的缺失导致tRNA 的低甲基化,使血管生成素能够内切tRNA,并积累5'tRNA 片段[16-19],这些片段可抑制帽依赖的蛋白质翻译[20-22],这与GSEA 富集的结果一致。还有研究显示[23],NSUN2 基因双等位基因功能的缺失变异与青少年白内障或脑异常疾病相关,提示NSUN2 与GBM 存在的相关性。GSEA 分析显示,NSUN2 高表达组在视网膜母细胞瘤相关通路中有显著富集。
综上所述,GBM 组织中NSUN2 基因呈高表达状态,并且与患者的临床病理特征密切相关,可以为GBM 诊断和治疗的提供新思路。

