麦玉轮作农田秸秆降解真菌的筛选与镰刀菌拮抗特性研究
李月, 谭金芳, 陈林, 梅浩, 王祎, 李慧, 李芳, 韩燕来
(1.河南农业大学,河南 州 450002;2.中山大学农学院,广东 广州 510000;3.中国科学院南京土壤研究所,江苏 南京 210000)
秸秆还田是各地大力推广、应用最多的农业生产模式,也是当前中国秸秆资源利用的主渠道[1]。自20世纪90年代秸秆还田技术在中国被广泛推广以来,其在农田肥力提升、缓解秸秆焚烧所带来的空气污染方面的贡献受到普遍的认可。然而,有研究显示,秸秆还田小区小麦根腐病、纹枯病、全蚀病发病率显著高于秸秆移除处理,且发病率呈现出逐年增加的趋势[2-3]。因此,土传病害高发是长期秸秆还田过程中的热点问题。亦有研究显示,秸秆还田非但没有增加土传病害的发病率,反而抑制了镰刀属病原菌的生长,降低作物土传病害的发病率[4-5]。由此可见,秸秆还田对于土壤病原菌的作用及最终发病率表征因各地的环境、土壤条件和农业管理措施而异。
土壤微生物作为主要的分解者,维系着农田生态系统的平衡,与作物的健康和还田秸秆的降解密切相关[6]。研究表明,秸秆还田后,不仅显著增加了纤维素降解功能微生物丰度[7-8],而且促进了部分富营养型病原菌的增加[9]。韦中等[10]提出,依托有益菌与病原菌之间的拮抗关系来维系农田生态系统的健康是行之有效的途径之一。与细菌相比,真菌在秸秆的降解过程中表现出明显的优势,主要体现在耕作农田中真菌对新加入纤维素的反应迅速而且持久,尤其是在秸秆降解的后期阶段,真菌比细菌更加活跃[11-12]。研究表明,高效降解纤维素和木质素的毛壳菌属真菌的丰度与土传病害的发生率呈现显著的负相关关系[13-14]。长期定位试验表明,担子菌门和子囊菌门真菌丰度在秸秆还田处理下增加,并且增加了有益的功能性真菌的种类和数量[15]。
黄淮海地区作为农业主产区,以麦玉轮作系统作为主要的农业生产模式,其秸秆还田量巨大。然而,对于麦玉轮作农田秸秆还田引起的土壤有益菌及致病菌的变化情况目前尚无系统研究。因此,本研究选择河南省麦玉轮作区代表性土壤类型潮土和砂姜黑土作为研究对象,对秸秆还田条件下土壤秸秆降解真菌进行筛选鉴定,对其抑菌特性进行评价,以明确潮土和砂姜黑土秸秆降解过程中有益菌和病原菌变化的共性及个性特征,为建立秸秆还田下土壤有益和病原真菌资源库,更好地解决秸秆还田引起的农作物土传病害频发问题奠定基础。
1 材料与方法
1.1 纤维素降解真菌的筛选
供试土壤均采自连续秸秆还田10 a以上的农田土壤,土壤类型分别为河南省原阳教科园区的壤质潮土,封丘县潘店镇沙质潮土,驻马店市西平县酸性砂姜黑土和南阳市方城县黄褐土,共计4份土壤样品。于2018年玉米收获后用土钻按照五点采样法采集秸秆还田处理的耕层土壤,去除土壤中的石块和杂质,过2 mm筛,保存于4 ℃备用。
1.1.1 筛选培养基 KH2PO40.5 g,MgSO4·7H2O 0.025 g,KNO30.5 g,NH4NO30.1 g,琼脂粉20 g,球磨纤维素粉20 g,蒸馏水1 L。刚果红纤维素培养基:在筛选培养基的基础上加刚果红0.2 g。培养基分别定容分装后高温高压灭菌20 min,冷却备用。
1.1.2 稀释涂平板法 将处理好的土壤样品称取5.0 g,置于灭菌三角瓶中,加入50 mL无菌水和无菌玻璃珠,置于28 ℃,150 r·min-1,震荡培养30 min,即母液。对母液进行梯度稀释,将稀释的倍数分别是10-1、10-2、10-3的样品溶液涂布到筛选培养基上。倒平板前,每100 mL培养基加入50 g·L-1卡那霉素100 μL,用于抑制细菌生长。28 ℃恒温培养3 d,挑取平板上的单菌落到新的PDA平板上培养,连续几代转接,直至得到纯菌落后进行鉴定。
1.2 菌种鉴定
使用Takara公司生产的Lysis Buffer for Microorganism to Direct PCR试剂,按照说明书操作快速获取真菌DNA。真菌DNA扩增:提取得到的真菌DNA对其ITS1F[16-17]区的扩增,采用引物ITS1F/ITS2[18]。PCR反应体系(50 μL):2×HiFi Hot Start Ready Mix 30 μL,引物(10 μmol·L-1)各1 μL,DNA模板1 μL,ddH2O 17 μL。PCR反应程序:95 ℃ 5min,95 ℃ 40 s,62 ℃ 30 s,72 ℃ 30 s,28个循环;72 ℃ 10 min。扩增产物用1%琼脂糖凝胶电泳验证后,采用Sanger测序技术进行测序。序列通过National Center for Biotechnology Information数据库进行BLAST,初步确定这些菌株种类。
1.3 秸秆降解能力预判
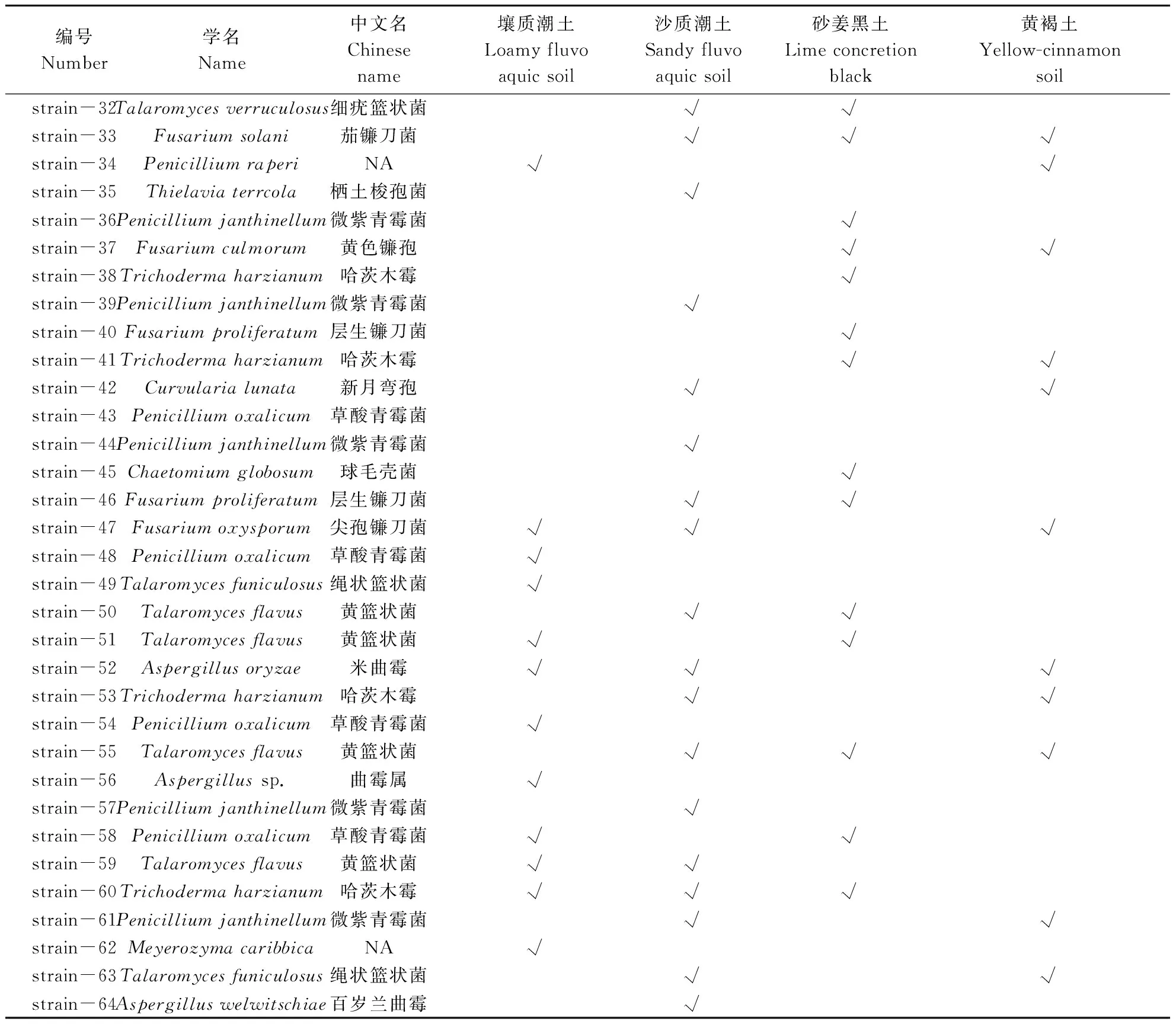
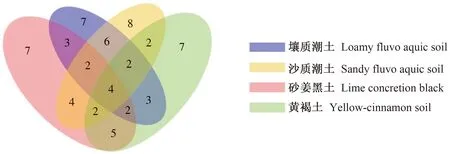
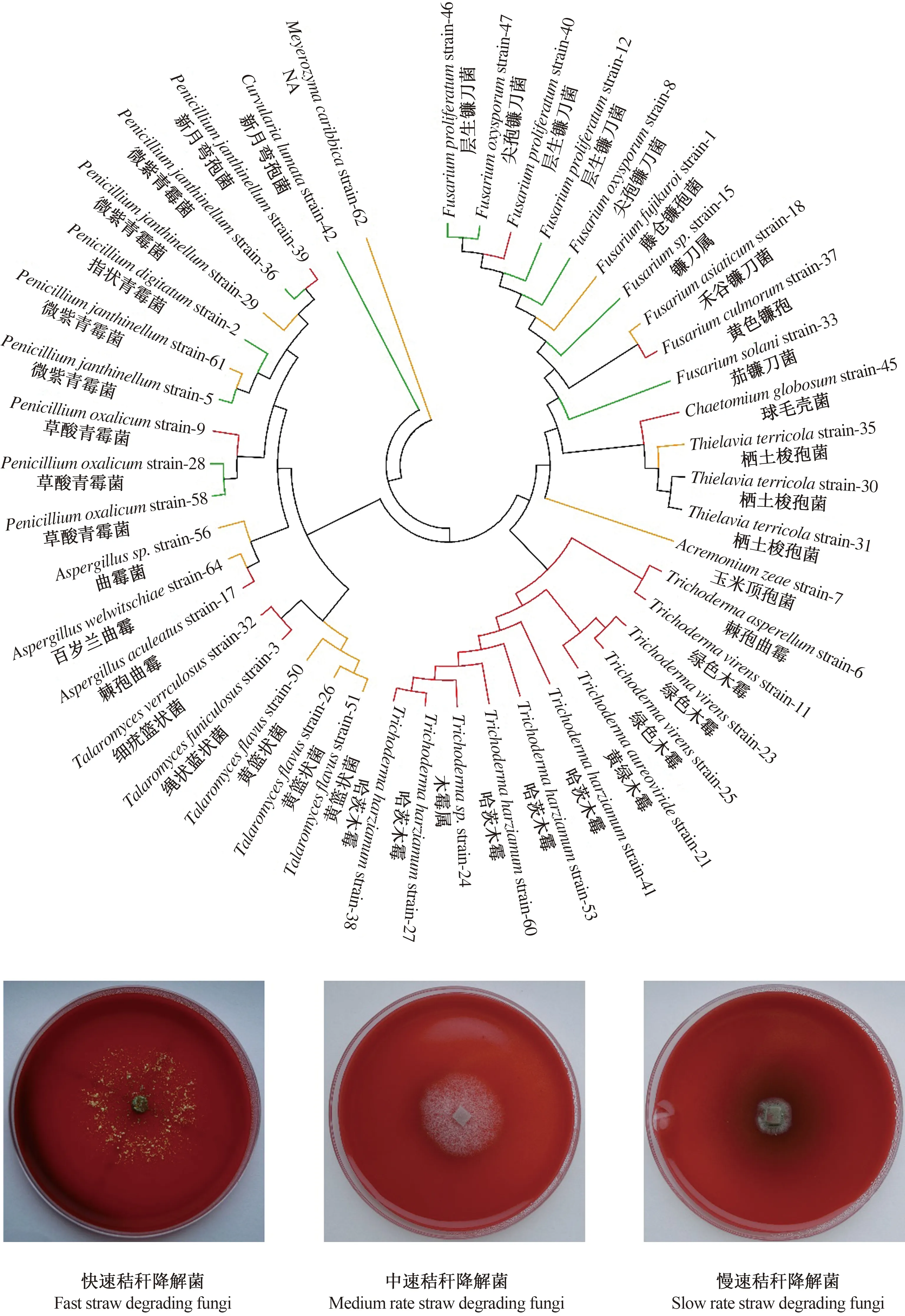
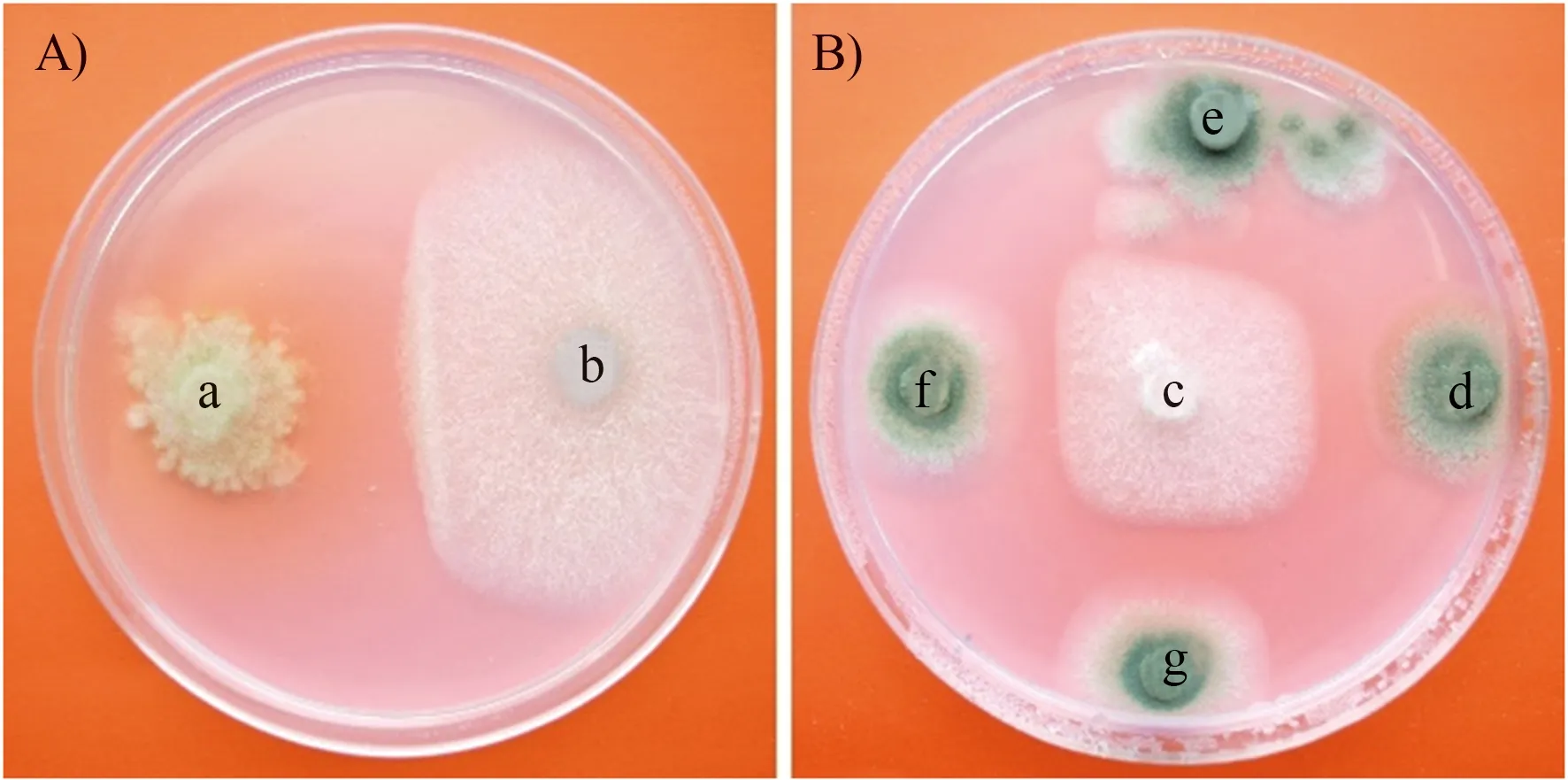
将纯化并鉴定的菌株用打孔器(直径约0.5 cm)打孔后,接种于刚果红纤维素培养基平板(9 cm)的中央,28 ℃培养3 d。根据刚果红纤维素培养基菌落周围水解圈直径的大小,初步评价菌株的纤维素降解能力[19-20]。本研究中采用的分级标准如下:当水解圈直径d≥4 cm判定为纤维素快速降解真菌,当3 cm 基于PDA培养基进行镰刀菌和其他秸秆降解真菌的拮抗试验。将致病菌接种于平板的中央,生防菌接种于致病菌的四周,仅接种镰刀菌的平板作为对照,28 ℃培养3 d。观察致病菌和生防菌生长时的拮抗情况,根据对照组和处理组病原菌落的直径,按照公式:生长速率=(单一致病菌菌落直径-接种生防菌后致病菌菌落直径)/单一致病菌菌落直径×100%,计算不同生防真菌对致病真菌生长速率的抑制情况,以致病菌生长速率≥30%作为具有拮抗效应的判断依据[21]。 使用初筛培养基,从4份土壤中筛选得到200株真菌,通过对其ITS区测序结果的比对,将序列100%相似的菌株合后,得到64株真菌。经过鉴定,这些菌株全部属于子囊菌门,包括了7个科和10个属,并对各个属真菌占筛选得到全部菌种的百分比进行展示(图1)。表1展示了64株真菌的鉴定信息以及来源,并对其分布进行展示(图2)。菌种序列已上传到National Center for Biotechnology Information网站的GenBank,序列号为MZ353521-MZ353584。 表1 纤维素降解真菌鉴定信息及来源Table 1 Indentification information and sources of cellulose degradingstrains 续表 Continuing table 注:NA:未检索到。下同。 利用纤维素刚果红培养基对菌株培养3 d,根据平板上产生的水解圈大小,评价菌株的纤维素降解效果,并对其亲缘关系进行分析(图3)。其中,快速纤维素降解真菌有19株,分别是木霉属(Trichoderma)的11个菌株、青霉属(Penicillium)的2个菌株、毛壳属(Chaetomium)的1个菌株,镰刀菌属(Fusarium)的2个菌株,曲霉属(Aspergillus)的1个菌株,篮状菌属(Talaromyces)的2个菌株;纤维素降解速率居中的菌株共14个,分别是青霉属(Penicillium)的5个菌株,弯孢属(Curvularia)的1个菌株,镰刀菌属(Fusarium)的6个菌株,梭孢科属(Thielavia)的2个菌株;降解速率较慢的菌株共12个,分别是:篮状菌属(Talaromyces)的3个菌株,曲霉属(Aspergillus)的2个菌株,青霉属(Penicillium)的2个菌株,Meyerozyma的1个菌株,镰刀菌属(Fusarium)的2个菌株、枝顶孢属(Acremonium)的1个菌株,梭孢壳属(Thielavia)的1个菌株。剩余19个菌株在培养过程中会产生大量孢子,在平板上没有形成整齐的水解圈,因而无法分类。 图2 纤维素降解真菌筛选来源分布情况 图3 纤维素降解真菌系统发育关系 本研究通过对已经筛选出来的64个菌种的ITS测序结果进行亲缘关系的比对及查阅相关文献,选出4株镰刀属真菌:茄镰刀菌(Fusariumsolani)、尖孢镰刀菌(Fusariumoxysporum)、层生镰刀菌(Fusariumproliferatum)和禾谷镰刀菌(Fusariumasiaticum);29株非致病真菌,包括Meyerozyma1株;毛壳属(Chaetomium)1株;梭孢壳属(Thielavia)2株;篮状菌属(Talaromyces)8株;木霉属(Trichoderma)9株;青霉属(Penicillium)8株。 进行拮抗试验后发现,部分非致病真菌对2株生防真菌和3株病原真菌产生了抑制作用(图4),菌种之间出现了非常明显的拮抗作用,当生防菌对某种致病菌有抑制作用时,生防菌和致病菌之间出现了明显的拮抗区域,致病菌生长速度减缓甚至不再生长。 注:a:球毛壳菌strain-45,b:尖孢镰刀菌strain-47,c:茄镰刀菌strain-33,d:草酸青霉菌strain-48,e:黄篮状菌strain-50,f:NAstrain-34,g:黄篮状菌strain-51。 图5结果显示,共有22株对茄镰刀菌(Fusariumsolani)有拮抗作用,13株对禾谷镰刀菌(Fusa-riumasiaticum)有拮抗作用,7株对层生镰刀菌(Fusariumproliferatum)有拮抗作用,仅6株非致病真菌对尖孢镰刀菌(Fusariumoxysporum)有拮抗作用。其中,篮状菌属(Talaromyces)的8株真菌对禾谷镰刀菌(Fusariumasiaticum)、层生镰刀菌(Fusariumproliferatum)和尖孢镰刀菌(Fusariumoxysporum)均没有拮抗作用;微紫青霉(Penicilliumjanthinellumstrain-36)对4株镰刀菌都有拮抗作用;木霉属真菌(Trichodermasp. strain-24)对5株真菌产生拮抗效果;Meyerozymacaribbicastrain-62仅对茄镰刀菌(Fusariumsolani)有拮抗效果。 图5 镰刀菌与其他秸秆降解真菌间的拮抗作用 已有研究表明,长期周期性的有机添加会引起土壤微生物群落结构的改变[22]。研究发现,长期秸秆还田会引起土壤中镰刀属真菌相对丰度的显著增加[23]。镰刀属真菌引起的植物病害问题在全世界的农作物生产中造成巨大的经济损失[24]。本研究发现,镰刀属真菌具有较强的纤维素降解能力。SISTA-KAMESHWAR等[25]通过对不同类型腐生真菌的研究中同样证明了镰刀属真菌具有较强的纤维素、半纤维素和果胶降解能力。SARSAIYA等[26]利用羧甲基纤维素钠为底物的Mander培养基筛选纤维素降解真菌的研究中,检测到粉红镰刀菌(Fusariumroseum)可以产生较高活性的外切β-葡聚糖酶和内切β-葡聚糖酶,尖孢镰刀菌(Fusariumoxysporum)可产生内切β-葡聚糖酶。尖孢镰刀菌、轮枝镰孢菌(Fusariumverticillioides)[27]、茄镰刀菌(Fusariumsolani)[28]都被证明可以高效降解纤维素。其中,茄镰刀菌(Fusariumsolani)被证实在防治作物真菌病害、促进作物生长等方面有良好效果[29]。CHANG等[30]通过对镰刀菌Q7-31T所产生的内切β-葡聚糖酶和蛋白酶的分离纯化和酶学性质的深入研究表明,该菌产生的酶在45 ℃时水浴30 min后仍然具有80%的生物活性,并在pH值5.0~8.0的范围内可以保持70%以上的生物活性,并能够高效降解羧甲基纤维素钠。GAWADE等[31]的研究表明,镰刀属致病真菌所产生的胞外酶,如纤维素分解酶、半纤维素分解酶、果胶分解酶和蛋白水解酶的活性在一定程度上决定了该病菌对寄主植物的侵染速率。由此可见,在没有拮抗微生物存在的条件下,以镰刀菌为主的病原真菌丰度在秸秆还田条件下的增加有一定的必然性,探索其拮抗物种对于土壤安全和植物健康意义重大。 木霉属真菌在控制镰刀菌引起的植物病害方面有巨大的潜力[32]。在本研究中,绿色木霉(Trichodermavirens)对茄镰刀菌和禾谷镰刀菌(Fsariumaminearum)均产生抑制效果,对尖孢镰刀菌和层生镰刀菌(Fusariumproliferatum)无明显效果。哈茨木霉(Trichodermaharzianum)对镰刀菌属的4株病原真菌均有效。木霉属真菌在土壤、作物根系和叶面中广泛存在,被作为抗真菌病原体的生防制剂而广泛应用[33]。该属真菌对番茄晚疫病[34]、茎腐病[34]等常见植物真菌病害的防治有显著的效果。平板培养拮抗试验发现,木霉属真菌对茎腐病的抑制率达到69.52%~81.43%,同时会导致致病菌丝由白色变为棕红[34]。研究表明,木霉属真菌对病原真菌的抑制不仅仅表现在养分和生长空间的争夺上[35],其产生的挥发性物质苯基乙醇有效地抑制病原真菌的生长。抗生素类物质如滴虫素Ⅵ,Ⅶ和Ⅷ均在木霉属真菌产生的分泌物种被分离提纯,并且在不同pH值、温度甚至高压灭菌条件下都保持生物活性,具有良好的抑菌效果[36]。BENTEZ等[37]的研究表明,木霉属真菌可以寄生在纹枯病菌(Rhizoctoniasolani)菌丝体上,通过分泌几丁质酶、β-葡聚糖酶和蛋白酶等裂解酶破坏寄主的细胞壁,从而达到杀死病菌的效果。亦有研究认为,木霉属真菌可以诱导植物产生抗性抵御病原真菌的侵染[38]。结合转录组测序结果,木霉属真菌可以诱导植物产生生长素,并降低细胞分裂素和脱落酸的含量,从而促进植株的生长[39]。自从20世纪60年代木霉属真菌的纤维素降解能力被发现以来,人们不断探索利用化学或物理诱变产生更高效纤维素酶突变体[40-41]。里氏木霉(Trichodermareesei)作为生物纤维素酶来源之一而被深入研究。在纤维素为底物条件下培养24 h后开始产生纤维素酶,并在48 h左右表现出最快的纤维素酶活性增强过程,72 h后达到稳定状态,对纤维素底物具有很高的水解能力[42]。同时,哈茨木霉(Trichodermaharzianum)同样被证实可以产生活性较高的几丁质酶和纤维素酶[43]。木霉属真菌在工业领域被用于生产果胶酶、纤维素酶、几丁质酶等多种酶类,在食品、纺织、酿造等领域也发挥着巨大作用[44]。本研究显示,筛选得到的11株木霉属真菌均具有纤维素降解能力。 纤维素作为世界上产量最大的可再生资源,其利用率极低。木霉属和镰刀属真菌在自然界生存范围极为广泛,可以利用这两个属的真菌降解纤维素,已达到资源的最大化利用。其中,木霉属真菌对多种致病真菌有极为有效的防治作用,在开发生防制剂方面的应用更加广阔,不仅能够防治真菌病害,还有利于作物的生长与产量的增加。根据本研究结果,不仅可以快速锁定抑制病害微生物的菌种,同时可以避免对某些益生菌的抑制,有效提高真菌病害的生物防治效果,并在一定程度上促进作物生长与产量的增加。 从目前实际情况来看,几乎所有的秸秆还田措施均配合化肥的施用。化肥除了给植物的生长提供养分外,也为秸秆降解真菌提供了氮磷钾等营养元素,对真菌的生长产生显著影响。研究表明,当以磷酸氢二铵和尿素作为氮源时,拟康宁木霉的产孢数量大于以硫酸铵和硝酸铵为氮源的情况,而菌丝长速则低于以硫酸铵和硝酸铵为氮源的情况[45]。磷酸氢二铵、硝酸铵对深色有隔内生真菌沙门外瓶柄霉生物量的促进要远高于尿素和硫酸铵;硝酸铵和硫酸铵对另一种深色有隔真菌甘瓶霉生物量的促进作用是尿素和磷酸氢二铵的两倍[46]。由此可见,即便是发挥同样功能或亲缘关系很近的真菌,其对不同氮源添加的响应亦不同。然而,这些有机无机肥料的添加如何影响有益菌和病原菌之间的拮抗关系尚未得到研究。而这项研究在指导秸秆还田农田施肥措施上具有重大的应用价值。通过探索不同类型肥料对病原菌和有益菌之间的拮抗关系的影响,有益于因地制宜地解决好秸秆还田引起的河南省农作物土传病害频发的问题,对于全面地研究河南省其他类型土壤适宜的施肥措施具有极强的参考价值和现实意义,以期付出最小的环境代价、人力物力成本来保证高效率的农业生产。1.4 拮抗试验
2 结果与分析
2.1 菌种的筛选、秸秆降解能力及抗病潜力预判


2.2 纤维素降解能力预判
2.3 拮抗试验

3 结论与讨论

