朝天椒辣椒素含量及辣椒表型与亲代相关性分析
毛丹 梁芳芳 孙朝霞 赵鹏飞
摘要 选用朝天椒品系A1、B173这2份材料的F2代群体,运用SSR构建辣椒分子连锁图谱,进行辣椒素、二氢辣椒素含量的QTL分析。结果表明,F2个体的辣椒素含量和二氢辣椒素含量的变异范围超出亲本的范围,为辣椒素和二氢辣椒素的QTL性状分子标记筛选提供了较好的遗传基础。利用筛选出来的 62对SSR 标记对群体DNA 进行遗传分析,共检测到2个辣椒素QTL 位点,3个二氢辣椒素QTL 位点;将10个连锁群与辣椒染色體进行了对应,以上5个QTL位点可能均位于2号染色体上。该研究对朝天椒辣椒素含量的遗传控制和分子标记辅助选择具有重要意义。
关键词 朝天椒;辣椒素;二氢辣椒素;数量性状位点
中图分类号 S 641.3文献标识码 A
文章编号 0517-6611(2022)04-0048-03
doi:10.3969/j.issn.0517-6611.2022.04.015
开放科学(资源服务)标识码(OSID):
CapsaicinContent and Phenotype of CorrelationAnalysis with Capsicum annuumParents
MAO Dan1,2,LIANG Fang-fang3,SUN Chao-xia4 et al (1.Henan Dingyou Agricultural Technology Co.,Ltd.,Zhengzhou,Henan 450015;2.Henan Seed Station, Zhengzhou,Henan 450015;3.Henan Vocational College of Agriculture,Zhongmu,Henan451450;4.Henan Red and Green Pepper Seed Industry,Zhengzhou,Henan 450004)
Abstract In this experiment,F2 populations of pepper strains A1 and B173 were selected to construct pepper molecular linkage map by SSR,and QTL analysis of capsaicin and dihydrocapsaicin content was carried out.The results showed that the variation range of capsaicin and dihydrocapsaicin content in F2 individuals were beyond the range of parents.It provided a good genetic basis for molecular marker screening of capsaicin and dihydrocapsaicin trait QTL.The 62 pairs of SSR markers were used for genetic analysis of population DNA.A total of 2 capsaicin QTL loci and 3 dihydrocapsaicin QTL loci were detected.Five QTL locus related to capsaicin and dihydrocapsaicin content were detected on P2 chromosomes.The results will be of great significance for the genetic control of capsaicin content and molecular marker assisted selection.
Key words Capsicum frutescensr;Capsaicin;Dihydrocapsaicin;QTL(Quantitative Trait Loci)
基金项目 郑州市第四批“智慧郑州”1125聚才计划人才团队“朝天椒抗病优质基因资源挖掘及杂交优势利用”(郑政预〔2019〕673号);河南农业职业学院科研创新人才项目(HNACSRHR-2021-05)。
作者简介 毛丹(1975—),男,河南许昌人,高级农艺师,硕士,从事农作物试验与示范研究。*通信作者,副教授,硕士,从事蔬菜教学和研究。
收稿日期 2021-12-22;修回日期 2021-12-27
辣椒(Capsicum annuum L.)为茄科(Solanaceae)辣椒属(Capsicum)作物,目前在世界范围内都是主要的经济作物,特别是在中国和韩国[1-3]。朝天椒(Capsicum frutescensr)是辣椒变种,常作一年生栽培。与辣味相关的辣椒素类物质有辣椒素(capsaicin)、二氢辣椒素(dihydrocapsaicin)、高辣椒素、高二氢辣椒素和降二氢辣椒素5类[4]。辣椒素和二氢辣椒素是起主要作用的辣椒素,提供了约90%的辣感和热感,约占总量的90%[5-6]。辣椒素(capsaicin)具有预防心血管疾病和消化道疾病、减肥等药理作用[7-11]。Kim等[12]研究证明辣椒素能改变细胞相关基因的表达。笔者选用朝天椒品系A1、B173这2份材料的F2代群体,运用SSR构建辣椒分子连锁图谱,进行辣椒素、二氢辣椒素含量的QTL分析,以期检测辣椒素QTL 位点和二氢辣椒素QTL 位点,明确辣椒素含量及辣椒表型与亲代相关性,为加快高辣朝天椒新品种培育提供理论基础。
1 材料与方法
1.1 试验材料
2019年4月和5月,以朝天椒品系A1为父本、品系B173为母本配制杂交组合,2020年获得F1单株,进一步自交产生F2,2021年种植F2分离群体,同时种植亲本朝天椒品系A1、B173和F1、F2分离群体共76个单株。2019—2021年所有试验材料均种植在河南农业职业学院高新科技园试验基地。苗期取样提取基因组DNA;果实青熟时采集果实测定辣椒素和二氢辣椒素含量。
1.2 辣椒素和二氢辣椒素的测定 利用超高效液相色谱(UPLC)测定朝天椒辣椒素和二氢辣椒素含量。
1.3 辣椒素含量的 QTL定位
1.3.1 基因组DNA的提取。苗期取辣椒品系A1、B173、F1和F2分离群体的幼嫩真叶,F2分离群体按单株取样。DNA 提取方法采用CTAB 法[13]。
1.3.2 SSR标记引物。
利用300 对均匀分布在辣椒染色体上的SSR 引物对辣椒亲本进行多样性筛选[14-17]。SSR 标记的PCR 反应采用25 μL 反应体系,包括20 ng总 DNA、0.2 mmol/L dNTP、0.5 U Taq DNA 聚合酶、2 mmol/L Mg2+(10×buffer)、正向和反向引物各0.33 μmol/L。SSR 标记反应程序:94 ℃ 预变性3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,35 次循环;72 ℃延伸10 min。PCR 反应产物用 10% 变性聚丙烯酰胺凝胶进行电泳,电泳缓冲液为1倍TBE,180 V恒压电泳1.0~1.5 h。
1.3.3 聚丙烯酰胺凝胶电泳和银染显色。参考Mimura聚丙烯酰胺凝胶电泳和银染显色[17]。
1.3.4 遗传连锁图谱构建和QTL定位。筛选在父母本间表现多态的SSR 标记;利用获得的多态性引物分析F2群体各单株基因型;将筛选到的亲本和F2群体中多态性标记数据导入软件进行分析并构建遗传连锁图[18]。采用 Kosambi 函数计算遗传距离,利用软件区间作图法进行 QTL 定位。
2 结果与分析
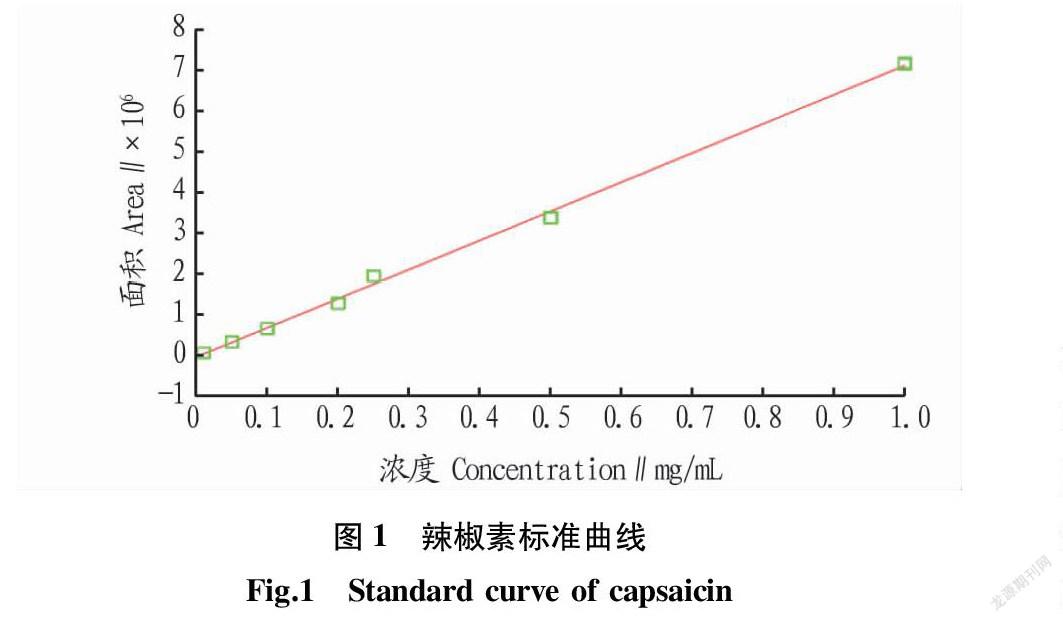
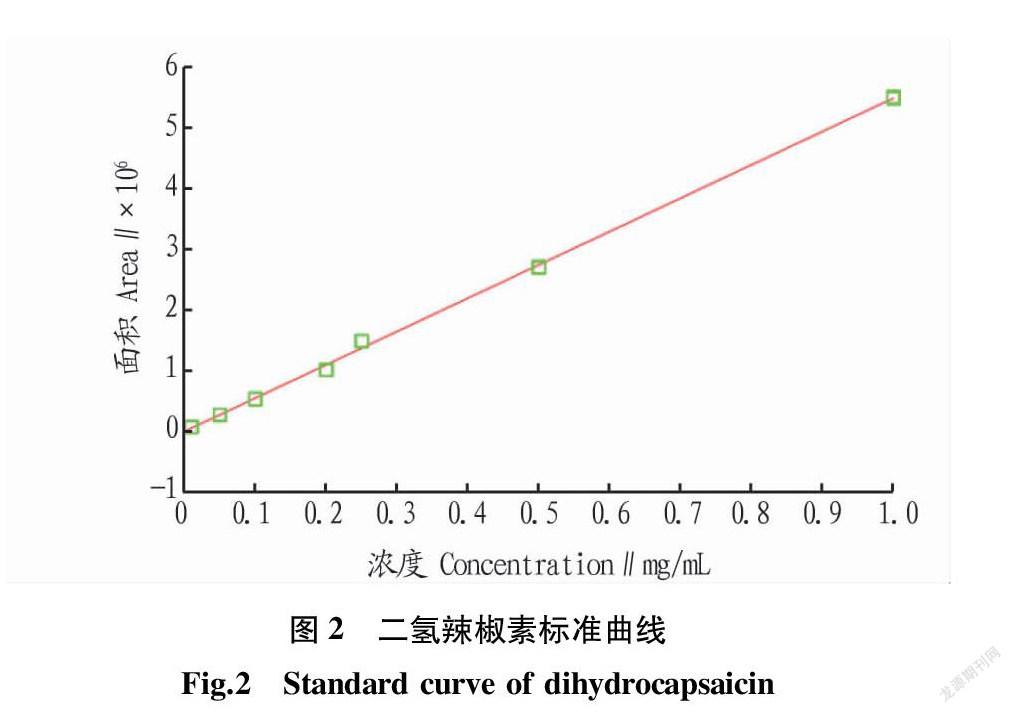
2.1 标准曲线
由图1和图2可知,辣椒素的回归方程为Y=106X-568.73,R2=0.997 8,二氢辣椒素的回归方程为Y=6 386 890X+2 962.65,R2=0.998 9,表明辣椒素和二氢辣椒素在0.01~1.00 mg/mL线性关系良好,即峰面积与进样量有良好的线性关系。
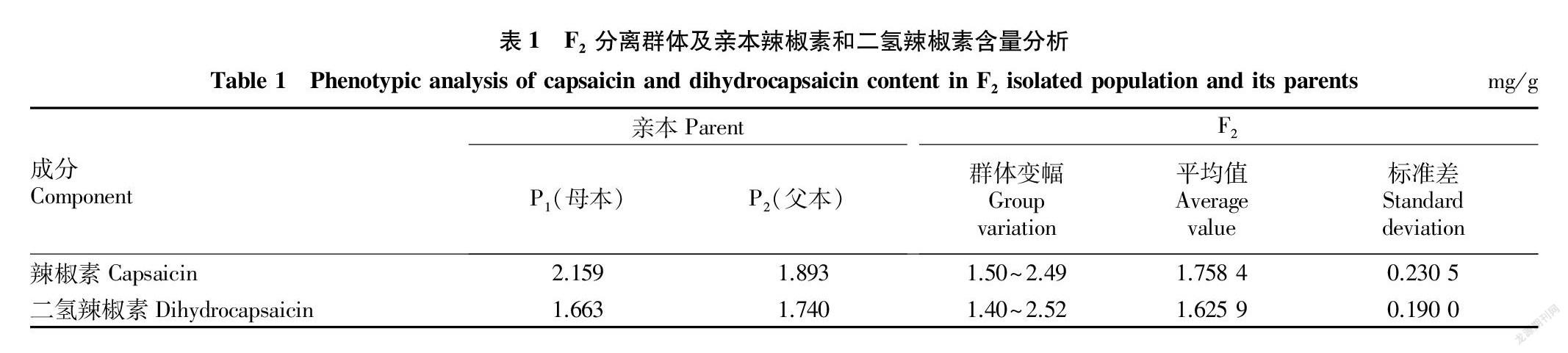
2.2 辣椒素和二氢辣椒素含量
取亲本、杂交F1和F2分离群体的辣椒样品,测定峰面积,计算辣椒素和二氢辣椒素含量,对F2个体的辣椒素和二氢辣椒素含量分析表明,其性状的变异范围超出了亲本的范围(表1),说明控制这2个性状的增效基因和减效基因在双亲中是分散的,这为辣椒素和二氢辣椒素性状QTL的分子标记筛选提供了较好的遗传基础。F2群体的辣椒素和二氢辣椒素含量均表现出超亲分离现象,适合QTL的定位分析。
2.3 标记的筛选
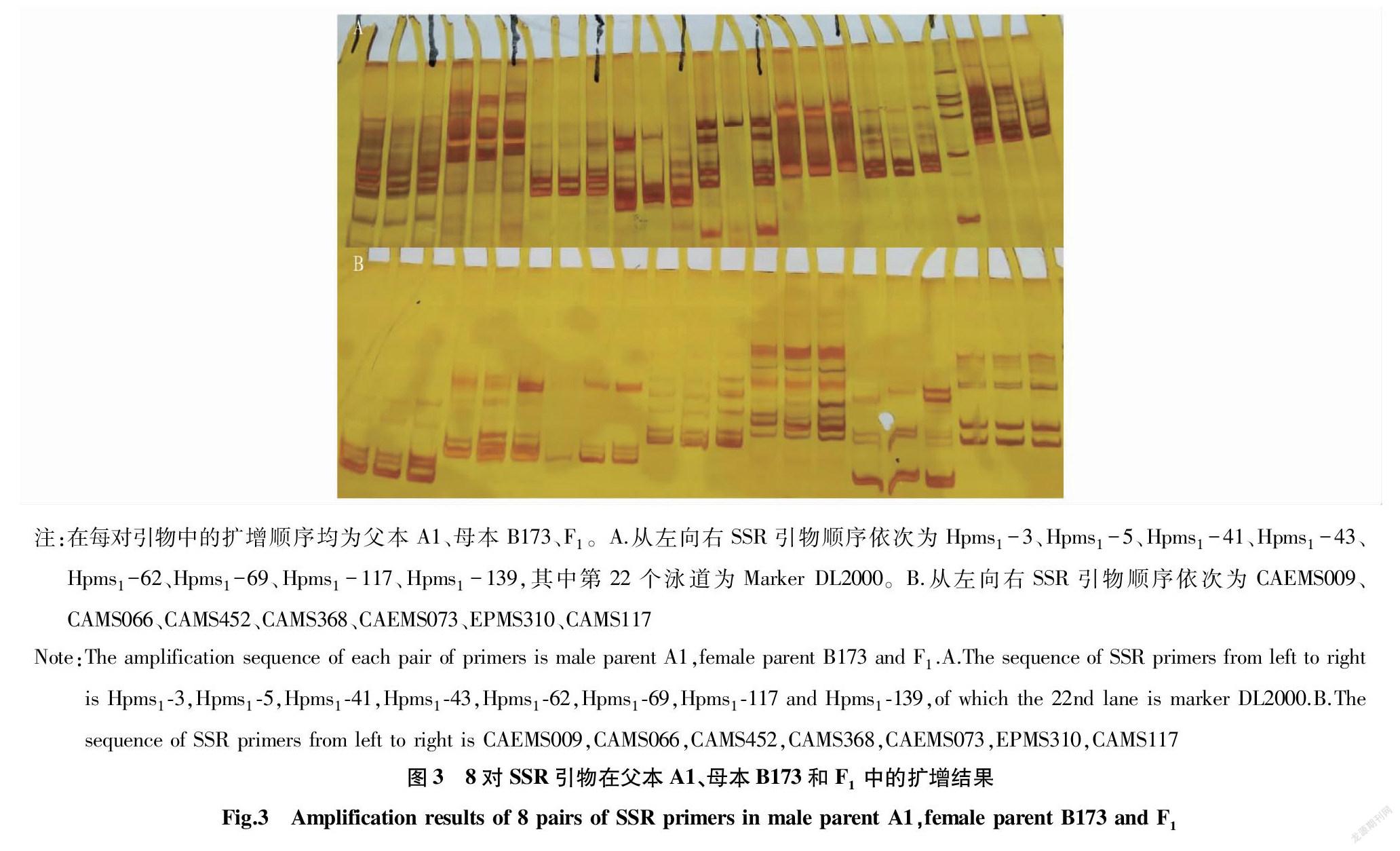
利用已公布的300 对SSR 引物对两亲本辣椒品系A1、品系B173及其F1进行差异引物筛选,在两亲本间有差异的引物共有62对,占所有用于扩增引物的20.67%(图3)。
2.4 群体分析、图谱构建QTL位点的定位分析
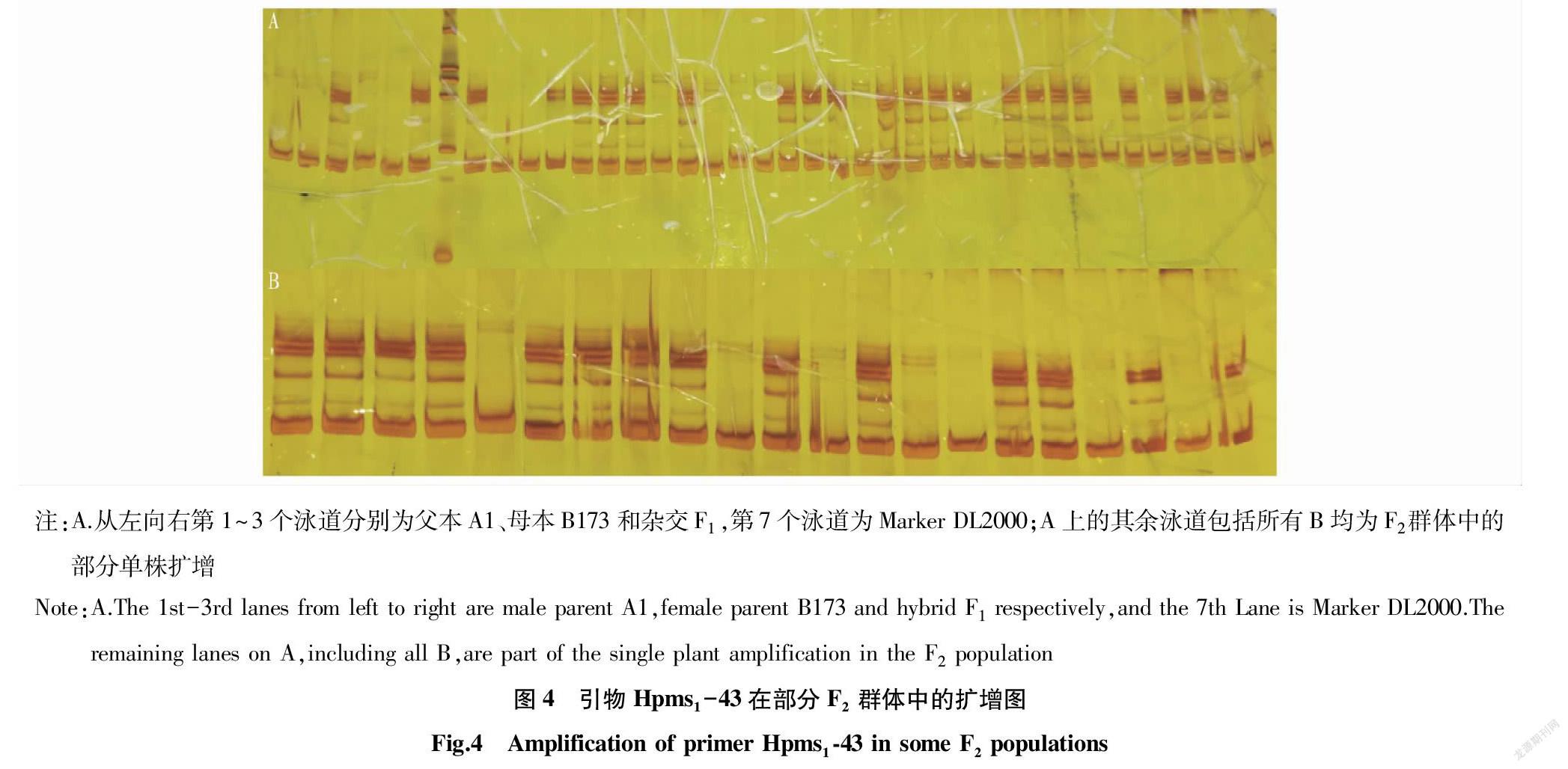
利用筛选出来的 62对SSR 标记对群体DNA 进行遗传分析(图 4),对多态性标记位点的分离比例与孟德尔理论分离比例3∶1(完全显性)和1∶2∶1(共显性)进行了χ2测验,有9对引物表现偏分离,其余均符合孟德尔分离比例。采用 JionMap 4.0 对标记统计数据进行遗传连锁性分析,构建了由10个连锁群构成的遗传连锁图谱,其上共有65个SSR标记。共检测到2个辣椒素QTL 位点, 3个二氢辣椒素QTL 位点。参照辣椒遗传连锁图谱,将10个连锁群与辣椒染色体进行了对应,以上5个QTL位点可能均位于2号染色体上。
3 结论与讨论
通过采集青熟时果实,对亲本朝天椒品系A1、B173和F1、F2分离群体的辣椒素和二氢辣椒素含量进行分析,结果表明,F2 群体的辣椒素和二氢辣椒素含量均表现出超亲分离现象,适合QTL的定位分析。利用已公布的300 對SSR 引物对两亲本朝天椒品系A1、品系B173及其F1进行差异引物筛选,在两亲本间有差异的引物共有62对,占所有用于扩增引物的20.67%。利用筛选出来的 62对SSR 标记对群体DNA 进行遗传分析,对多态性标记位点的分离比例与孟德尔理论分离比例3∶1(完全显性)和1∶2∶1(共显性)进行了χ2测验,有9对引物表现偏分离,其余均符合孟德尔分离比例。偏分离位点的发现、标记定位和遗传效应研究都需要有高密度的分子遗传图谱为基础,目前绝大多数重要植物上开展了遗传作图[19]。构建了由10个连锁群构成的遗传连锁图谱,其上共有65个SSR标记。共检测到2个辣椒素QTL 位点, 3个二氢辣椒素QTL 位点。参照辣椒遗传连锁图谱,将10个连锁群与辣椒染色体进行了对应,以上5个QTL位点可能均位于2号染色体上。5个QTL位点的发现,初步明确了辣椒素含量及辣椒表型与亲代相关性,为加快高辣朝天椒新品种培育提供理论基础。
参考文献
[1]
CHEN C M,HAO X F,CHEN G J,et al.Characterization of a new male sterility-related gene Camf1 in Capsicum annum L.[J].Molecular biology reports,2011,39(1):737-744.
[2] 邹学校,张竹青,陈文超,等.辣椒果实性状的遗传分析[J].西北植物学报,2007,27(3):497-501.
[3] 刘辰,马宁,付楠,等.辣椒GMS育性相关候选基因的克隆及表达分析[J].中国农业科学,2014,47(16):3264-3276.
[4] KORKUTATA N F,KAVAZ A.A comparative study of ascorbic acid and capsaicinoid contents in red hot peppers (Capsium annum L.) grown in Southeastern Anatolia Region[J].International journal of food properties,2015,18(4):725-734.
[5] USMAN M G,RAFII M Y,ISMAIL M R,et al.Capsaicin and dihydrocapsaicin determination in chili pepper genotypes using ultra-fast liquid chromatography[J].Molecules,2014,19(5):6474-6488.
[6] WU S X,ZENG J M,XIE H,et al.Capsaicin determination and chili sauce discrimination using low-cost and portable electrochemical sensors based on all graphite pencil electrodes[J].Analytical methods,2016,8(39):7025-7029.
[7] MAIHFNER C,SCHMELZ M,FORSTER C,et al.Neural activation during experimental allodynia:A functional magnetic resonance imaging study [J].European journal of neuroscience,2004,19(12):3211-3218.
[8] KEMPAIAH R K,MANJUNATHA H,SRINIVASAN K.Protective effect of dietary capsaicin on induced oxidation of low-density lipoprotein in rats [J].Molecular and cellular biochemistry,2005,275(1/2):7-13.
[9] KATAGIRI F,INOUE S,SATO Y,et al.Ecabet sodium raises plasma levels of calcitonin gene-related peptide and substance P in healthy humans[J].Journal of pharmacy and pharmacology,2010,57(6):799-805.
[10] BARTNESS T J,SONG C K,SHI H F,et al.Brain-adipose tissue cross talk[J].Proceedings of the nutrition society,2005,64(1):53-64.
[11] 姜越君,刘素纯,李佳莲,等.辣椒素的生理功能及提取研究进展[J].安徽农业科学,2009,37(31):15426-15428.
[12] KIM J D,KIM J M,PYO J O,et al.Capsaicin can alter the expression of tumor forming-related genes which might be followed by induction of apoptosis of a Korean stomach cancer cell line,SNU-1[J].Cancer letters,1997,120(2):235-241.
[13] KUMAR S,RAI M.Chile in India[J].Theoretical and applied genetics,2005,75:224-228.
[14] LEE J M,NAHM S H,KIM Y M,et al.Characterization and molecular genetic mapping of microsatellite loci in pepper[J].Theoretical and applied genetics,2004,108(4):619-627.
[15] YI G,LEE J M,LEE S,et al.Exploitation of pepper EST-SSRs and an SSR-based linkage map[J].Theoretical and applied genetics,2006,114(1):113-130.
[16]
MINAMIYAMA Y,TSURO M,HIRAI M.An SSR-based linkage map of Capsicum annuum[J].Molecular breeding,2006,18(2):157-169.
[17] MIMURA Y,INOUE T,MINAMIYAMA Y,et al.An SSR-based genetic map of pepper (Capsicumannuum L.) serves as an anchor for the alignment of major pepper maps[J].Breeding science,2012,62(1):93-98.
[18] VAN OOIJEN J W.JoinMap 4:Software for the calculation of genetic linkage maps in experimental populations[M].Wageningen,Netherlands:Kyazma BV,2006.
[19] 宋憲亮,孙学振,张天真.偏分离及对植物遗传作图的影响[J].农业生物技术学报,2006,14(2):286-292.
3856500338252

