基于环境DNA宏条形码技术的秦淮河生物多样性研究
王 晨,陶 孟,李爱民,*,施 鹏,杨江华,,王志浩,张效伟,
1 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210023 2 南京易基诺环保科技有限公司,南京 211100
淡水生态系统虽仅占地球表面的0.8%,但其独特的生境却为全球6%的已知物种提供了栖息地[1]。而它所面临的生物多样性危机却不断加深,据世界自然基金组织(World Wide Fund for Nature,WWF)报道[2],到2014年,淡水脊椎动物的地球生命力指数(Living Planet Index,LPI)已经下降了83%。随着淡水生态系统生物多样性不断丧失[3],生物多样性保护也受到了广泛的关注和认可[4—5],而物种资源调研作为生物多样性保护的基础,其紧迫性不容小觑。
秦淮河是南京的母亲河,但近几十年来,剧烈的城市化进程严重破坏了秦淮河的水生生态系统。目前针对秦淮河生物多样性的研究较少,已有研究主要集中在秦淮河局部河段的常规水质指标分布[6]、细菌的群落结构[7—8]、单一物种群落结构[9—13]和水资源保护与治理途径[14]上,缺乏对秦淮河生物多样性全貌的整体调研。而生物多样性的调研对调研技术的科学性、全面性均提出了更高的标准,先前零散的调查[10—13]已无法满足现阶段的研究和管理需求。
环境DNA宏条形码技术是将高通量测序(High throughput sequencing,HTS)技术与生物识别的DNA条形码相结合,利用HTS获得条形码基因扩增子,通过生物信息学手段分析鉴定群落的物种组成[15]。相较于传统的条形码,环境DNA宏条形码因具有更高的扩增速度、精度以及更低的成本而受到了广泛的关注[16—17]。大量研究表明,环境DNA宏条形码可用于水生生态系统的生物监测[17—20]。不同的引物对生物类群的偏好不同[15],线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)[21—22]、18S-V9 rDNA[23—24]和12S rRNA[25—26]分别广泛用于大型无脊椎动物、真核生物和脊椎动物多样性研究。国内环境DNA宏条形码在淡水生态系统中的应用虽有报道,但主要集中在个别种群[27—28],全面的生物多样性监测在国内报道较为罕见。
本研究以秦淮河为研究区域,利用环境DNA宏条形码评估秦淮河淡水生态系统中生物多样性,探究(1)秦淮河生物多样性的组成;(2)上下游生物多样性的差异;(3)生物多样性与环境因子的关系,以期为秦淮河的生物多样性保护提供参考。
1 材料与方法
1.1 采样点位及环境DNA样本采集
秦淮河位于长江下游,共有南北两源,北源句容河发源于句容市宝华山南麓,南源溧水河发源于南京市溧水区东庐山。于2019年7月,在秦淮河主干共设置32个采样点,具体采样点位信息见图1、表1。每个采样点位采集3L表层水样,采集后在24h内,每个点位300mL水样使用0.22μm无菌滤膜(广东环凯微生物科技有限公司)真空抽滤得到滤膜(各点位5—7个平行),滤膜保存至-80℃冰箱中,直至DNA提取。
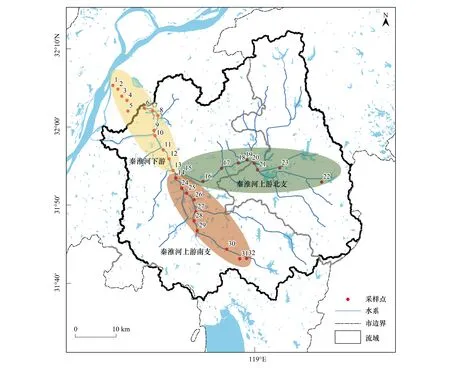
图1 秦淮河采样点位图Fig.1 Sampling sites in Nanjing city of Qinhuai River图中数字表示采样点位序号

表1 秦淮河点位分组
1.2 环境因子的测定
采用便携式水质参数仪(HACH SL1000)现场测定pH值和溶解氧(DO);采集后的水样运回实验室后在24h内测定完其理化指标。氨氮(NH3-N)、总磷(TP)和总氮(TN)使用国家标准方法测定;亚硝酸盐氮(NO2-N)和硝酸盐氮(NO3-N)过0.45μm的水膜后使用离子色谱(Thermo Fisher ICS5000+)测定;总有机碳(TOC)使用TOC仪(耶拿 multi N/C 3100)测定;化学需氧量(COD)使用哈希COD仪(DR 2800)测定。
1.3 DNA提取及PCR扩增
使用MO BIO PowerSoil®DNA分离试剂盒(QIAGEN)提取DNA。提取完成后,使用NanoDrop测定DNA的浓度及质量。针对不同生物类群选择不同的PCR引物进行测试,详见表2。12S引物PCR扩增总体系50 μL,包含2×Taq Plus Master Mix Ⅱ 25 μL(诺唯赞),上下游引物各2 μL,DNA模板2 μL,ddH2O 19 μL,扩增片段长度170 bp;扩增条件:95℃预变性3 min,95℃变性15 s,62.4℃退火20 s,72℃延伸20 s,30个循环。18S-V9引物PCR扩增总体系50 μL,包含2×Phanta Max Master Mix 25 μL(诺唯赞),上下游引物各2 μL,DNA模板2 μL,ddH2O 19 μL,扩增片段长度130 bp;扩增条件:95℃预变性3 min,95℃变性20 s,59℃退火20 s,72℃延伸15 s,25个循环。COI引物反应体系与18S-V9引物一致,扩增片段长度310 bp;反应条件:95℃预变性2 min,95℃变性15 s,46℃退火30 s,72℃延伸40 s,35个循环。PCR产物使用琼脂糖凝胶电泳检测,琼脂糖凝胶浓度为2%,核酸染料采用GelRed,电泳电压110V,电泳时间30min,使用100bp DNA Ladder对产物DNA链长度进行大致划分。电泳完成后,使用ImageLab判断电泳是否成功,要求PCR扩增产物有目的条带,且条带清晰单一,阴性对照无显著条带。最后使用磁珠法对PCR产物进行纯化处理,并利用Qubit测定纯化产物浓度,纯化产物DNA浓度要求大于2.5 ng/μL。

表2 DNA提取引物信息
1.4 高通量测序
委托南京易基诺环保科技有限公司进行测序。使用NEBNext Fast DNA Library Prep Set for Ion Torrent (E6270)试剂盒进行测序文库的构建。利用凝胶电泳对所构建的文库质量进行检查,并使用Qubit进行文库浓度定量。最后选用Chip 530芯片在Ion Torrent S5平台进行二代测序。
1.5 生物信息学数据数据分析
根据UPARSE将序列以97%的相似性(18S和COI)和99%(12S)聚类到可操作的分类单元(Operational Taxonomic Units,OTUs)。对于18S和COI的OTU使用核糖体数据库(Ribosomal Database Project,RDP)进行分类并在Greengenes[29]和SILVA[30]数据库中进行注释;12S OTU代表序列在NCBI中的核苷酸数据库GenBank中进行注释[31]。将分属同一类群的OTU组合,以估计该类群的丰度。Shannon-Weiner指数、主坐标分析、PERMANOVA检验及相似性距离关系等统计分析均使用R软件(3.5.3)中的vagan包,可视化绘图使用R软件中ggplot2包及Origin 2020b。
2 结果与分析
2.1 秦淮河环境DNA物种注释
秦淮河32个采样点位环境DNA宏条形码测试结果及物种注释结果如表3所示。
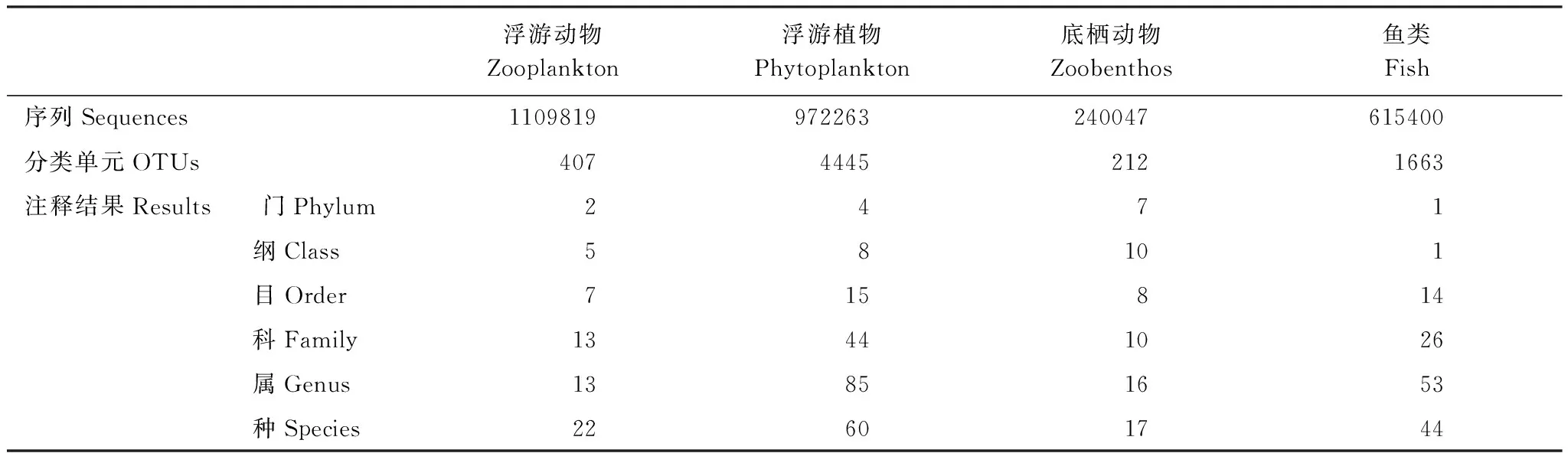
表3 秦淮河环境DNA宏条形码测试结果
2.2 秦淮河物种分布
2.2.1秦淮河浮游动物(目水平)分布
综合32个点位浮游动物目水平注释结果,秦淮河游泳轮虫目(Ploima)、双甲目(Diplostraca)和未归类的浮游动物(unassignedzooplankton)的序列数占比较高,分别占比31.95%、31.42%和27.40%。但是不同点位优势种占比差异较大,点位9中双甲目(Diplostraca)占比高达95.91%,点位15中游泳轮虫目(Ploima)占比高达75.08%,点位27和28中未归类的浮游动物(unassignedzooplankton)占比较高。
2.2.2秦淮河浮游植物(门水平)分布
秦淮河中浮游植物的优势种群为隐藻门(Cryptomonas)、褐藻门(Ochrophyta)及绿藻门(Chlorophyta),其序列数占比分别为46.35%、41.76%和5.85%,占序列总数的93.96%。点位15隐藻(Cryptomonas)占比最高,为72.53%;点位23褐藻(Ochrophyta)占比最高,为86.42%。上游北支(点位15—23)呈现出,从上游到下游,隐藻占比逐渐下降而褐藻占比逐渐上升的趋势;下游(点位1—13)除点位6外和上游南支(点位14、点位24—32),隐藻和褐藻占比变化不大。
2.2.3秦淮河底栖动物(门水平)分布
秦淮河中底栖动物序列数占比较高的种群为节肢动物门(Arthropoda)和刺胞动物门(Cnidaria),其占比分别为91.67%和7.13%,占总序列的98.8%。虽然软体动物门(Mollusca)在总序列中占比较低,但在点位23中占比达45.75%。相较于浮游动物而言,底栖动物测得的总序列数较少,仅占COⅠ引物测序总数的17.78%。
2.2.4秦淮河鱼类(目水平)分布
鱼类属于辐鳍鱼纲,共检出14目。其中鲤形目(Cypriniformes)、虾虎鱼目(Gobiiformes)和鲱形目(Clupeiformes)为优势种群,占比分别为69.99%、15.86%和5.42%。鲤形目(Cypriniformes)在32个点位中占比均最高,占比区间为51.81%—81.34%。除个别点位(点位10、点位24和点位25)外,秦淮河鱼类分布占比较为平均。

图2 秦淮河浮游动物目水平占比Fig.2 Proportion of zooplankton classified in Order level in Qinhuai River
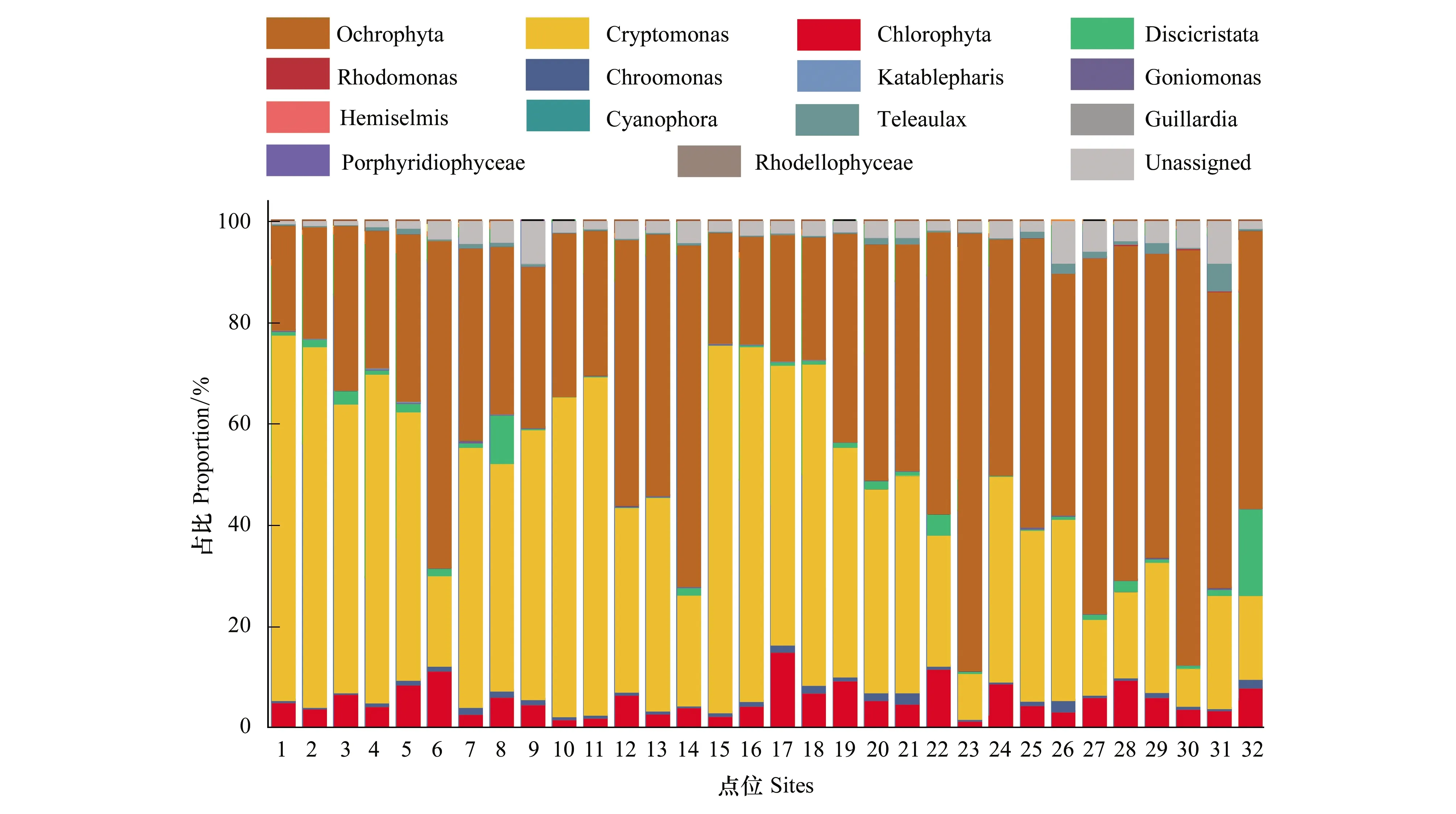
图3 秦淮河浮游植物门水平占比Fig.3 Proportion of phytoplankton classified in Phylum level in Qinhuai River

图4 秦淮河底栖动物门水平占比Fig.4 Proportion of zoobenthos classified in Phylum level in Qinhuai River
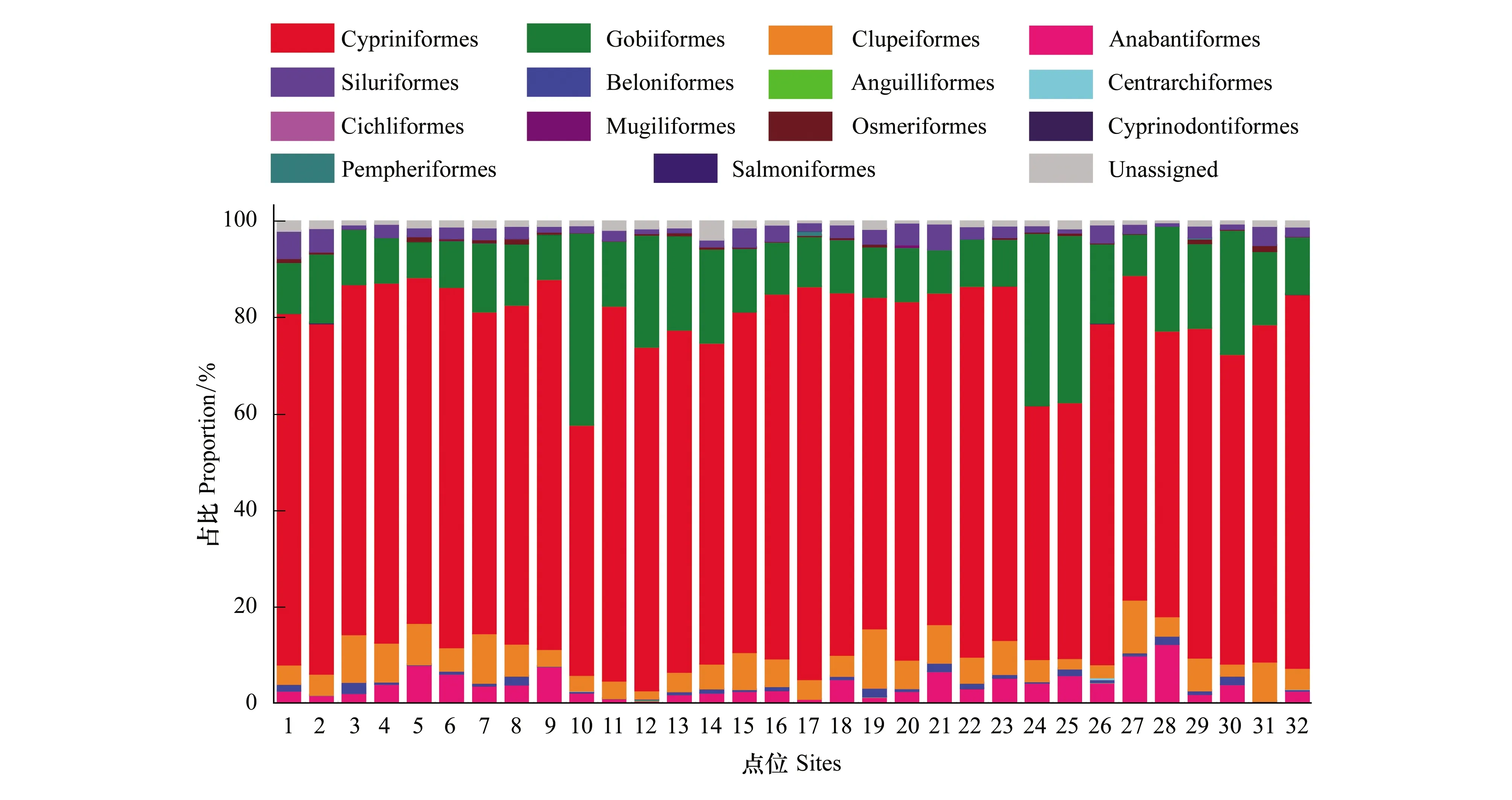
图5 秦淮河鱼类目水平占比Fig.5 Proportion of fish classified in Order level in Qinhuai River
2.3 秦淮河生物多样性
Shannon-Weiner指数常用来评价群落生境内的α多样性。秦淮河的生物多样性状况如图6所示。秦淮河浮游动物Shannon-Weiner指数均值在1.22—4.03之间,点位9浮游动物多样性状况较差,上游浮游动物多样性比下游更丰富;浮游植物Shannon-Weiner指数均值范围为3.64—6.48,上游南支浮游植物多样性均比较丰富,上游北支和下游均呈现多样性从上游到下游逐渐降低的趋势;底栖动物Shannon-Weiner指数均值为1.23—3.26,整体Shannon-Weiner指数偏低,点位31、32和下游底栖动物多样性更贫乏;秦淮河鱼类多样性丰富,Shannon-Weiner指数均值为5.22—6.36。
2.4 秦淮河上下游差异
从Shannon-Weiner指数来看,如图7所示秦淮河上下游各群落α多样性相差较小,为了能更直观地比较各个种群上下游间的差异,本研究对数据进行了降维,并利用PERMANOVA对组间差异从统计学上进行检验。
降维使用了主坐标分析,从可视化结果上看,除鱼类外,秦淮河上下游物种均有显著差异。浮游动物的PCoA图PCo1和PCo2共解释40.65%的差异,其中下游和上游北支均与上游南支差异显著;浮游植物的两个主坐标共解释41.99%的差异,结果与浮游动物类似;底栖动物的两个主坐标共解释35.24%的差异,上游南北支差异显著;鱼类的两个主坐标共解释24.615%的差异,但PCoA图上各组并没有显著分开。因此对数据进行PERMANOVA检验,从统计学判断各组间是否有显著的差异。
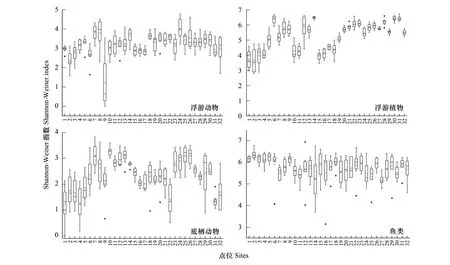
图6 秦淮河生物多样性Fig.6 Alpha(α) diversity in Qinhuai River

图7 秦淮河上下游生物多样性Fig.7 Alpha(α) diversity in the upstream and downstream of Qinhuai River

图8 秦淮河主坐标分析Fig.8 Principal coordinates analysis of species in Qinhuai River
由PERMANOVA检验可知,四类种群上下游各组间均有极显著差异(P<0.001),主坐标分析图重合较多分组的可解释部分(R2)较小,上下游各组间鱼类群落虽然有显著差异,但是R2仅为3.48%,表明上下游位置因素贡献显著但占比较小。上下游位置因素对浮游动物和浮游植物和底栖动物群落差异的贡献较大,R2分别为11.34%、17.52%和9.44%。秦淮河上游不同来源的两支间群落结构也有显著差异。

表4 秦淮河组间差异(PERMANOVA)
2.5 秦淮河物种距离衰减变化

图9 秦淮河物种距离衰减变化Fig.9 Distance-decay relationship of community in Qinhuai River
秦淮河不同物种的距离衰减变化(Distance decay relationship,DDR)趋势不一致。浮游动物、浮游植物和底栖动物都表现出了显著的生物相似性随距离增长而衰减的趋势(P<0.001),其中底栖动物的衰减趋势更强。鱼类没有表现出明显的距离衰减趋势,详见图9。
2.6 秦淮河物种群落与化学指标关系
为了评价秦淮河物种群落与环境因子(TN、TOC、NO2-N、NO3-N、TP、NH3-N、COD、和DO)之间的关系,对其进行了冗余分析,经过膨胀因子检验,去除了共线性显著的NO2-N和NO3-N。其结果如图10所示。置换检验结果表明所选的环境因子(TN、TOC、TP、NH3-N、COD和DO)均对浮游生物和底栖动物群落有极显著的影响(P<0.001);对鱼类群落结构而言,具有极显著影响的是DO、TOC、TN,其次是COD和TP,NH3-N对其影响不显著。
就环境因子影响大小而言,浮游动物的环境因子影响大小排序为:TN>TOC>TP>NH3-N>DO>COD;浮游植物的环境因子影响大小排序为:TOC>TN>DO>TP>COD>NH3-N;底栖动物的环境因子影响大小排序为:TOC>COD>TN>TP>NH3-N>DO;鱼类的环境因子影响大小排序为:TOC>DO>TN>COD>TP。

图10 秦淮河物种群落与环境因子的冗余分析Fig.10 Redundancy analysis ordination plot of OTUs of Qinhuai River constrained by environmental variables
3 讨论
3.1 秦淮河物种组成及水质状况
调研期间,秦淮河32个采样点位环境DNA宏条形码技术鉴定到:浮游动物13属22种407个OTUs;浮游植物85属60种4445个OTUs;底栖动物16属17种212个OTUs;鱼类53属44种1663个OTUs。其中浮游动物以游泳轮虫目(Ploima)和双甲目(Diplostraca)为主,共占比63.37%;浮游植物以隐藻门(Cryptomonas)和褐藻门(Ochrophyta)为主,共占比88.11%;底栖动物中节肢动物门(Arthropoda)占比最高,达91.67%;鱼类中鲤形目(Cypriniformes)占比最高,达69.99%。
石晓丹等[13]2005年在秦淮河流域通过常规形态学鉴定共检出浮游动物13种,以轮虫为主,轮虫占全部种类的69.2%,本次调研中,虽轮虫占比不及2005年,但也为秦淮河浮游动物中的优势种。石晓丹等[13]于2005年调研秦淮河的浮游植物,调研表明共检出43种,以硅藻门和绿藻门为主;严莹[10]于秋冬季对秦淮河的调研共检出浮游植物37种,以蓝藻和硅藻为主。本次调研中浮游植物的检出结果与以往的文献报道有较大差异,一方面是由于时间的变化,调研时间跨度较久,浮游植物的变化较大,另一方面由于检测方式有差异,今后将进一步探究秦淮河浮游植物的时间变化差异。吴东浩等[12]于2009年4月对秦淮河上游底栖动物进行调查,共获得63个底栖动物分类单元。其中节肢动物门占比最高,达47.6%,这与本次调研有相似的结论,但本次调研中节肢动物门占比更高。秦淮河鱼类资源调研资料暂缺,但毛志刚等[32]于2009—2010年对太湖鱼类资源进行了调研,共捕获鱼类40属50种,其中鲤形目占比最高,为总数的68%。徐念等[28]于2016年1月利用环境DNA宏条形码技术对长江中下游物种进行监测,结果也表明鲤形目在鱼类中占比高达60%。本次调研与文献报道中的长江、太湖流域鱼类监测结果类似,这也与长江鱼类资源鲤科鱼类种类多[33]的特点相吻合。
国内外大量学者研究表明环境DNA宏条形码技术在物种多样性调研方面较传统形态学监测具有显著优势,其具有节省时间、人力成本,不需要专业的形态学鉴定人员等优点[16—17]。且其鉴定结果中的物种丰度较传统形态学监测更高[34—35]。本次调研虽未利用形态学监测进行对比,但与历史文献等相对比,结论具有一定的相似性,同时也为秦淮河整体的类群调研提供了新的思路与方法。
根据Shannon-Weiner指数分级评价标准(表5)[36],秦淮河浮游动物,1个点位多样性“一般”,水体呈现中污染状态,占比3.12%;9个点位多样性“较丰富”,水体呈现轻度污染,占比28.13%;22个点位处于“丰富”,水体清洁,占比68.75%。秦淮河所有点位的浮游植物多样性均为“丰富”。底栖动物中,8个点位多样性“一般”,占比25%;19个点位多样性“较丰富”,占比59.38%;5个点位多样性“丰富”,占比15.62%。秦淮河鱼类Shannon-Weiner指数均大于5,均属于“丰富”级别。总的来说,多样性指数较低的点位多处于下游和上游南支,下游处于城市住宅中心,属于居民密集区,受人为活动影响较大,可能因此多样性较低,水体污染较重;秦淮河上游两支,总体上游南支(南京)α多样性较上游北支(句容)更丰富。

表5 Shannon-Wiener指数(H′)分级评价标准
3.2 秦淮河生物多样性空间差异
本次调研结果表明浮游动物和浮游植物各点位占比差异较大,整体空间变化趋势相似,可能是由于部分浮游动物以浮游植物为食[37];底栖动物上游北支与下游近江(长江)点位丰富度更高;鱼类群落种类整体分布更为均匀,鲤形目在各点位均为优势种。空间分布上,主坐标分析和PERMANOVA组间差异检验表明秦淮河下游、上游南支和上游北支间有极显著差异(P<0.001)。其中浮游动物、浮游植物和底栖动物受分组影响更大,R2分别为0.113、0.175和0.094,分组对鱼类的影响相对较小,R2仅为0.035。除鱼类外,整体上游南支多样性指数(Shannon-Weiner指数)更高,物种更为丰富,表明秦淮河上游南支(南京)水质状况更好。距离衰减关系常用来评估物种对地理或环境距离的响应程度。由于不同生物对同一景观的敏感度不同,因此不同物种的距离衰减关系不同。秦淮河的四个类群中,除鱼类外,其余三个类群均表现出了明显的随距离增加而衰减的趋势。浮游动物、浮游植物和底栖动物显著的距离衰减趋势表明扩散可能导致它们的组成变化[38]。鱼类没有表现出明显的距离衰减趋势可能是由于鱼类迁徙能力强,分布广泛[31],这也与鱼类α多样性指数较为均匀一致。秦淮河生物群落结构和分布的探究,有助于今后制定秦淮河生物多样性监测的采样方案;探究地理距离对其群落结构的影响便于今后更好地确定秦淮河生物多样性保护的重点。
3.3 环境因子对秦淮河生物群落分布的影响
生物群落分布受环境因素的综合影响,不同水体中环境因素对群落结构的影响也存在差异。相关研究表明,氮、磷等营养盐能调节浮游植物生长[39],而浮游植物作为生产者是生态系统中消费者食物来源之一,从而也会对其他生物造成影响。Zhou等[40]发现水温、TP、TN、COD和TOC是影响太湖中浮游动物的主要环境因子;任辉等[41]通过冗余分析发现叶绿素a、溶解氧、盐度、水温、TN和pH对珠江河南沙河浮游植物群落结构影响最为密切;陈丽等[42]通过典范对应分析发现拉萨河底栖动物群落结构的主要影响因子为海拔、COD、硫化物、pH、TP和TN。本次调研结果表明,环境因子对秦淮河生物具有显著的影响,其中DO、COD、TOC以及氮磷营养盐对浮游生物和底栖动物均有极显著影响(P<0.001),结论与上述结论类似。本次调研中发现秦淮河鱼类群落分布主要受TOC、DO、TN、COD和TP影响,这与李艳利等[43]在河段尺度上对浑太河鱼类群落分布的影响环境因子探究结果类似。
冗余分析结果还进一步表明,不同营养级的生物对环境因子的敏感程度有差异。较低营养级的生物对环境因子的变化更为敏感,比如NH3-N对浮游生物和底栖动物均有显著的影响,但对鱼类的影响并不显著。
4 结论
(1)基于环境DNA宏条形码技术,秦淮河共监测到浮游动物22种407个OTUs,浮游植物60种4445个OTUs,底栖动物17种212个OTUs,鱼类44种1663个OTUs。其中浮游动物以游泳轮虫目和双甲目为主,浮游植物以隐藻门和褐藻门为主,底栖动物中节肢动物门占比最高,鱼类中鲤形目占比最高。环境DNA宏条形码技术在物种丰度鉴定方面较传统形态学监测更具优势。
(2)通过主坐标分析和PERMANOVA检验,发现秦淮河下游、上游南支和上游北支间有极显著差异(P<0.001)。下游α多样性较上游更为贫乏,上游南支(南京)α多样性较上游北支(句容)更丰富。四个类群中,除鱼类外,均表现出了明显的随距离增加而衰减的趋势。
(3)冗余分析表明,较低营养级的生物对环境因子的变化更为敏感,浮游生物和底栖动物的主要影响因子为TN、TOC、TP、NH3-N、COD和DO。鱼类的影响因子为DO、TOC、TN、TP和COD。
(4)基于环境DNA宏条形码技术对秦淮河生物多样性的刻画,可为秦淮河生物多样性的保护提供理论参考。

