小麦麸皮阿拉伯木聚糖/豌豆分离蛋白复合物的乳化性能研究
张朵朵,朱婷伟,陈复生*,殷丽君
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.中国农业大学食品科学与营养工程学院,北京 100083)
我国是小麦生产大国,每年因小麦制粉约产生2 000万吨麦麸。目前,大部分麦麸仅用于动物饲料,造成资源的巨大浪费[1]。麦麸中主要的非淀粉多糖因具有降血糖、增强免疫力、高生物相容性等重要生理活性而受到越来越多的关注[2-4]。阿拉伯木聚糖(arabinoxylan,AX)是麦麸中主要的非淀粉多糖,约占麦麸的20%,具有高黏度、高亲水性等性质,在稳定乳液时,可以增大乳液的黏度,通过空间位阻来阻止液滴间的碰撞和聚集[5-7]。在功能性食品开发中,乳液可作为生物活性物质的递送体系,在饮料及乳制品开发中作为食品配方基料,近年来已成为食品中的研究热点[8-10]。因此,开展小麦麸皮阿拉伯木聚糖(wheat bran arabinoxylan,WBAX)在乳液中的应用研究对提高小麦麸皮附加值、促进谷物加工副产品的综合利用具有重要意义。目前,在乳液稳定性的研究进展中发现,多糖可作为制备乳液的稳定粒子,但大多数植物多糖的表面活性主要是由于其含有蛋白质或者是结构中亲水性和疏水性基团的组合,表面活性较弱,不是良好的乳化剂,因此需要对多糖粒子进行进一步处理从而稳定乳液[11]。其中,多糖与蛋白质之间通过静电或共价相互作用形成多糖-蛋白质复合物稳定乳液时,可以抵抗环境应力(pH值、温度和离子强度等),更好地提高乳液的稳定性[12-14]。豌豆分离蛋白(pea protein isolate,PPI)具有均衡的氨基酸组成,是一种优质的植物蛋白资源[15]。此外,与大豆蛋白相比,其致敏性较低,营养价值相对较高,且未经过基因改性[16]。因此,本研究利用豌豆分离蛋白改性小麦麸皮阿拉伯木聚糖并将其应用在乳液体系中,对其乳化性能进行研究。
基于此,本文以小麦麸皮为原料,通过碱溶醇沉法提取得到WBAX,对其进行组成成分分析及鉴定。并对WBAX分别进行加热、添加PPI及添加PPI后加热处理,得到4种乳化剂样品,对各样品的乳化特性进行研究,同时通过荧光光谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)深入分析不同处理条件对WBAX乳化特性的影响及WBAX与PPI间的相互作用。最后,通过粒度仪及激光共聚焦扫描显微镜(confocal laser scanning microscopy,CLSM)研究乳液粒径、Zeta-电位及微观结构变化,对WBAX作为粒子制备稳定乳液应用效果进行初探,以期扩大WBAX的应用,开发性能优良的乳液稳定粒子。
1 材料与方法
1.1 材料与设备
小麦麸皮(周麦27):河南农业科学院;PPI(蛋白含量86%):西安维珍生物科技有限公司;α-淀粉酶(3 700 U/g):北京索莱宝科技有限公司;D-木糖:上海阿拉丁生化科技股份有限公司;金龙鱼玉米油:益海嘉里粮油有限公司;三氟乙酸、甲醇、1-苯基-3-甲基-5-吡唑啉酮、氯仿:天津市科密欧化学试剂有限公司。以上试剂均为色谱纯。
LGJ-25C型冷冻干燥机:北京四环科学仪器厂;FM200型高速剪切分散乳化机:上海弗鲁克科技发展有限公司;Nano-ZS90型激光粒度仪:英国Malvern公司;激光共聚焦扫描电镜:日本OLYMPUS公司。
1.2 试验方法
1.2.1 WBAX的提取
采用碱溶醇沉法提取 WBAX[17]。以料液比 1∶4(g/mL)向小麦麸皮中加入蒸馏水后沸水浴加热40 min,待温度降低至80℃加入α-淀粉酶以除去淀粉,沸腾蒸馏水冲洗5次,于烘箱中75℃干燥4h,冷却至室温(25℃)后于4℃保存备用。向去淀粉后的麦麸中加入4倍体积的0.25mol/L NaOH溶液,180 r/min避光旋转碱提4 h后离心(6 000 r/min,20 min),将上清液 pH 值调至 4,再次离心(6 000 r/min,20 min),取上清液,按 1∶3 的体积比加入无水乙醇,收集沉淀,冻干,于4℃保存备用。
1.2.2 WBAX鉴定
1.2.2.1 组成成分分析
水分、灰分、粗蛋白含量测定分别参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》、GB 5009.4—2016《食品安全国家标准食品中灰分的测定》、GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;AX含量根据间苯三酚-盐酸法测定,木糖标准曲线为 y=0.446 5x+0.135 2,R2=0.992 5,AX的含量计算公式如下。
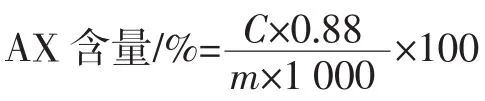
式中:C为由标准曲线查得的木糖含量,μg/mL;0.88为AX与木糖的比例系数;m为WBAX质量,mg。
1.2.2.2 单糖组成
取0.1 mL 5 mg/mL的WBAX溶液与0.1 mL 4 mol/L三氟乙酸溶液混合于安瓿瓶中,热封后110℃保持5 h后氮气吹干,然后加入等体积甲醇氮气吹干3次后溶于0.2mL超纯水中,取0.1mL上述溶液与等体积0.5mol/L NaOH溶液及0.2 mL 1-苯基-3-甲基-5-吡唑啉酮溶液混合,于70℃反应100 min,再用0.3 mol/L HCl溶液调至中性,加等体积氯仿萃取3次后过0.45 μm微孔滤膜,进行高效液相色谱(high performance liquid chromatography,HPLC)分析。色谱柱 ZORBAX Eclipse XDB-C18,流动相0.1 mol/L磷酸盐缓冲液-乙腈(体积比为 83∶17),流速 1 mL/min,柱温 30 ℃。
1.2.3 样品制备
称取一定量的WBAX和PPI分别分散于去离子水中使之浓度均为10 mg/mL,室温(25℃)搅拌使WBAX和PPI充分分散后于4℃冰箱中水化过夜。将上述溶液pH值调至10后取一定量的WBAX溶液和PPI溶液等体积混合,之后将WBAX溶液、WBAX和PPI的混合液于90℃加热3 h,所得样品分别命名为WBAX-3及WBAX/PPI-3。未加热的WBAX溶液、未加热的WBAX和PPI混合液分别命名为WBAX-0、WBAX/PPI-0。
1.2.4 乳化性和乳化稳定性
将浓度为5 mg/mL的WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3分别与大豆油按体积比3∶1混合,以13 500 r/min高速剪切1 min后倒入50 mL小烧杯中。分别于0、10 min从烧杯底部0.5 cm处取50 μL乳化液,将乳化液与5 mL 0.1%SDS混合,测定其在500 nm处的吸光度值。根据以下公式计算其乳化活力指数(emulsifying activity index,EAI)和乳化稳定指数(emulsifying stability index,ESI)。
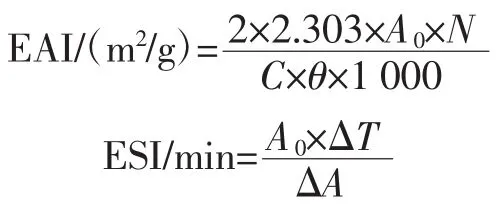
式中:A0为0 min的吸光度值;N为稀释倍数(100);C为样品浓度,g/mL;θ为油相体积(0.75);ΔT为时间差,min;ΔA为ΔT内的吸光值差。
1.2.5 荧光光谱分析
用去离子水分别将 WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3稀释至1 mg/mL,用荧光分光光度计在激发波长280 nm、发射波长300 nm~500 nm、激发和发射狭缝宽度5 nm下,测定样品的荧光发射光谱。
1.2.6 SDS-PAGE分析
将 WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3分别与样品缓冲液按1∶1的体积比混合(混合后样品浓度为5 mg/mL),将上述混合物在100℃下煮沸3 min,冷却至室温(25℃),各取10 μL进行SDS-PAGE电泳。
1.2.7 乳液的制备
将 WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3分别与大豆油以9∶1的体积比进行混合(加入0.01%的叠氮钠抑制微生物生长),高速剪切分散机以13500 r/min剪切3min,然后在超声功率500W的条件下超声3min制备乳液。
1.2.8 乳液粒径和电位的测定
采用Malvern激光粒度仪测定乳液的粒径和Zeta-电位。为避免多重散射的影响,将乳液稀释200倍。粒径参数设置为颗粒折射率1.450、颗粒吸收率0.001、分散剂为水、分散剂折射率1.330。
1.2.9 乳液的微观结构观察
向1 mL乳液中加入20 μL尼罗红溶液(1 mg/mL)和20 μL异硫氰酸荧光素(10 mg/mL二甲亚砜),染色1 h。将染色后的乳液置于载玻片上,盖上盖玻片后倒置于CLSM载物台上。利用Leica软件采集和分析样品的CLSM图像。
1.3 数据处理
采用Origin 9.0和SPSS 20.0软件处理数据,每个指标至少重复测定3次。
2 结果与分析
2.1 WBAX的成分分析与表征
2.1.1 WBAX成分分析
WBAX的基本成分如表1所示。

表1 WBAX的基本成分Table 1 Basic components of WBAX
WBAX中主要成分为AX,其含量为68.21%,水分及灰分含量分别为6.57%及8.59%,这也与吕丁阳等[18]、张梅红[19]的结果相似。此外,WBAX中存在少量蛋白质(7.68%),一部分蛋白可能是提取过程中pH值调节至4.0~4.3,未能使WBAX中游离蛋白质全部沉淀析出;另一部分蛋白可能是通过阿魏酸连接到WBAX的结合蛋白。尽管WBAX中蛋白含量较少,但对WBAX的乳化特性具有重要作用。有研究发现,当WBAX作为乳化剂稳定乳液时,WBAX中的蛋白可以吸附到油水界面处,从而使WBAX也迁移至油水界面处,而WBAX糖链延伸至水相中,通过空间位阻、范德华力等作用阻碍油滴聚集,进而提高乳液稳定性[6]。
2.1.2 WBAX单糖组成
单糖标样和WBAX的高效液相色谱图如图1所示。
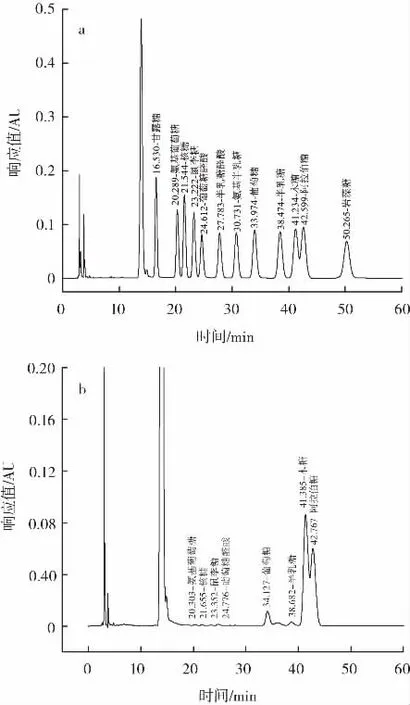
图1 单糖标样和WBAX的高效液相色谱图Fig.1 High performance liquid chromatogram of standard monosaccharide and WBAX
根据图1各单糖标样与WBAX样品的保留时间确定其单糖的种类,通过峰面积确定WBAX样品中各单糖的物质的量比,得到WBAX的单糖组成如表2所示。
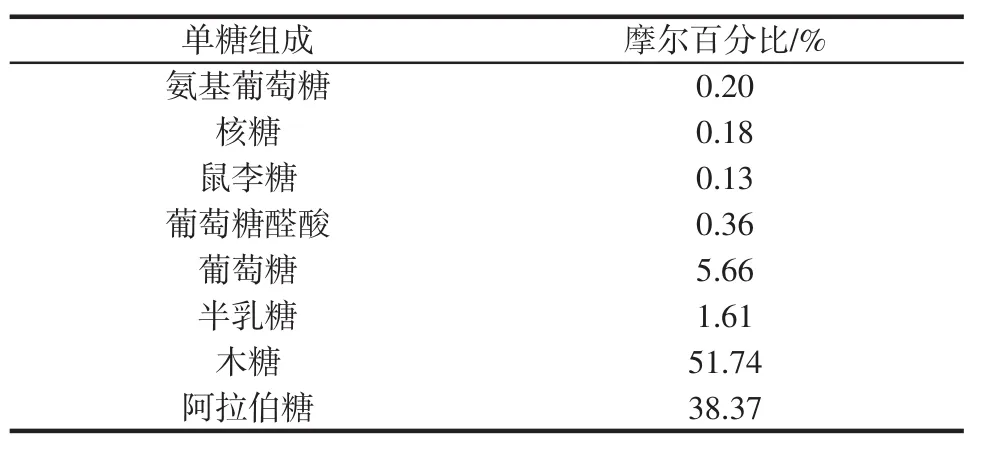
表2 WBAX的单糖组成成分Table 2 Composition of monosaccharide of WBAX
WBAX中木糖(Xyl)与阿拉伯糖(Ara)含量最高,分别为51.74%和38.37%,且两者单糖含量之和大于85%,这与WBAX结构(Xyl为主链、Ara为侧链)相对应。Ara/Xyl的比值可反应WBAX的分支程度,有研究表明,Ara/Xyl比值高、分子量低的AX具有良好生理功能[20-21]。其它几种单糖中,葡萄糖含量相对较高,为5.66%,这可能与提取过程中使用乙醇使其析出有关[22]。
综合上述WBAX的组成及表征分析结果可知,碱溶醇沉法提取得到的WBAX符合木糖为主链、阿拉伯糖为侧链的典型结构;且WBAX中含有少量的蛋白质,可作为潜在的乳化剂应用于乳液中。
2.2 乳化特性分析
为了进一步考察碱溶醇沉法提取得到的WBAX作为乳化剂在乳液中的应用效用,对不同处理条件下的WBAX乳化特性进行研究。而乳化特性一般通过EAI和ESI来评价。其中,EAI是指样品形成乳液的能力;ESI是指样品在一定时间内保持液滴分散,防止脂肪上浮、絮凝和凝结,从而防止乳液出现相分离的能力。因此研究样品的乳化特性对其在乳液中的应用具有重要作用。不同处理条件下的WBAX乳化特性见图2。
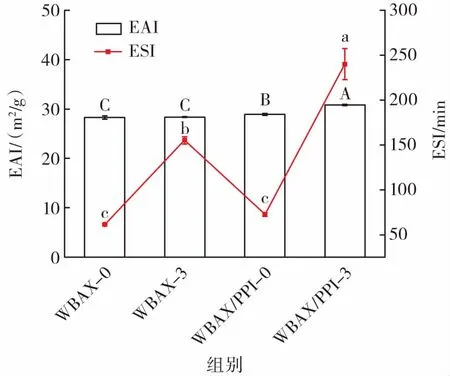
图2 不同条件下WBAX的乳化特性Fig.2 Emulsifications characteristics of WBAX under different conditions
WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3的 EAI和 ESI分别为 28.30、28.37、28.93、30.80 m2/g和61.30、155.14、72.53、240.05 min。与 WBAX-0 相比,WBAX-3的ESI显著提高,WBAX-3的ESI提高可能是由于加热提高了WBAX的溶解性或者是加热使WBAX与其所包含的少量蛋白质发生了美拉德反应。与WBAX-0相比,WBAX/PPI-0的EAI显著提高,这说明添加PPI后改善了WBAX乳液的EAI。与WBAX/PPI-0相比,WBAX/PPI-3的EAI和ESI均显著提高,推测可能是在加热条件下WBAX与PPI发生了糖基化反应使WBAX/PPI-3粒子紧密地吸附在油/水界面处,形成稳定的黏弹性膜,降低界面张力并稳定油滴以防止聚结,从而极大地提高了乳液的EAI和ESI[23]。适当对WBAX进行热处理或添加PPI均可以提高WBAX的乳化特性,特别是热处理协同添加PPI的WBAX/PPI-3具有良好的乳化特性,可以作为潜在的稳定粒子用于乳液中。
2.3 结构特性分析
为了深入研究不同处理条件对WBAX乳化特性的影响及WBAX与PPI间的相互作用,进行了荧光光谱、SDS-PAGE结构特性分析。
2.3.1 荧光光谱分析
一般情况下,蛋白质的酪氨酸(Tyr)和色氨酸(Trp)残基可以在280 nm处激发出一定的荧光强度,且对所处环境极性的改变非常敏感。因此,可以通过对比不同样品间荧光光谱的差异来表征蛋白质结构的变化及蛋白质和环境之间相互作用[24]。各样品的荧光光谱如图3所示。
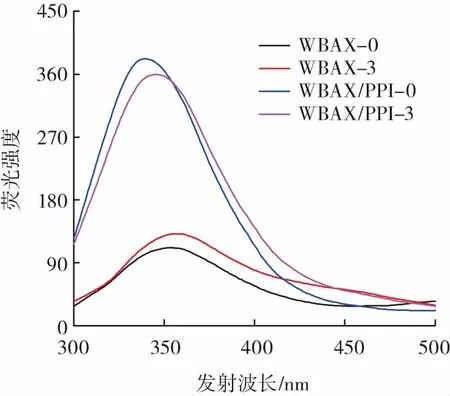
图3 各乳化剂的荧光光谱Fig.3 Fluorescence spectra of emulsifiers
由于WBAX中含有少量蛋白质(7.68%),因此WBAX-0和WBAX-3在激光波长300 nm~500 nm存在较弱的荧光吸收。WBAX/PPI-0、WBAX/PPI-3的最大发射波长(λmax)分别为 340、345 nm。与 WBAX/PPI-0相比,WBAX/PPI-3的λmax往长波方向移动,即发生了红移,说明其色氨酸残基趋向于亲水性的微环境,这是由于WBAX/PPI-3中的PPI与WBAX在加热条件下发生了共价结合使得复合物的微环境的极性增强[25]。
2.3.2 SDS-PAGE分析
SDS-PAGE是分析蛋白质组成和分子量分布的重要方法。当蛋白与糖发生相互作用时,其电泳条带会发生变化,因此通常使用SDS-PAGE来表征蛋白-糖共价复合物的形成。各样品的SDS-PAGE如图4所示。
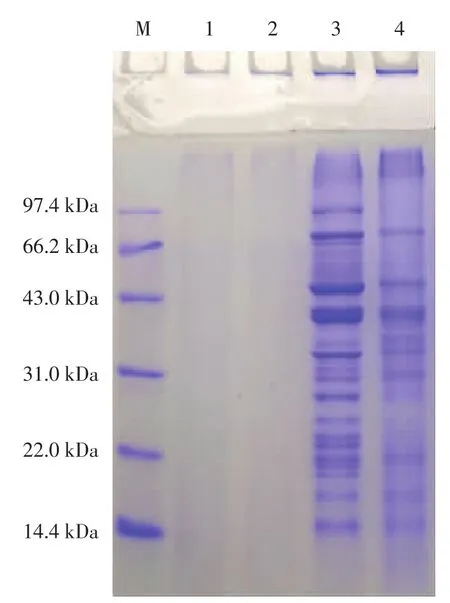
图4 各乳化剂的SDS-PAGE图Fig.4 SDS-PAGE of emulsifiers
WBAX(泳道1、泳道2)虽然含有少量蛋白质(7.68%),但是由于一部分蛋白通过共价作用连接至WBAX上,而多糖分子量较大不能进入泳道,其次,WBAX中的游离蛋白含量过低,因此不能在SDSPAGE图谱上显示出蛋白电泳条带。相较于WBAX/PPI-0(泳道 3)而言,WBAX/PPI-3(泳道 4)的电泳条带均变浅且部分条带消失,电泳条带有明显上移现象,此外分离胶顶部的条带略微加深且凝缩胶进样孔处蓝色染色带加深,浓缩胶与分离胶的交界处拖尾现象明显,说明在加热条件下,WBAX与PPI之间发生了美拉德反应,形成了高分子量的共价复合物。
2.4 在乳液中的应用
2.4.1 乳液粒径及电位
乳液的平均粒径及Zeta-电位如图5所示。
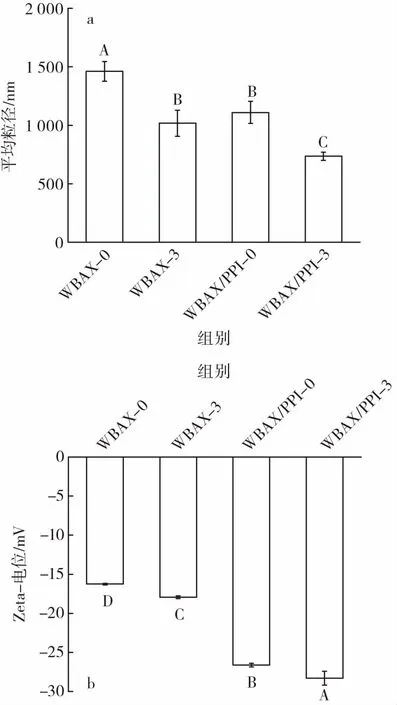
图5 乳液的平均粒径及Zeta-电位Fig.5 Average particle size and Zeta-potential of emulsions
乳液粒径及其所带电荷是乳液的重要特征参数,一般来说,当乳液粒径较小时,乳滴间的布朗运动减弱,碰撞概率降低,有利于其稳定性[26]。乳液Zeta-电位绝对值越高,乳滴间的排斥力越大,乳液稳定性越好[27]。如图 5 所示,WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3所稳定的乳液的平均粒径分别为1 461、1 018、1 109、735 nm。与 WBAX-0相比,WBAX-3所稳定的乳液的平均粒径显著降低。推测原因是由于加热提高了WBAX的溶解性,进而降低其所稳定的乳液的平均粒径。与WBAX-0相比,WBAX/PPI-0所稳定的乳液平均粒径降低,这表明PPI的加入不仅没有增加乳液液滴的粗糙度,反而降低了油滴的尺寸。与WBAX/PPI-0相比,WBAX/PPI-3所稳定的乳液的平均粒径显著降低,这说明WBAX与PPI的共价复合物所稳定的乳液具有较好稳定性。WBAX-0、WBAX-3、WBAX/PPI-0、WBAX/PPI-3所稳定的乳液的Zeta-电位绝对值分别为 16、18、27、28 mV,这说明添加 PPI后的WBAX所稳定的乳液液滴所带电荷增大。乳液液滴间静电斥力增大,可以有效防止油滴聚集,因此形成的乳液更稳定[28]。
2.4.2 乳液微观结构
利用CLSM可以更加直观的观察到乳液液滴的整体分布和结构。图6展示了不同粒子稳定的乳液的微观结构,图中绿色和红色分别代表水相和油相。
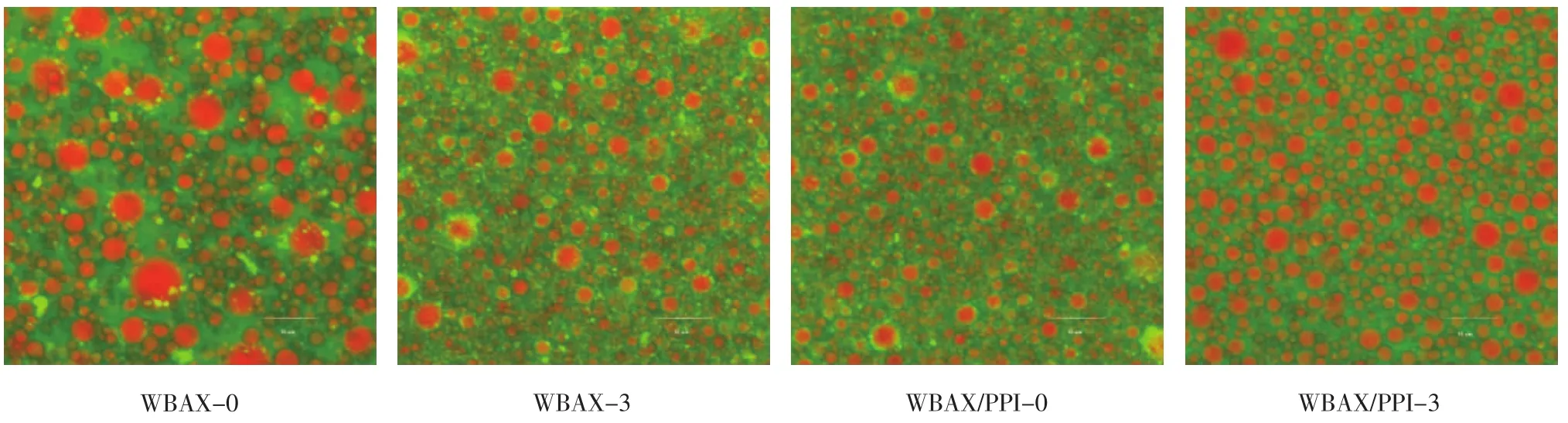
图6 乳液的激光共聚焦图像Fig.6 CLSM images of emulsions
WBAX-0所稳定的乳液的油滴粒径较大且分布不均一,小油滴易附着在大油滴表面,进而引起聚集现象。WBAX-3和WBAX/PPI-0所稳定的乳液液滴尺寸降低,但形成的液滴大小分布不一。WBAX/PPI-3所稳定的乳液油滴粒径大幅度变小且分布相对均匀,表明WBAX/PPI-3所稳定的乳液具有较好稳定性。CLSM的结果与粒度仪测定的各样品所稳定的乳液的粒径结果相一致。
综上可得,利用不同条件处理后的WBAX粒子可制备得到具有一定稳定性的乳液,特别是WBAX/PPI-3可作为稳定粒子用于制备均一、稳定的乳液。
3 结论
本试验以小麦麸皮为原料,采用碱溶醇沉方法提取得到了WBAX,鉴定发现提取的WBAX符合木糖为主链、阿拉伯糖为侧链的典型结构,且WBAX中含有少量的蛋白质,可作为乳化剂应用于乳液中。进一步对WBAX及添加PPI后的WBAX进行热处理(90℃,加热3 h),得到WBAX-3和WBAX/PPI-3复合物样品,结果表明WBAX/PPI-3的EAI和ESI显著增强;WBAX/PPI-3的荧光光谱发生红移,亲水性增强;热处理条件下WBAX与PPI发生了美拉德反应,生成了大分子复合物;WBAX/PPI-3粒子所稳定的乳液平均粒径较小且分布相对较为均匀,电位绝对值较高,静电斥力较大,所形成的乳液更稳定。本研究利用豌豆分离蛋白改性小麦麸皮阿拉伯木聚糖并应用在乳液体系中,扩大了小麦麸皮阿拉伯木聚糖在食品中的应用。

