保加利亚乳杆菌ATCC11842 L-乳酸脱氢酶同工酶基因的克隆与表达分析
黄艳娜, 王金斌, 王赛赛, 段赛菲, 周茂超, 唐雪明
(上海市农业科学院 生物技术研究所,上海 201106)
保加利亚乳杆菌(Lactobacillusdelbrueckiisubsp.bulgaricus, 以下简称L.bulgaricus)为革兰阳性菌,在分类上属于乳杆菌属,兼性厌氧,为乳酸菌家族中的重要一员,其作为发酵剂而被广泛应用于食品工业中[1-3]。乳酸菌细胞内乳酸脱氢酶的立体特异性决定了形成乳酸的立体构型,如德氏乳杆菌(Lactobacillusdelbrueckii)、保加利亚乳杆菌(Lactobacillusbulgaricus)、詹氏乳杆菌(Lactobacillusjensenii)和棒状乳杆菌(Lactobacilluscoryniforis)发酵产物以D-乳酸为主[4-8],有的菌株含有D型和L型两种乳酸脱氢酶或存在乳酸消旋酶,最终形成DL-乳酸,而有些乳酸菌产生的是L-乳酸[9]。保加利亚乳杆菌可通过NAD-依赖的D-乳酸脱氢酶催化底物合成D-乳酸,恒化培养时可以合成L-乳酸,由L-乳酸脱氢酶催化[10]。L.bulgaricusATCC11842属于同型乳酸发酵细菌,也是极少的几株通过EMP途径利用葡萄糖合成光学纯D-乳酸的野生菌株[11]。事实上,不同的保加利亚乳杆菌菌株具有菌株特异性,其合成D-乳酸和L-乳酸的能力也有所不同,Manome等[9]报道L.delbrueckiiATCC 9649菌株合成D-乳酸的光学纯度为87.2%;L.bulgaricusATCC11842自然发酵合成D-乳酸的光学纯度约为95%(本研究测得),表明其合成乳酸的调控机制可能是不同的。目前对L.bulgaricusATCC11842中D-乳酸脱氢酶的酶学性质和蛋白结构已有报道,研究表明保加利亚乳杆菌的D-LDH和L-LDH分别来自两个完全不同的家族,其蛋白序列同源性较低,仅有27%~37%[11-13]。但有关L-乳酸脱氢酶尚无系统研究,对其作用也无明确结论。为进一步了解保加利亚乳杆菌合成乳酸的调控机制,本研究以L.bulgaricusATCC11842为出发菌株,克隆其L-LDH同工酶基因ldb0120和ldb0094,以pET28a(+)为表达载体,在大肠埃希菌BL21(DE3)中过量表达,通过摇瓶发酵研究该酶催化合成L-乳酸的能力,结合蛋白纯化和酶活的测定,揭示L-乳酸脱氢酶同工酶基因在保加利亚乳杆菌中的作用机制,为进一步了解保加利亚乳杆菌合成乳酸的机理提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 大肠埃希菌(Escherichiacoli)BL21(DE3)和表达载体pET28a (+)为上海市农业科学院生物技术研究所保存,保加利亚乳杆菌ATCC11842购自中国工业微生物菌种保藏中心(CICC)。
1.1.2 培养基 MRS培养基(Oxid, Hampshire, England)用于保加利亚乳杆菌的培养;LB培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,固体培养基添加琼脂粉15 g/L) 用于大肠埃希菌及其重组菌的培养;重组大肠埃希菌的发酵培养基采用M9培养基(g/L):葡萄糖 9.0,Na2HPO4·12H2O 15.12,KH2PO43.0,NaCl 0.5,NH4Cl 3.0,每升添加1 mol/L MgSO42 mL,1 mol/L CaCl20.1 mL,1%(质量分数)维生素B10.2 mL,微量元素0.1 mL。
1.1.3 主要试剂与仪器设备Taq酶、DNA Marker、蛋白Marker、XhoI/NheI限制性内切酶、T4 连接酶(大连宝生物有限公司) ;细菌基因组提取试剂盒、胶回收试剂盒、质粒提取试剂盒、Bradford蛋白浓度测定试剂盒、Ni-NTA 琼脂糖纯化树脂试剂盒(生工生物工程(上海)股份有限公司);乳酸脱氢酶活性检测试剂盒(Solarbio LIFE Sciences, Beijing);D-/L-乳酸测定试剂盒(Megazyme international, Ireland)。超净工作台(ZHJH-C1112C,上海智城分析仪器制造有限公司);生化培养箱(Spx-100B-Z,上海博迅实业有限公司医疗设备厂);恒温培养振荡器(ZWY-240,上海智城分析仪器制造有限公司);紫外-可见分光光度计(Evolution 60,Thermo Fisher);电泳仪(EPS-200,上海天能生命科学有限公司);双板垂直电泳仪(DYCZ-24DH,北京六一仪器厂)。
1.2 方法
1.2.1 目的基因克隆 参照细菌基因组提取试剂盒所述抽提保加利亚乳杆菌基因组。根据GenBank中公布的L.bulgaricusATCC11842 L-乳酸脱氢酶的基因序列(ldb0120和ldb0094),设计特异性引物(表1)。PCR扩增条件:94 ℃预变性10 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。琼脂糖凝胶电泳检测PCR产物。
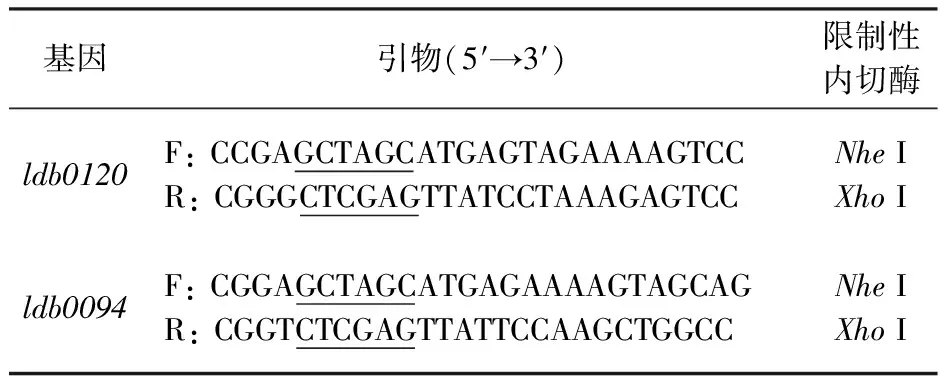
表1 引物设计
1.2.2 重组表达载体的构建 分别将PCR产物和载体pET28a(+)按表1所示限制性内切酶进行双酶切,胶回收纯化后,采用T4 DNA连接酶16 ℃连接过夜。连接产物热激转化到E.coliBL21(DE3)感受态细胞,37 ℃复苏1 h后涂布终浓度为50 μg/mL卡那霉素抗性的LB平板,培养12 h后,挑单菌落至LB液体培养基中,37 ℃培养10 h,挑选重组转化子,送至生工生物工程上海股份有限公司测序,并对重组菌进行质粒抽提和限制性内切酶酶切验证。
1.2.3 目的基因在大肠埃希菌中的表达 将培养过夜的重组菌按照1%(体积分数)的接种量接种至新鲜LB培养基中,培养至对数期前期,添加终浓度为0.5 mmol/L IPTG进行诱导,诱导时间为4 h,以空质粒重组菌和未诱导重组菌为对照,收集菌体进行全细胞聚丙酰胺凝胶电泳 (SDS-PAGE)。
1.2.4 重组蛋白的纯化 分别将1%(体积分数)重组菌种子液接种于含有终浓度为50 μg/mL卡那霉素的LB液体培养基中,37 ℃摇瓶发酵至菌液OD600值为0.6~0.8后加入IPTG,使其终浓度为0.5 mmol/L,并在25 ℃、150 r/min条件下诱导12 h,冷冻离心收集菌体,用pH 7.5,50 mmol/L Tris-HCl缓冲液洗涤悬浮,采用高压匀浆超声破碎仪破碎,超声破碎条件:功率37.5 W,超声周期2 s-2 s,时间10 min。4 ℃离心取上清。参照Ni-NTA琼脂糖纯化树脂试剂盒对重组蛋白中带有的His-Tag进行镍柱亲和层析,并对纯化后的蛋白进行SDS-PAGE分析。
1.2.5 L-乳酸脱氢酶活性的测定 采用考马斯亮蓝法检测酶液的蛋白浓度。参照乳酸脱氢酶活性检测试剂盒说明书测定L-乳酸脱氢酶酶活,以灭活的酶为空白对照。酶活力定义:每mg蛋白每分钟催化产生1 nmol丙酮酸所需的酶量为1个酶活力单位。
1.2.6 表达L-乳酸脱氢酶基因重组大肠埃希菌的摇瓶发酵 将重组大肠埃希菌种子液按照1%(体积分数)的接种量接种于M9发酵培养基中,添加终浓度为0.5 mmol/L IPTG进行诱导,以空质粒重组菌E.coli/pET28a作对照。有氧发酵条件:250 mL三角瓶,装液量30 mL,8层纱布包裹瓶口;微好氧培养条件:50 mL蓝口瓶,装液量40 mL。其中D-乳酸脱氢酶重组菌添加终浓度为50 μg/mL的卡那霉素,37 ℃,200 r/min,发酵时间24 h,测定细胞生长(OD600),并采用D-/L-乳酸检测试剂盒测定L-乳酸的浓度。
1.2.7 数据统计分析 摇瓶发酵实验中每个菌株设置3次生物学重复,每个实验重复3次,采用SPSS 17.0软件进行数据的显著性分析。
2 结果与分析
2.1 L-乳酸脱氢酶基因的克隆
以保加利亚乳杆菌ATCC11842基因组为模板,以表1所示为引物,PCR扩增L-乳酸脱氢酶同工酶基因ldb0094和ldb0120。琼脂糖凝胶电泳均获得特异大小的条带(图1),测序得到该片段长度分别为909和924 bp ,并与GenBank的L.bulgaricusATCC11842的ldb0094(CAI96935.1, 909 bp)和ldb0120(CAI96961.1, 924 bp)进行同源比对,结果显示基因序列完全一致,证明克隆的基因正确。
2.2 表达L-LDH同工酶基因的重组大肠埃希菌的构建
对目的基因片段和质粒pET28a分别进行双酶切,胶回收纯化后对目的片段和线性化pET28a载体进行连接,并将连接产物转化E.coliBL21感受态细胞,采用卡那霉素抗性筛选重组转化子。抽提重组质粒质粒并进行双酶切验证,结果如图2所示。每个重组质粒切成两条带,较大的为pET28a线性化载体,为5.3 kb左右,较小的条带为目的基因,与预期大小一致,表明重组大肠埃希菌构建成功。
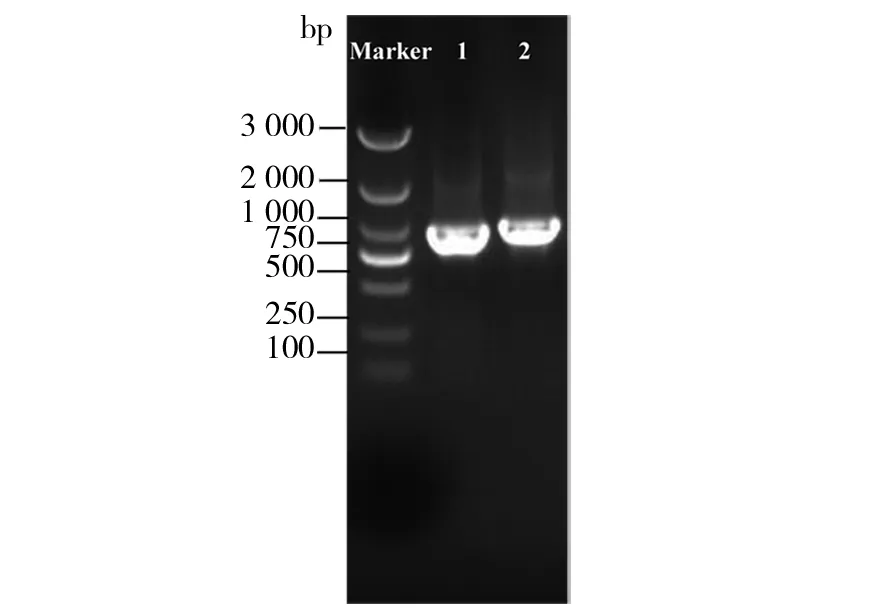
图1 L-乳酸脱氢酶基因PCR扩增电泳图Fig.1 The electrophoretogram of PCR products of L-lactate dehdyrogenase gene Marker: 100~3 000 bp; 1: ldb0094; 2: ldb0120

图2 重组质粒双酶切验证电泳图Fig.2 The elelectrophoresis of double restriction enzyme digestion of recombinant plasmidMarker: 250~15 000 bp; 1: ldb0120 (Nhe I 和 Xho I 双酶切); 2: ldb0094(Nhe I 和 Xho I 双酶切)Marker: 250-15 000 bp; 1: ldb0120 restricted by Nhe I and Xho I; 2: ldb0094 restricted by Nhe I and Xho I
2.3 重组大肠埃希菌聚丙烯酰氨凝胶电泳
表达L-LDH同工酶因的重组大肠埃希菌聚丙烯酰胺凝胶电泳结果如图3所示。与对照E.coliBL21和空质粒E.coliBL21/pET28a相比,重组菌E.coliBL21/pET28aldb0020和E.coliBL21/pET28aldb0094均有特异蛋白表达,其中LDB0120蛋白分子量为29 kDa左右,LDB0094蛋白分子量为26 kDa左右。

图3 表达ldb0120和ldb0094基因的重组大肠埃希菌SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoresis of recombinant E. coli expressing ldb0120 and ldb00941: E.coli BL21; 2: E.coli BL21/pET28a; 3: E.coli BL21/pET28aldb0120 (0 mmol/L IPTG); 4:E.coli BL21/pET28aldb0120 (0.5 mmol/L IPTG); 5:E.coli BL21/pET28aldb0094 (0 mmol/L IPTG); 6:E.coli BL21/pET28aldb0094 (0.5 mmol/L IPTG)
2.4 重组蛋白的纯化
采用Ni-NTA 琼脂糖纯化树脂试剂盒分别对重组蛋白进行纯化。并将蛋白破碎液、蛋白流穿液、两次蛋白收集液进行SDS-PAGE凝胶电泳,结果如图4所示。经Ni-NTA 琼脂糖纯化树脂洗脱纯化,目的蛋白在第二次收集液中仅显示单一条带,且蛋白分子量与预期一致,LDB0094和LDB0120分子量大小分别为26 kDa和29 kDa左右,这表明获得了LDB0094和LDB0120的纯酶。
2.5 L-乳酸脱氢酶酶活的测定
对重组蛋白进行Ni-NTA柱亲和层析和酶学活性测定,结果显示,LDB0120和LDB0094的比活力分别为0 和25 U/mg,这表明LDB0094具有低活性,而LDB0120没有活性。推测可能是保加利亚乳杆菌主要合成D-乳酸的原因所在。Hao等[13]对L.bulgaricus2038进行了全基因组测序和功能注释,认为L-LDH在细胞中是不表达的,而D-LDH在体内表达水平较高,其中ldhL1(LBU0059) 和ldhL2(LBU0084)密码子适应指数(Condon adaption index, CAI)分别为0.305和0.225。Ragout等[10]的研究显示L.bulgaricusATCC 11842存在L-乳酸脱氢酶,可以可逆催化丙酮酸合成L-乳酸的反应。但该酶非常不活跃,只能产生极少量的L-乳酸,而且该合成不依赖于培养基中pH和葡萄糖浓度的变化[14],这表明L-LDH在保加利亚乳杆菌ATCC11842菌株糖代谢合成乳酸过程中作用甚微。
2.6 重组大肠埃希菌L-乳酸合成的摇瓶发酵实验
以表达空质粒重组菌为对照,分别对表达L-乳酸脱氢酶重组大肠埃希菌进行好氧和微好氧发酵,37 ℃、220 r/min培养24 h,测定菌体浓度OD600,4 ℃、12 000 r/min离心收集发酵样品,采用D-/L-乳酸试剂盒测定L-乳酸的含量,摇瓶发酵结果如表2所示。与对照E.coliBL21/pET28a相比,重组菌E.coliBL21/pET28aldb0120与对照E.coliBL21/pET28a无差异,L-乳酸的浓度仅为3~6 mg/L,表明重组酶Ldb0120在L-乳酸的合成中没有作用,而菌株E.coliBL21/pET28aldb0094微好氧条件可以合成L-乳酸,浓度为227.9 mg/L,好氧条件下L-乳酸的浓度为41.9 mg/L,表明LDB0094具有活性,且受到氧的负调控,好氧条件下酶活降低,导致L-乳酸的合成下降。该结果与酶活测定结果吻合,由于LDB0120未检测到酶活,揭示了LDB0094为催化L-乳酸合成的关键酶。有研究表明乳酸的合成受氧的调控,Collins等[15]的研究显示厌氧条件下LDHs的酶活是好氧条件的10倍左右,因此改变通气量和搅拌转速等参数也会影响乳酸的合成。这与本研究中表达ldb0094基因的重组大肠埃希菌在微好氧条件下可以合成更多乳酸的结果一致。

图4 纯化的L-乳酸脱氢酶SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoresis of purified L-lactate dehydrogenase1: E.coli BL21/pET28aldb0094蛋白破碎液; 2: E.coli/pET28aldb0094 蛋白洗脱液; 3: E.coli BL21/pET28aldb0094 第一次蛋白收集液; 4: E.coli BL21/pET28aldb0094 第二次蛋白收集液; 5: E.coli BL21/pET28aldb0120 蛋白破碎液; 6: E.coli BL21/pET28aldb0120 蛋白洗脱液; 7: E.coli BL21/pET28aldb0120 第一次蛋白收集液; 8: E.coli BL21/pET28aldb0120 第二次蛋白收集液1: E.coli BL21/pET28aldb0094 protein fragmentized solution; 2: E.coli/pET28aldb0094 protein flow-through solution; 3: E.coli BL21/pET28aldb0094 1st protein collecting solution; 4: E. coli BL21/pET28aldb0094 2nd protein collecting solution; 5: E.coli BL21/pET28aldb0120 protein fragmentized solution; 6: E.coli BL21/pET28aldb0120 protein flow-through solution; 7: E.coli BL21/pET28aldb0120 1st protein collecting solution; 8: E.coli BL21/pET28aldb0120nd protein collecting solution
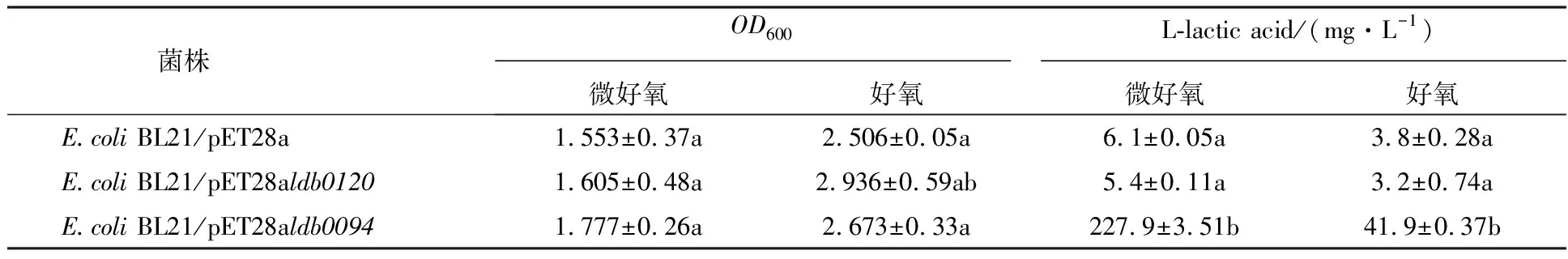
表2 表达L-乳酸脱氢酶基因重组大肠埃希菌摇瓶发酵结果
3 讨 论
近年来,在乳酸菌LAB的基因组测序方面取得了长足的进展。截止2020年,NCBI数据库中已有50个完整的德氏乳杆菌(Lactobacillusdelbrueckii)基因组草图,包括L.lactis、L.bulgaricus、L.jakobsenii、L.indicus和L.sunkii[16-19]。保加利亚乳杆菌基因组测序显示的一些特征揭示了该菌株基因组处于快速进化的假设。在嗜酸菌群的乳酸菌中L.delbrueckii通常被认为是不典型的,目前的基因组序列观察到的GC含量差异主要是由于密码子3位的GC含量不同,可以解释为近期进化的可能性,也表明L.delbrueckiisubsp.bulgaricus可能比曾经认为的还不典型[18]。Song等[20]对蔗糖复原脱脂牛奶酸化发酵结果的全基因组关联研究分析表明,L-乳酸脱氢酶(lldD: Ldb2036)和细菌产酸速率相关。Tanigawa等[21]分析采用多位点序列分型技术对41株L.delbrueckii进行了多样性分析,发现L.delbrueckii具有较高的遗传多样性。
L.bulgaricusATCC11842是D-乳酸合成菌株,目前关于保加利亚乳杆菌合成乳酸的研究主要集中于利用不同原料及其水解物来合成高纯度的D-乳酸[22-24]。Balakrishnan等[25]以Kodo小米麸皮酸解和酶解物为原料对L.delbrueckiiNBRC3202进行了有氧和微好氧发酵,D-乳酸浓度为25.38 g/L,光学纯度达到97.79%;Karnaouri等[26]研究显示L.bulgaricusATCC11842可利用有机溶剂预处理山毛榉和松树获得的木质纤维素生物质合成光学纯的D-乳酸;Xu等[27]研究了保加利亚乳杆菌利用可再生菊粉生产D-乳酸,在同步糖化发酵条件下D-乳酸的浓度可达到126.3 g/L,光学纯度>99.9%。Wang等[28]利用酸预处理玉米秸秆发酵L.bulgaricusCICC21101产D-乳酸,光学纯度可达99%。在L-乳酸合成方面,王刚等[29]研究了ldhL-ldb0094基因敲除对保加利亚乳杆菌CICC21101产L-乳酸的影响,结果显示该基因的敲除使得ldb0120基因转录水平上调,进而提高L-乳酸的合成,其光学纯度由54.56%增加到92.25%。在本研究中,对L.bulgaricusATCC11842菌株进行了D-乳酸和L-乳酸合成的测定,结果显示在厌氧条件该菌株D-乳酸的合成比例约占95%左右(数据未显示),表明L.bulgaricusATCC11842与L.bulgaricusCICC21101可能在乳酸合成的调控方面机制有所不同。
因此,为了解保加利亚乳杆菌L-乳酸脱氢酶同工酶基因对细胞合成L-乳酸的作用,本研究首次将L-乳酸脱氢酶同工酶基因进行大肠埃希菌的异源表达,以L.bulgaricusATCC11842基因组DNA为模板,克隆得到两种L-LDH同工酶基因 (ldb0120和ldb0094),构建重组质粒并转化大肠埃希菌BL21,实现了保加利亚乳杆菌L-LDH同工酶基因在大肠埃希菌中的表达。对重组大肠埃希菌进行了好氧和微好氧摇瓶发酵实验,结果显示重组菌E.coliBL21/pET28aldb0120无论在好氧还是微好氧条件下均基本不合成L-乳酸,E.coliBL21/pET28aldb0094在好氧和微好氧条件下L-乳酸的浓度分别为41.9和227.9 mg/L,这表明L-乳酸脱氢酶的活性受到氧的负调控,这与酶活测定数据相吻合。因此,综合两株重组菌在厌氧和微好氧条件下L-乳酸的合成和L-乳酸脱氢酶同工酶酶活的测定,推测保加利亚乳杆菌ATCC11842主要通过L-乳酸脱氢酶同工酶LDB0094来催化丙酮酸合成L-乳酸,尽管活性很低,但仍然在L-乳酸的合成中起着关键作用。本研究深入了解了保加利亚乳杆菌中L-乳酸脱氢酶在乳酸合成中的作用,结果表明两种L-乳酸脱氢酶同工酶在保加利亚乳杆菌中仅LDB0094具有非常低的酶活,进而影响了L-乳酸的合成,也从侧面揭示保加利亚乳杆菌主要合成D-乳酸可能与此有关。