新型光声传感及成像系统探测乳腺癌前哨淋巴结的基础研究
赵家贤,江道淮,丛斌斌,高 飞,王永胜
1.山东第一医科大学(山东省医学科学院),山东 济南 250062;
2.山东省肿瘤防治研究院(山东省肿瘤医院)乳腺病中心,山东 济南 250117;
3.上海科技大学,信息科学与技术学院,混合成像系统实验室,上海 201210;
4.中国科学院上海微系统所与信息技术研究所,上海 200050;
5.中国科学院大学,北京 100049
乳腺癌前哨淋巴结(sentinel lymph node,SLN)的状态反映腋窝区域淋巴结(lymph nodes,LN)转移情况。前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)已经取代腋窝淋巴结清扫术成为诊治早期乳腺癌区域LN转移患者的首要方案。目前国内及国际指南[1-2]推荐蓝染法联合核素法作为SLN的定位方法。然而蓝染料颗粒直径较小,不具有靶向性,易将次级LN染色,存在较高的假阴性率。核素存在放射性污染的问题,其制备过程复杂且需严格质控,限制了放射性核素示踪剂在临床中的推广[3-5]。为此我们研制了新型荧光靶向示踪剂,将吲哚菁绿(indocyanine green,ICG)与利妥昔单抗(rituximab,RIT)偶联形成ICG-RIT,其以ICG产生荧光效应,以RIT产生靶向定位效应。该示踪剂具有靶向SLN的性能,且无放射性污染,但目前以荧光脉管系统成像仪探测,ICG发出的荧光穿透组织厚度低,较难发现位置深的SLN,且易切断淋巴管使荧光示踪剂泄露导致周围组织荧光污染,不易识别并定位SLN[6-7]。
光声成像(photoacoustic imaging,PAI)是近年新兴的成像技术,其结合了光学成像高对比度和超声成像高穿透力的优势,具有良好的应用前景。ICG是常用的小分子近红外光声造影剂,它是一种获得中国国家食品药品监督管理局批准的低毒染料,具有较高的摩尔吸光系数[(2.3×105/(mol·cm)]。在水溶液中,ICG的光吸收峰在波长为780 nm处,此波长下可获得在荧光染料中较低的荧光量子产率(0.027)。ICG能迅速与血浆蛋白结合,结合后光吸收峰为805 nm,所以临床上常利用其光声效应用作血流造影剂[8]。
本研究利用ICG-RIT的光声效应,以其作为光声造影剂,搭建手持式光声信号传感系统(photoacoustic signal sensing system,PASS)及手持式光声成像(photoacoustic imaging,PAI)系统,探索其探测富集ICG-RIT淋巴结的最佳探测深度,研究其定位SLN的准确性。
1 材料和方法
1.1 实验材料及仪器
RIT 100 mg/10 mL,购自上海罗氏制药有限公司;ICG 25 mg,购自丹东医创药业有限责任公司;亚甲蓝(methylene blue,MB)20 mg/2 mL,购自济川药业集团有限公司;明胶500 g,购自济南槐荫蓝鲸实验设备销售经营部;PASS及PAI系统,由上海科技大学混合成像系统实验室提供;MDM-I型荧光脉管系统成像仪,购自廊坊明德生物医药技术有限公司;SD大鼠,体重为200~300 g,雌性,无菌级,购自浙江维通利华实验动物技术有限公司;鸡胸组织自备;其他试剂为国产AR级。
1.2 搭建手持式PASS及手持式PAI
根据PAI原理搭建手持式PASS及手持式PAI。实验采用能量为80~100 mJ的波长可调脉冲激光器(Phocus Mobile,OPOTEK,Carlsbad,CA),激发光源波长选择本次实验所测ICGRIT光吸收峰780 nm(图1),脉冲重复频率为10 Hz,脉冲持续时间为10 ns。激光通过光纤围绕在频率2.5 MHz,带宽80%的单点超声换能器(仿体实验使用的超声换能器厂商为日本奥林巴斯公司,人体组织试验超声换能器厂商为广州多浦乐电子科技股份有限公司),与皮肤的距离不同产生直径3~5 cm照射范围,激光能量小于最大允许曝光量(20 mJ/cm²),信号通过示波器收集(图2)。PAI采用同款激光器,激光通过光纤由两侧贴合于频率7.5 MHz,带宽80%的128通道线性阵列超声换能器(广州多浦乐电子科技股份有限公司),示意图见图3。
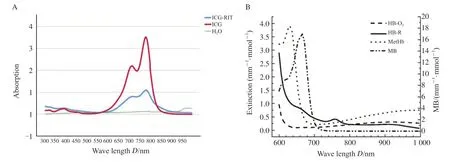
图1 光声造影剂光吸收谱对比Fig.1 Comparison of optical absorption spectra of different photoacoustic agents

图2 手持式PASS结构示意图Fig.2 The diagram of the structure of hand-held photoacoustic signal sensing system
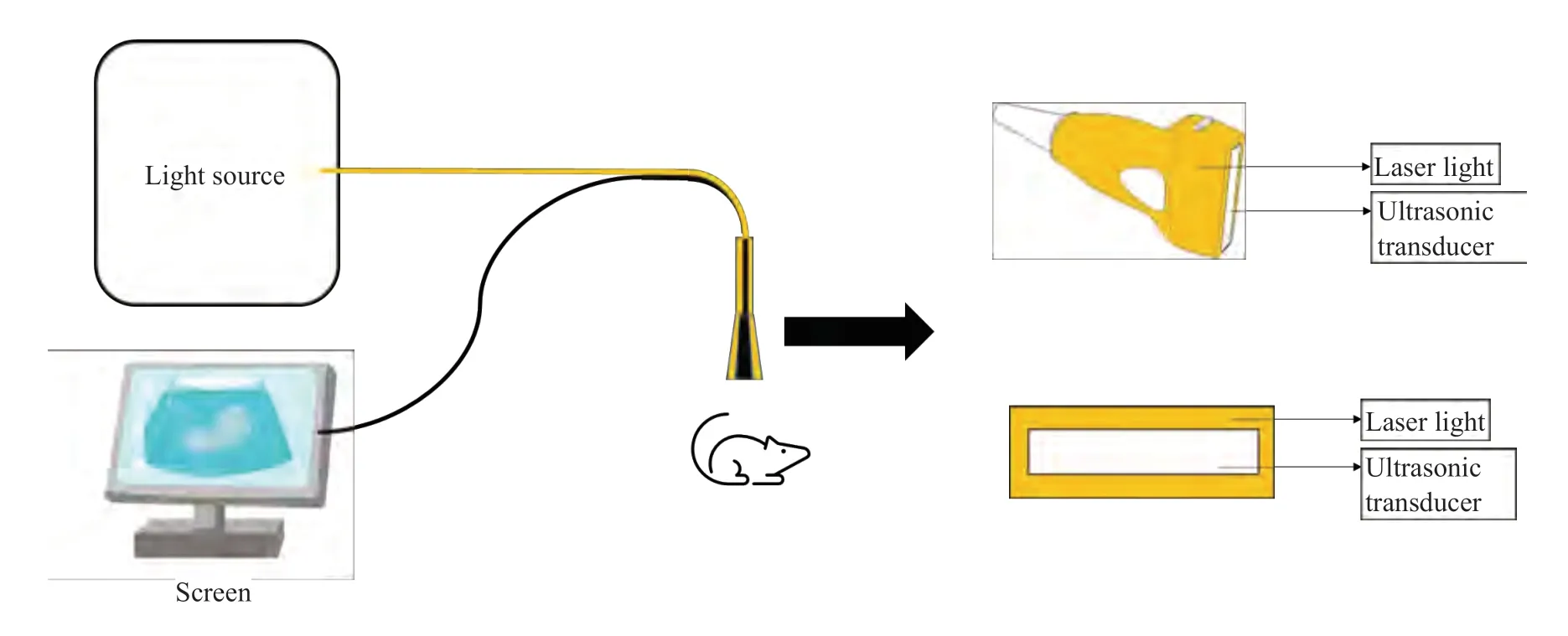
图3 手持式PAI结构示意图Fig.3 The structure of hand-held photoacoustic imaging system
1.3 制备新型示踪剂及模拟腋窝环境
根据我们团队的研究[6-7],以RIT与ICG最佳质量比4∶1配制新型示踪剂1 mL,含ICG 1.25 mg(1.613 mmol/L),RIT 5 mg(34.756 μmol/L)。ICG与RIT偶联后其光吸收峰位于780 nm附近,与ICG光吸收峰780 nm近似,对比MB光吸收峰位于664 nm,血红蛋白光吸收峰位于600 nm以下[9-10](图1)。偶联的ICG-RIT保持抗体分子的完整性和免疫活性,且无菌、无致热原,也无急性毒性。
仿体实验以ICG-RIT染色明胶模仿体外LN,取5份1 mL ICG-RIT分别用无菌注射用水稀释至100.00%、50.00%、25.00%、12.50%和6.25%备用;取10 g明胶,加入30 mL无菌注射用水隔水加热溶解,在冷却至室温时加入不同浓度ICG-RIT染色,置于4 ℃冰箱静置凝固,成型后分割成直径0.5 cm,厚度0.3 cm的圆柱形仿体。有研究[11-12]显示,鸡胸组织光散射系数与人体乳腺组织相似,故本实验采用鸡胸组织模拟人体乳腺组织,将鸡胸组织切割成长约7.0 cm,宽约3.0 cm,厚度约1.0 cm薄片。鸡胸组织的确切厚度将通过PASS测量。
人体组织试验在拟行SLNB患者术前3~18 h于6、12点位腺体内注射99mTc-硫胶体(各0.6 mL 0.5 mCi,1 mCi=3.7×107Bq),同时患乳外上象限乳晕旁单点皮下注射ICG-RIT 1.0 mL,术中应用核素法及荧光显像法遵循 SLNB 操作规范行SLNB,术中取荧光显像的SLN以明确ICG-RIT引流至SLN。收集乳房标本中远离瘤床及LN的腋窝脂肪层,切割成长约5.0 cm,宽约3.0 cm,厚度约1.0 cm薄片以之模拟腋窝环境,其确切厚度通过PASS测量。
1.4 实验设计
1.4.1 光声穿透组织深度实验
1.4.1.1 仿体实验
取不同浓度的ICG-RIT仿体,放置于不同层数鸡胸组织下,用手持式PASS探测光声信号。同时测量MB明胶仿体光声信号作为对照。每组重复3次取平均值。实验共采集30组数据(表1)。
1.4.1.2 人体组织试验
取红外荧光显像的SLN,放置于不同层数腋窝脂肪下,用手持式PASS探测光声信号,用手持式PAI与超声成像对比其成像效果及穿透深度。试验共采集10例原发性乳腺癌患者数据。患者均签署知情同意书(2021年7月—12月就诊于山东省肿瘤医院乳腺外科一病区,共行10例次SLNB)。
1.4.2 大鼠SLNB模型实验
1.4.2.1 实验组
据解剖图示及研究结果[13]显示,SD大鼠后肢淋巴引流由双侧腘LN引流至髂LN,我们定义腘LN为SLN,髂LN为次级LN。取0.1 mL ICGRIT,含ICG 0.125 mg,麻醉大鼠后注射至大鼠后肢足垫皮下,据团队既往研究[14],注射后18 min后腘LN开始显像,39 min达到最佳显像效果。本实验设置注射后30 min用PASS探测并记录腘窝LN及髂LN光声信号强度,同时行PAI。根据光声信号及成像结果解剖大鼠后肢及盆腔,取出对应LN并置于PASS下探测并记录光声信号强度。取3只SD大鼠重复实验。
1.4.2.2 对照组
取0.1 mL MB(1 mg),麻醉大鼠后注射至大鼠后肢足垫皮下,重复上述实验步骤。取3只SD大鼠重复实验。
2 结果
2.1 PASS探测鸡胸组织下ICG-RIT仿体
示波器采集信号均显示鸡胸组织置于仿体上时可探测到相同基础信号,为鸡胸组织的光声信号,同时在基础信号上ICG-RIT仿体呈现特征性单峰信号波形,证明PASS可特异性识别鸡胸组织下的ICG-RIT仿体(图4)。示波器采集数据后平均计算X轴距离,得0~4层鸡胸组织平均厚度分别为0.00、15.13、24.84、39.72和52.42 mm。取单纯鸡胸组织基础光声信号为0,测得单纯浓度100%的ICG-RIT仿体光声信号强度为26.70 mV,在平均52.42 mm深处平均光声信号强度为5.87 mV;对比100%MB在深度为0.00 mm处产生光声信号强度19.45 mV,52.42 mm处产生光声信号强度4.34 mV(表1)。随着探测深度的增加,ICG-RIT浓度的降低,仿体的光声信号逐渐减小(图4)。PASS探测25%ICG-RIT仿体达到最大探测深度62.22 mm,信号强度为2.75 mV(图5)。6.25%ICG-RIT仿体在46.95 mm深度测得光声信号强度最小可观测值为2.74 mV,与基础信号区分度小,不予采用(图6)。
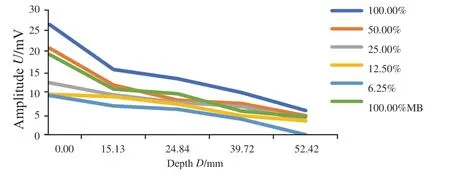
图4 不同浓度ICG-RIT仿体在各深度下的光声信号强度变化趋势Fig.4 Amplitudes of ICG-RIT phantoms with different concentrations at different depths
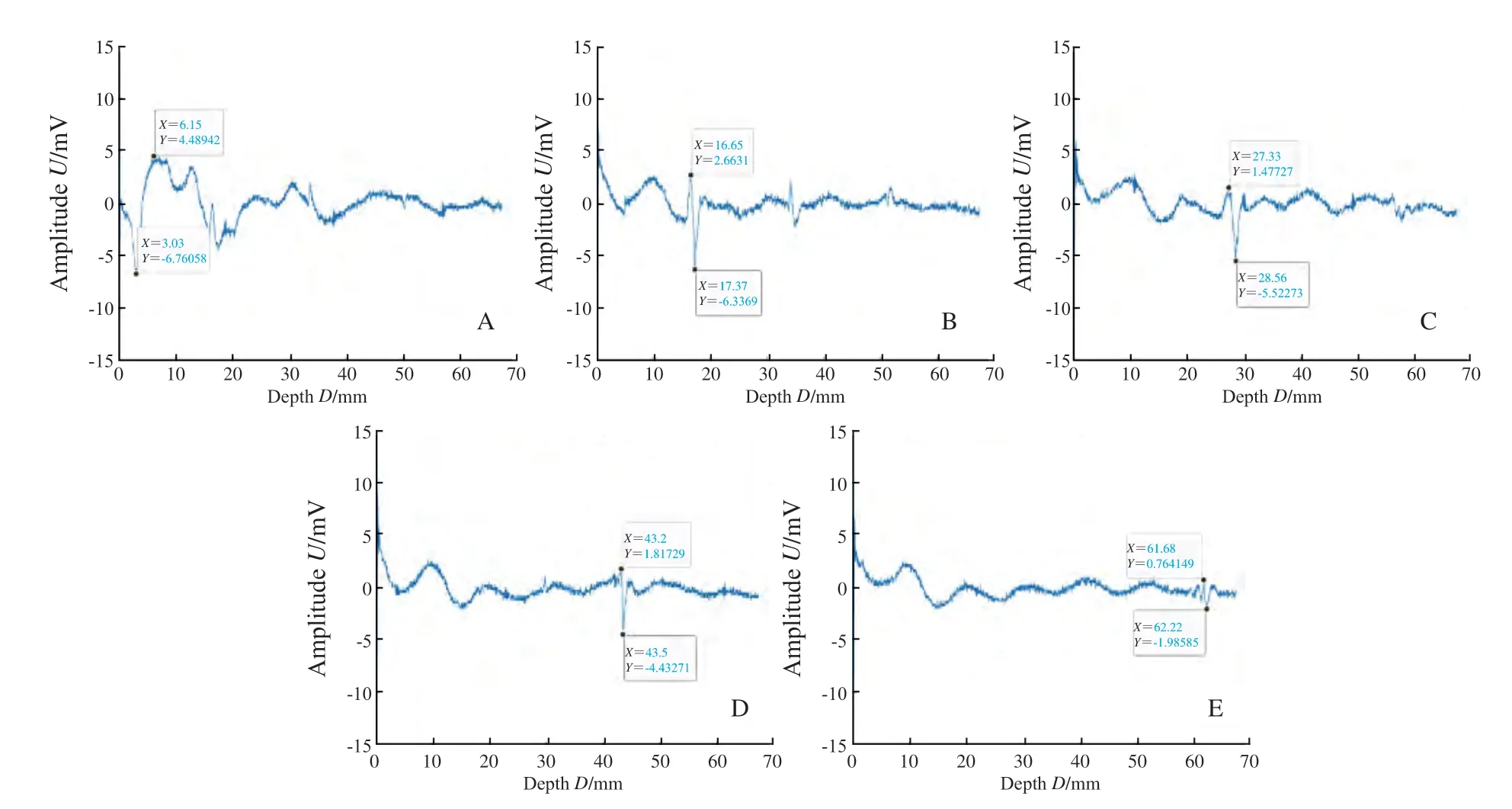
图5 25%浓度ICG-RIT仿体在各深度下的光声信号图Fig.5 Photoacoustic signals of 25% concentration ICG-RIT phantoms at different depths
2.2 PASS、PAI与US探测腋窝脂肪下SLN
术中应用核素法及荧光法取得SLN,在荧光脉管系统成像仪中显示为发光LN(图7)。PASS探测腋窝脂肪获取基础信号(图8),SLN在不同厚度脂肪下均呈现特征性单峰信号,且随着深度减少光声信号减弱,最大穿透深度为32.72 mm时光声信号为31 mV,与6.25%的ICG-RIT在鸡胸组织下光声信号相似(图6D)。PAI可清晰成像约2.5 cm深度SLN,对比超声可成像约4 cm深度SLN(图9)。
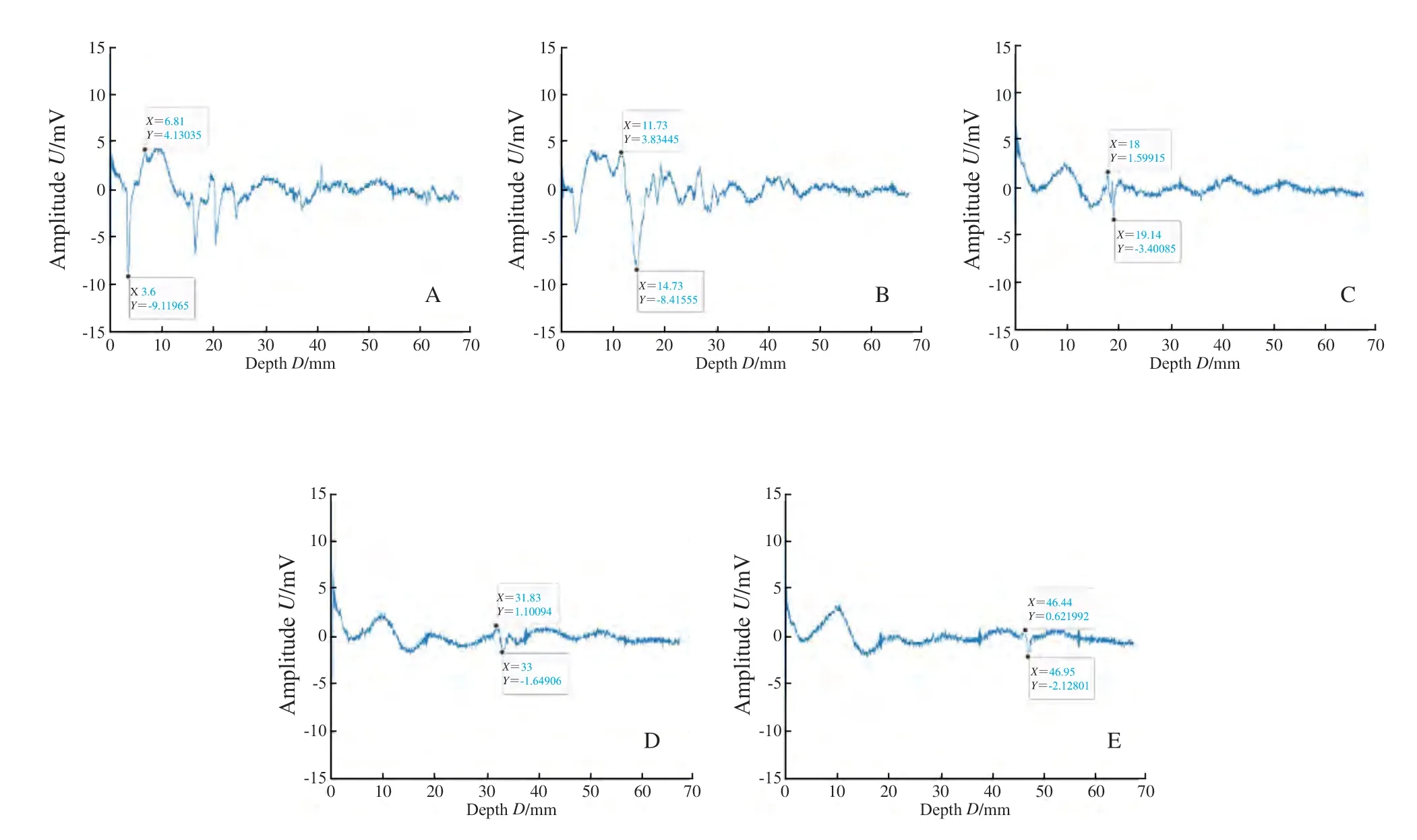
图6 6.25%浓度ICG-RIT仿体在各深度下的光声信号图Fig.6 Photoacoustic signals of 6.25% concentration ICG-RIT phantoms at different depths

图7 荧光法行SLNBFig.7 Lymph nodes in NIR fluorescence imaging system
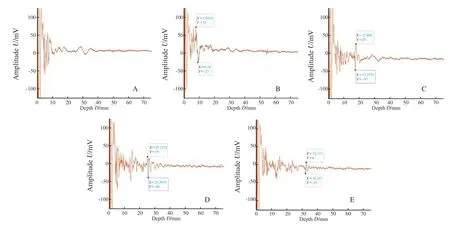
图8 SLN在不同层数腋窝脂肪下光声信号图Fig.8 Photoacoustic signals SLN at different depths
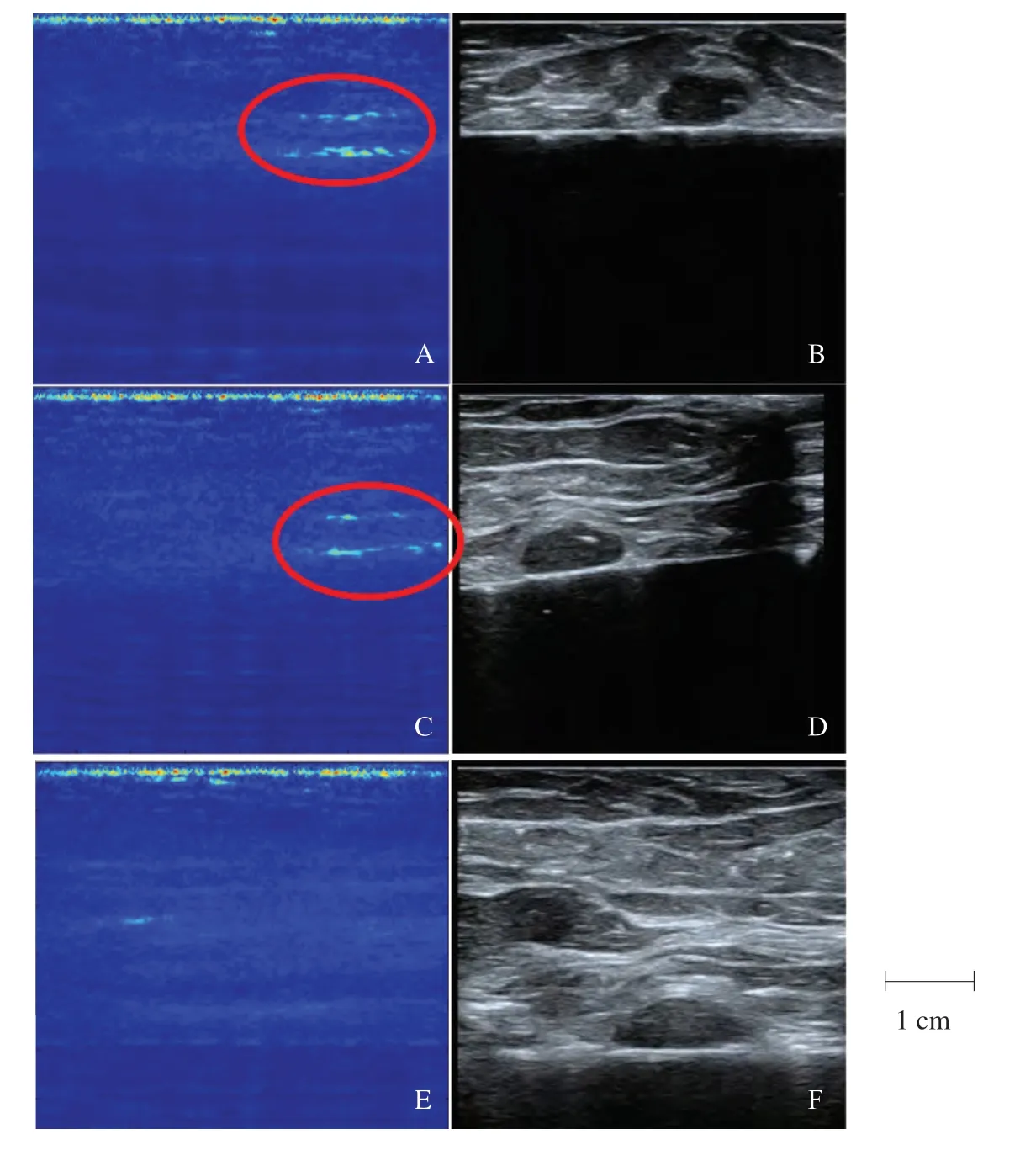
图9 SLN在深度不同的腋窝脂肪下光声成像与超声成像Fig.9 Photoacoustic images and ultrasound images of SLN at different depths
2.3 ICG-RIT定位SLN的能力
ICG-RIT组,3只SD大鼠用PASS及PAI探测腘LN体表,距超声换能器9.57 mm处探及高信号,光声信号平均为2.00 mV,对侧后肢腘LN处未探及明显信号,髂LN处未探及明显信号(图10)。沿光声信号解剖大鼠后肢未见绿染LN(图10G、H)。取下LN后可见腘LN光声信号平均为2.50 mV,髂LN未见明显光声信号。MB组,腘LN处距超声换能器6.19 mm处探及光声信号平均为2.25 mV,髂LN处距换能器14.34 mm处探及光声信号平均为3.00 mV,PAI明确显像腘LN及髂LN(图11A~D),取出LN后见腘LN光声信号平均为20.25 mV,髂LN光声信号7.74 mV(图12)。大鼠后肢注射ICG-RIT和MB各级LN光声信号强度对比如表1所示。证明PASS能准确地定位富集ICG-RIT的LN,具有定位SD大鼠腘LN的性能,且在30 min内无次级LN显像。对比可看出,肉眼下MB染色的LN可视性优于ICGRIT组(图10G、H和图11E、F)。
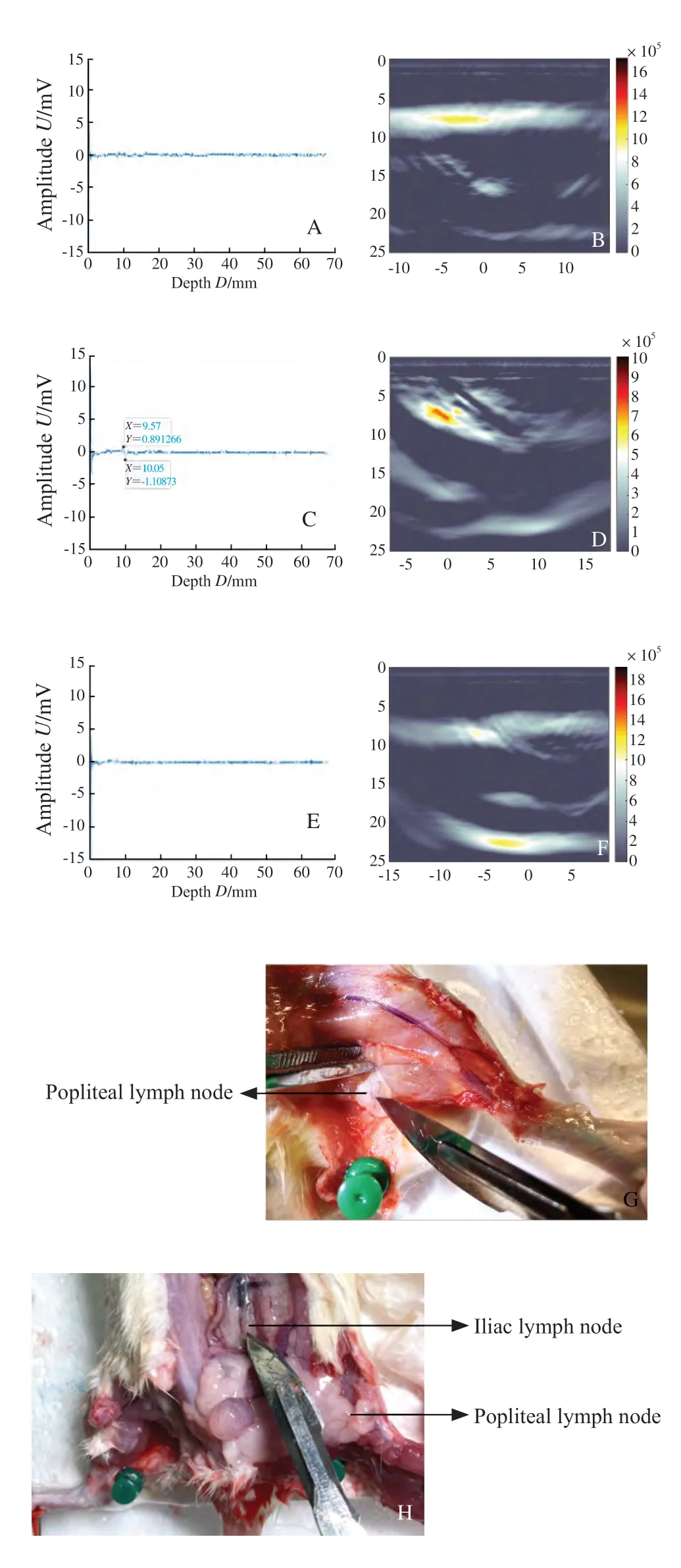
图10 大鼠后肢注射ICG-RIT各级LN光声信号强度及对应光声成像Fig.10 Amplitudes and photoacoustic images after injection of ICG-RIT
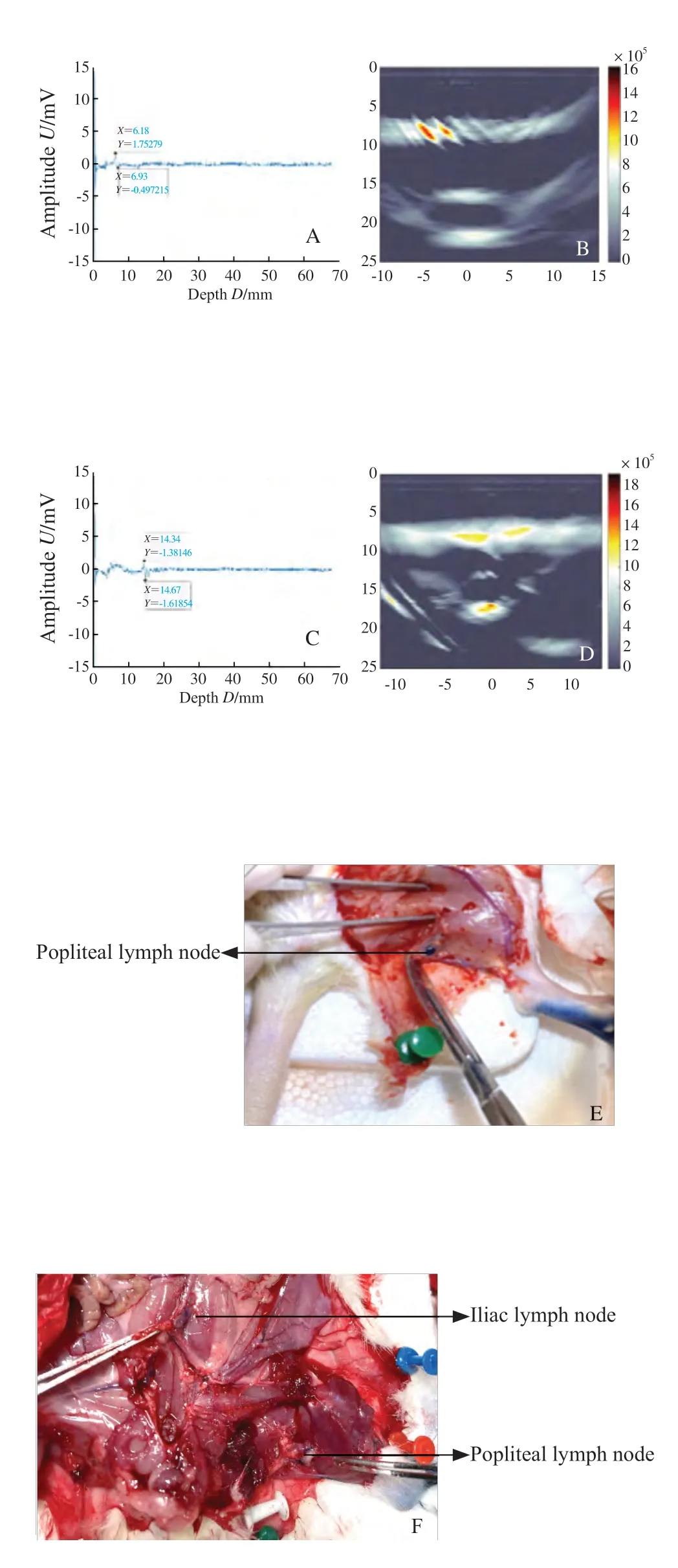
图11 大鼠后肢注射MB各级LN光声信号强度及对应光声成像Fig.11 Amplitudes and photoacoustic images after injection of MB
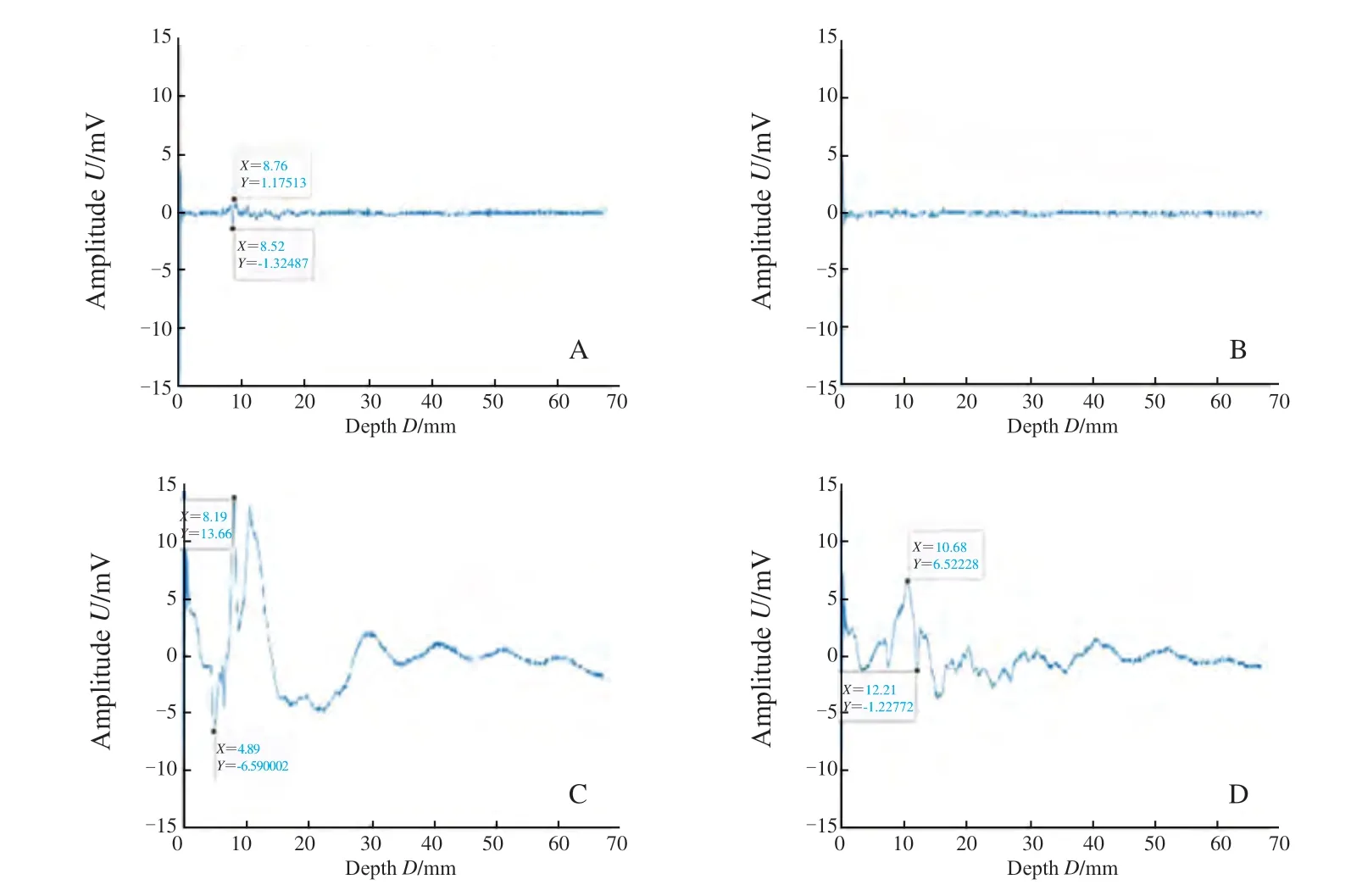
图12 离体LN后光声信号图Fig.12 Amplitudes of ex vivo lymph nodes
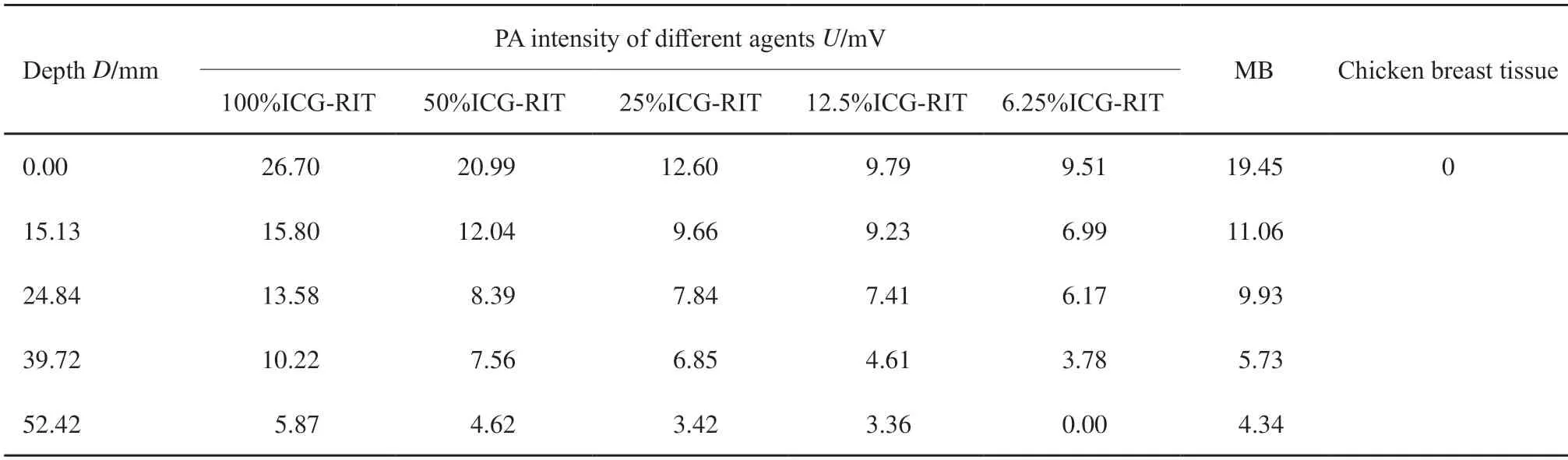
表1 不同浓度ICG-RIT仿体在各深度下的光声信号强度Tab.1 Amplitudes of ICG-RIT phantoms with different concentrations at different depths

表2 大鼠后肢注射ICG-RIT与MB各级LN光声信号强度对比(mV)Fig.2 Amplitude differences between ICG-RIT and MB at different level lymph nodes
3 讨论
SLNB是早期乳腺癌患者分期的标准技术,SLN阴性的患者可以豁免腋窝淋巴结清扫,从而减少腋窝淋巴结清扫引发的上肢淋巴水肿、感觉异常及运动障碍等并发症[1-2]。因此准确定位并识别SLN是重要环节。当前指南[15]推荐蓝染法联合核素法作为SLN示踪技术,但其仍存在一定的限制性,MB会使次级LN染色,可出现皮肤色素沉着导致坏死的不良反应;核素具有放射性,同时其制备过程需严格质控,这需要医院配备核医学科室[3-5]。理想的示踪剂应具备靶向性:局部注射后,由外周淋巴管网快速到达并大量积聚在SLN,不进入次级淋巴结;可视性:确保SLN可被准确识别,肉眼可见/可经特殊设备探测发现;可重复性:易质控;以及安全性、操作简便、价格低廉等特点[8]。
为此,我们团队研究将大分子的RIT与小分子的ICG进行偶联,其原理为小分子ICG中的含硫活性基团与大分子RIT中的自由氨基相结合,每个大分子的利妥昔单抗能偶联15~20个小分子ICG,新形成的ICG-RIT以ICG产生荧光效应,以RIT产生靶向定位效应。通过荧光成像仪显像富集ICG-RIT的SLN,以此行SLNB。该新型示踪剂制备工艺简单且无放射性危害,为无菌、无致热原、无急性毒性的示踪剂。同时,ICG-RIT是一种粒径稳定的偶合物,通过透射电镜确认其粒径为200~300 nm,皮下注射时能通过淋巴管(100~500 nm)而不会进入毛细血管(20~50 nm)。当RIT与ICG以质量比为4∶1制备,注射剂量为10 μL/20 mg小鼠时(含ICG 12.5 μg),在荧光成像系统中能达到SLN显像且无次级LN显像效果。但其最大穿透深度约为22 mm,实际操作中容易漏检产生荧光效应的淋巴管及LN[6-7,16]。
本研究利用ICG的光声效应,其依赖于光热转换,造影剂吸收脉冲激光引起局部热弹性膨胀,随后向外辐射超声波,由于不同组织成分的光吸收系数不同,超声换能器可以检测到不同强度的超声波,分析处理后即形成了组织光能吸收差异光声信号图。光声技术不仅结合了光学成像高对比度和超声成像高穿透力的优势,还能通过光声造影剂获得组织功能和相关分子信息,有助于组织结构形态、生理病理特征和代谢功能等的研究,在生物医学领域具有广阔的应用前景[8-10]。ICG光吸收峰位于近红外区域,与RIT结合后光吸收峰位于780 nm,在手持式PASS下定位效果优于荧光成像系统。
本研究应用100 μL/250 mg大鼠(含ICG 125 μg),实验显示注射30 min后,SD大鼠腘LN显像,而无髂LN显像,证明ICG-RIT靶向停留在腘LN中,在PASS系统中成像特征性单峰信号图,证明富集ICG-RIT的LN能被特异性识别;在仿体实验中,小于2.74 mV的光声信号难以与鸡胸组织产生的基础信号区分,而大鼠实验中2.00 mV信号与基础信号区分度大,即光声信号强弱不代表识别难易程度。不同组织下基础光声信号呈现不同波形,识别特定信号依赖于与基础信号的区分,提示后续研究需采集不同组织的基础信号,以识别特定信号波形,从而避免系统误差,提示操作手持式PASS系统需要一定的学习曲线。接收到的光声信号强度与超声换能器到探测组织内产生光声信号源的距离相关,距离越近光声信号强度越高,预计临床应用时与核素探测仪效果相似,即探头与被探测物越近则信号越强,结合特定信号区别于基础信号即可识别前哨LN。ICG-RIT淋巴结在PASS系统中穿透腋窝脂肪厚度达到32.72 mm,突破以往利用荧光效应显像时穿透深度低的限制;深度大于32.72 mm时,其特定信号与基础信号难以区分,这是因为激光穿透组织深度有限,以及光声信号穿透组织时有更大衰减使得信号淹没在其他非目标组织所产生的信号中。
早期乳腺癌腋窝的外科处理传统意义上是为了提升生存率、提高局部控制率以及为分期和治疗决策提供依据。当前早期乳腺癌外科处理在有效的局部控制及全身治疗的基础上呈现降阶梯化的趋势,腋窝处理更大的作用在于提供分期信息以及为全身治疗决策提供依据。在此背景下,精准识别乳腺癌腋窝SLN能更大程度地减少患者腋窝损伤,提高生活质量。利用ICG-RIT的淋巴结靶向性及新型手持式PASS和手持式PAI的高组织穿透力,该技术有望精准地识别乳腺癌SLN,使SLNB进一步微创化,是一项理想的示踪技术,需要进一步开展临床试验证实。
总之,利用ICG-RIT的光声特性、靶向LN特性及良好的被探测深度,通过手持式PASS系统及手持式PAI能特异性定位SLN,具有良好的应用前景,但仍需进一步临床试验数据证实。
利益冲突声明:所有作者均不存在利益冲突。

