栽培一枝蒿粗多糖佐剂增强口蹄疫疫苗的皮下免疫效果
翁 翔,张爱莲*,李泉晓,吴道澄,曹 辉
(1. 新疆大学生命科学与技术学院,新疆生物资源与基因工程重点实验室,乌鲁木齐 830046; 2. 西安交通大学生命科学与技术学院,西安 710000; 3. 天康生物股份有限公司,乌鲁木齐 830000)
中草药在人类和动物传染病防控过程中发挥着重要的作用,在流感、人类免疫缺陷病毒(human immunodeficiency virus, HIV)、乙型肝炎病毒(hepatitis B virus, HBV)、口蹄疫等疾病以及流行的埃博拉和新冠肺炎的治疗过程中疗效显著[1-3]。中草药的多种成分具有免疫调节活性,其中多糖能促进免疫器官发育,增强树突状细胞(dendritic cells, DC)的吞噬能力,促进体液免疫和细胞免疫应答[4-5]。中草药多糖作为疫苗佐剂已经被系统和广泛的研究,如,菊粉多糖AdvaxTM可作为流感、HIV、HBV、西尼罗河病毒和非洲马热病毒的疫苗佐剂,黄芪多糖可作为狂犬病灭活疫苗和口蹄疫疫苗的佐剂,人参水提物在H5N1禽流感疫苗和口蹄疫疫苗中具有良好的佐剂效果[6-9]。
口蹄疫(foot-and-mouth disease, FMD)具有高度的传染性,可造成巨大的经济损失,接种疫苗是控制口蹄疫传播的有效方法[10-11]。目前使用的是口蹄疫灭活疫苗(foot-and-mouth disease vaccine, FMDV)免疫原性较差,佐剂的应用是提高疫苗效力的方法之一。现有口蹄疫灭活疫苗的佐剂主要有ISA-206、ISA-201、AS03、铝佐剂[12]。现有的口蹄疫商品疫苗中通常包含ISA-206油乳佐剂,虽然ISA-206能够增强疫苗的效力,但是会引起注射部位坏死,肉芽肿和脓肿等不良反应。由于口蹄疫疫苗佐剂的种类有限,随着免疫协同概念的不断深入,植物多糖佐剂与多种类型免疫激动剂相结合的策略已被证明具有良好的免疫增强作用[9, 13]。因此,开发低副作用,低成本,高效的新型佐剂对口蹄疫的防治势在必行。
新疆一枝蒿(ArtemisiarupestrisL.)是菊科蒿属植物,作为中草药具有抗病毒,抗炎,免疫调节等功能[14]。前期研究发现新疆野生一枝蒿粗多糖具有良好的佐剂效应,作为流感疫苗,FMDV和OVA的佐剂可以增强抗原特异性的细胞和体液免疫应答[15-17]。由于过度采集野生一枝蒿已经成为濒危物种,栽培一枝蒿已成功大面积种植,但是栽培一枝蒿活性成分的免疫调节作用还没有进行详细研究。鉴于DC通过激活效应T细胞启动获得性免疫应答,中草药及其活性成分可通过调节DC功能影响免疫应答[18-19]。因此,本研究选用栽培一枝蒿粗多糖(cultivatedArtemisiarupestrisL. crude polysaccharides, CARCP)佐剂FMDV皮下免疫ICR小鼠,通过检测小鼠体液和细胞免疫应答,以及DC和调节性T细胞的水平,评价CARCP的佐剂活性,为CARCP作为FMDV的候选佐剂提供实验依据。
1 材料与方法
1.1 材料
新疆栽培一枝蒿;口蹄疫灭活抗原(FMD-Ag),ISA-206佐剂和口蹄疫灭活疫苗FMDV(FMD-Ag+ISA-206)均由天康生物股份有限公司提供;辣根过氧化物酶标记的山羊抗鼠IgG、IgG2a和IgG1购自Southbiotech公司;N-四甲基联苯胺(TMB)购买于蓝季科技发展有限公司;RPMI 1640培养基购自Gibco公司;胎牛血清购自BI公司;青霉素/链霉素溶液购自Hyclone公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自Biosharp公司;调节性T细胞检测试剂盒购自eBioscience;流式抗体:异硫氰酸荧光素(FITC)标记的CD4、CD8a、MHC-Ⅱ,藻红蛋白(PE)标记的CD3、CD44、Foxp3、CD11c,别藻蓝蛋白(APC)标记的CD4、CD25、CD86等均购自BD公司;其他试剂均为国产分析纯试剂。
1.2 制备粗多糖
采用80 ℃水提醇沉法制备CARCP[20],栽培一枝蒿粉末用无水乙醇脱色,以1∶20料液比加入蒸馏水,80 ℃浸提4 h,收集上清液,重复上述步骤,将上清液合并,真空旋蒸浓缩至200 mL,Sevag法除蛋白。最后加入4倍体积无水乙醇置于(4 ℃)过夜沉淀,收集沉淀烘干得到CARCP。苯酚/硫酸法测得多糖含量为35.65%。
1.3 疫苗配制
0.9% NaCl溶解CARCP配成50 mg·mL-1的多糖母液,疫苗配方是分别将FMD-Ag与ISA-206佐剂混匀或与添加CARCP的ISA-206按照体积比1∶1.1充分混合。将抗原和佐剂在自动混合机中低速(300 r·min-1)混合搅拌10 min,最终形成水包油包水的双乳状液。
1.4 实验动物及免疫
SPF级雌性ICR小鼠(7~9周龄)购自新疆医科大学动物实验中心。将小鼠随机分为5组,每组6只,分别为0.9% NaCl组(空白对照),FMDV组(试验对照),FMDV-CARCP-L组(FMDV+CARCP 50 μg),FMDV-CARCP-M组(FMDV+CARCP 300 μg),FMDV-CARCP-H组(FMDV+CARCP 600 μg)。其中灭活抗原的剂量为0.3 μg,免疫总体积为150 μL,采用背部皮下2点免疫小鼠,共免疫两次,间隔2周。初免后14 和21 d眼眶静脉窦采血,收集血清用于抗体水平检测,28 d收集小鼠脾和腹股沟淋巴结,流式细胞术检测T细胞亚群。用相同的免疫策略免疫小鼠后,用来检测小鼠脾DC共刺激分子的表达和CD4+CD25+Foxp3+T细胞的表达。免疫后的小鼠每周称量一次体重,监测小鼠的生长状态。
1.5 血清IgG抗体及其亚类水平检测
间接ELISA法检测初免后14、21 d小鼠血清中IgG、IgG1和IgG2a抗体的水平。具体检测方法:FMD-Ag用抗原包被液稀释至0.125 μg·mL-1,每孔100 μL包被于ELISA板中,置于4 ℃过夜包被;用5%脱脂奶粉在37 ℃封闭1 h;将待测血清按照14 d血清1∶100稀释,21 d血清1∶1 000稀释,将稀释后的血清加入ELISA板中,在37 ℃ 孵育1 h; 再加入HRP标记的山羊抗鼠IgG或IgG1或IgG2a,在37 ℃孵育1 h;最后用PBST洗涤3次,加入显色液避光显色15 min;加入2 mol·L-1H2SO4终止反应,检测OD450 nm/OD655 nm吸光度(A)值。
1.6 淋巴结T细胞亚群以及脾DC与T细胞亚群检测
无菌制备脾和淋巴结单细胞悬液,裂解红细胞并将细胞浓度调整为5×106个·mL-1,取100 μL单细胞悬液加入15 mL离心管,用含有0.5% FBS的PBS(PBSF)洗涤细胞,1 200 r·min-1离心7 min,弃上清,分别用CD3、CD8a、CD4、CD44荧光抗体染脾和淋巴结T细胞亚群;CD11c、MHC-Ⅱ、CD86荧光抗体染脾DC;加入荧光抗体避光染色30 min,PBSF终止染色,1 200 r·min-1离心7 min,弃上清,加入300 μL PBS吹散细胞,200目铜网过滤后上流式细胞仪检测。
1.7 脾调节性T细胞检测
每组随机选取3只小鼠,制备1×107个·mL-1脾单细胞悬液,取100 μL细胞悬液加入PBSF 8 mL,1 200 r·min-1离心7 min,弃上清,获得沉淀的细胞,加入CD25和CD4荧光抗体常温避光染色30 min, PBSF终止染色,1 200 r·min-1离心7 min,弃上清后,使用Tregs检测试剂盒处理细胞,Foxp3荧光抗体避光染色30 min,Wash buffer终止染色,使用流式细胞仪检测CD4+CD25+T细胞中Foxp3的表达量。
1.8 统计分析
2 结 果
2.1 CARCP对FMDV特异性IgG抗体及其亚类的影响
检测初免后14和21 d血清IgG抗体水平,结果如图1A所示:初免后14 d,CARCP中剂量组和高剂量组可以显著提高血清IgG抗体水平(P<0.05)。初免后21 d,抗体水平较14 d有明显提高,CARCP中剂量和高剂量组与FMDV组相比均可以显著增加IgG抗体水平(P<0.05)。检测IgG1抗体水平,结果如图1B所示,CARCP中剂量和高剂量组能有效提高IgG1抗体亚类水平(P<0.05)。检测IgG2a抗体水平,结果如图1C所示,CARCP的三剂量均能极显著增强IgG2a抗体水平(P<0.01),其中CARCP中剂量为最优剂量。
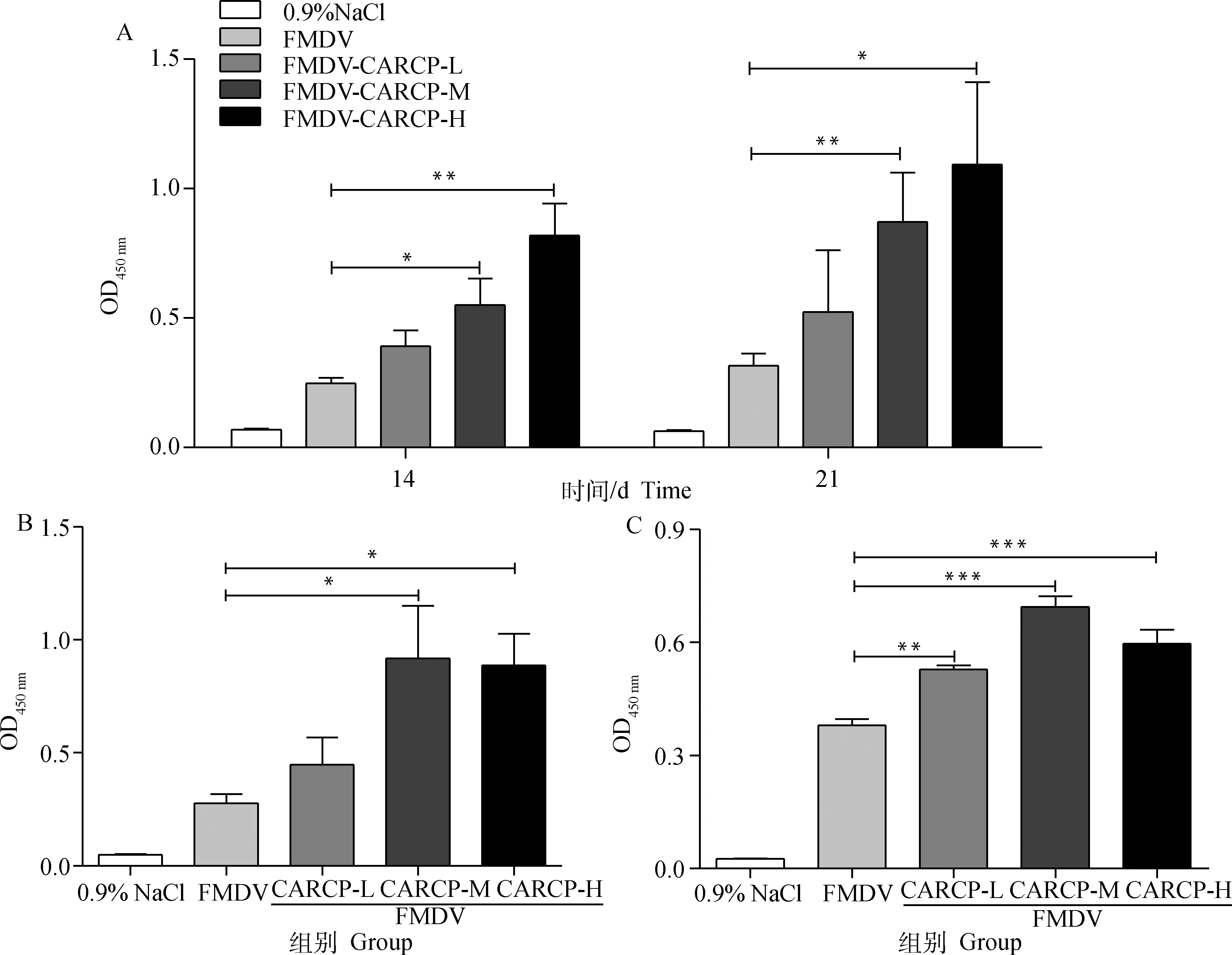
A. 14和21 d IgG抗体水平; B. 21 d IgG1抗体水平; C. 21 d IgG2a抗体水平。与FMDV免疫组相比, *.P<0.05, **.P<0.01, ***.P<0.001A. IgG antibody levels at 14 and 21 d; B. IgG1 antibody levels at 21 d; C. IgG2a antibody levels at 21 d;Compared with FMDV immune group, *.P<0.05, **.P<0.01;***. P<0.001图1 CARCP对FMDV特异性IgG抗体及其亚类的影响(n=6)Fig.1 Effects of CARCP on FMDV-specific IgG antibody and subclass (n=6)
2.2 CARCP对淋巴结T细胞亚群的影响
二免后14 d,每组取3只小鼠,流式细胞术检测淋巴结T细胞亚群百分比,结果如图2所示:与FMDV单独免疫组相比,CARCP低剂量组和中剂量组CD3+CD4+T细胞百分比显著提高(P<0.05)。CARCP中剂量组中CD3+CD8+T细胞百分比极显著提高(P<0.01)。CARCP中剂量组CD4+CD44+效应T细胞百分比极显著提高(P<0.01)。CARCP中剂量组CD8+CD44+效应T细胞百分比显著提高(P<0.05)。
2.3 CARCP对脾T细胞亚群的影响
取二免后14 d小鼠脾,制备单细胞悬液,流式细胞术检测脾T细胞亚群,结果如图3所示: CARCP中剂量组CD3+CD4+和CD3+CD8+T细胞百分比显著高于FMDV组(P<0.05)。CARCP中剂量组CD4+CD44+效应T细胞百分比极显著高于FMDV组(P<0.01)。CARCP低剂量组和CARCP中剂量组CD8+CD44+效应T细胞百分比显著高于FMDV组(P<0.05)。
2.4 CARCP对小鼠脾DC共刺激分子和对Tregs表达的影响
收集二免后14 d脾,制备单细胞悬液,流式细胞术检测免疫小鼠后CARCP对脾DC表面MHC-Ⅱ与CD86的表达,以及CD4+CD25+Foxp3+Tregs细胞的比例。结果如图4所示,CARCP低、中、高3个剂量组与FMDV单独免疫组相比,MHC-Ⅱ分子的表达显著提高(P<0.05)。CARCP中剂量组CD86表达极显著提高(P<0.01)。CARCP中剂量和高剂量组CD4+CD25+Foxp3+Tregs细胞的比例被显著抑制(P<0.05)。
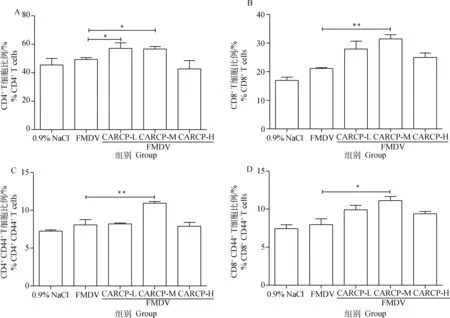
A. 淋巴结CD4+T细胞; B. 淋巴结CD8+T细胞; C. 淋巴结CD4+CD44+T细胞; D. 淋巴结CD8+CD44+T细胞。与FMDV免疫组相比, *.P<0.05, **.P<0.01A. Detection of lymph node CD4+T lymphocyte; B. Detection of lymph node CD8+T lymphocyte; C. Detection of lymph node CD4+CD44+T lymphocyte; D. Detection of lymph node CD8+CD44+T lymphocyte. Compared with FMDV immune group, *.P<0.05, **.P<0.01图2 FACS检测淋巴结T细胞亚群比例(n=3)Fig.2 Effect of CARCP on T cell subsets in lymph nodes (n=3)
2.5 CARCP处理对小鼠平均体重的影响
为评价CARCP对小鼠生长是否造成影响,每周称量1次小鼠体重,如图5所示,发现小鼠体重的差异无统计学意义(P>0.05)。观察FMDV组小鼠的注射部位,可以明显发现在注射部位产生了皮下肉芽肿,2周之后肉芽肿未消退,添加CARCP组在注射部位未观察到明显的肉芽肿等局部反应。免疫后也未发现CARCP对小鼠的饮食,活动和毛发生长造成不良的影响。
3 讨 论
佐剂辅助疫苗在传染病防治中发挥重要作用。由于对新型佐剂及其作用机制的探索有限,目前,FDA批准用于疫苗中的佐剂仅有铝佐剂、MF59、AS03、AS04、AS01和CpG ODN等[21-22]。佐剂在增强疫苗效力的同时,安全性是很重要的问题,佐剂应该足够安全,以减少临床应用的副作用,因此,开发安全有效的新型佐剂很有必要[23]。中草药多糖具有良好的免疫增强作用和低毒性成为新型佐剂筛选的理想材料,为此,本研究选用CARCP作为FMDV的候选佐剂,与ISA-206油乳剂相比,栽培一枝蒿粗多糖为水剂,可以与抗原任意比互溶,无需乳化,使用方便。在小鼠免疫后整个试验过程中,CARCP在注射部位的反应原性更低,没有出现ISA-206油乳剂注射小鼠后产生的皮下肉芽肿。试验组的小鼠,未见异常行为或副作用,对小鼠生长也没有影响,证实了CARCP提高了疫苗的安全性。
佐剂与疫苗免疫效果之间存在量效关系。合适剂量的佐剂与疫苗配伍才能诱导抗原特异性免疫应答,发挥佐剂的效果[24]。因此,为了探讨CARCP的最佳作用剂量,选用了CARCP的3个剂量,采用皮下注射进行动物免疫试验,通过对体液免疫和细胞免疫应答的检测,确定CARCP的最佳剂量。抗体检测结果表明,CARCP的中剂量和高剂量均可增强FMDV特异性抗体水平,初免后21 d的IgG抗体水平比初免后14 d有明显升高。这些研究结果显示:CARCP作为FMDV的水佐剂可以显著提高体液免疫应答。
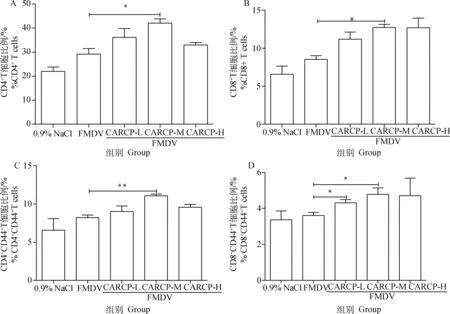
A. 脾CD4+T细胞; B. 脾CD8+T细胞; C. 脾CD4+CD44+T细胞; D. 脾CD8+CD44+T细胞。与FMDV免疫组相比, *.P<0.05, **.P<0.01A. Detection of spleen CD4+T lymphocyte; B. Detection of spleen CD8+T lymphocyte; C. Detection of spleen CD4+CD44+T lymphocyte; D. Detection of spleen CD8+CD44+T lymphocyte. Compared with FMDV immune group, *.P<0.05, **.P<0.01图3 FACS检测脾T细胞亚群比例(n=3)Fig.3 Effect of CARCP on T cell subsets in spleen (n=3)
FMDV特异性的体液免疫对于保护易感动物免受口蹄疫的威胁至关重要。但是,T细胞在诱导细胞免疫对抗感染中发挥重要作用[25]。因此,本研究检测了小鼠次级淋巴组织中T细胞亚群的表型,发现CARCP中剂量组可以增强小鼠脾和引流淋巴结中CD4、CD8、CD44 T细胞亚群的表达水平。这些结果提示,抗体水平的增强和效应T细胞亚群水平的升高有关。虽然T细胞的活化在保护机体免受某些感染的作用中至关重要,理想的佐剂应该能够诱导Th1和Th2反应,Th1反应可以产生保护性免疫,Th2反应可以激活B细胞增殖和分化,从而病毒和细菌感染时发挥防治作用[26]。T细胞亚群调节抗体亚类的产生,IgG1抗体的产生与Th2免疫相关,IgG2a抗体的产生与Th1应答有关。本研究抗体亚类IgG1和IgG2a的结果显示,CARCP中剂量组可显著升高IgG1和IgG2a水平,表明CARCP作为FMDV的佐剂可以促进Th1和Th2免疫应答。
以上研究结果表明,CARCP作为FMDV的佐剂可以显著增强FMDV特异性的免疫应答,促进初始T细胞活化成为效应T细胞。因此,可以推测CARCP佐剂FMDV也可能诱导DC成熟,降低Tregs频率。DC成熟可启动对初始T细胞的适应性免疫应答[18]。Tregs减少可增强体液和细胞免疫应答,保持机体的免疫平衡。本研究对免疫后小鼠的DC成熟和脾Tregs进行了进一步的探究,结果显示,3个剂量的CARCP作为佐剂均可提高脾中DC表面CD86和MHC Ⅱ分子的表达,表明CARCP佐剂FMDV能够活化DC并促进其成熟,这些结果与T细胞亚型结果相关。此外,CARCP免疫小鼠后,CD4+CD25+Foxp3+T细胞的频率受到抑制,表明CARCP佐剂FMDV通过促进DC成熟和降低Tregs频率来增强抗原特异性免疫应答。
免疫后相同时间各组之间体重差异不显著,P>0.05No statistical difference between groups at the same time (P>0.05)图5 CARCP对小鼠体重的影响(n=6)Fig.5 Effect of CARCP on body weight of mice(n=6)
4 结 论
通过小鼠体内试验评价CARCP对FMDV特异性免疫应答的特点,表明CARCP作为FMDV的水佐剂可以增强Th1和Th2免疫应答,促进T细胞活化,诱导DC成熟,抑制Tregs,并具有一定的安全性。这些研究结果为CARCP作为FMDV新型佐剂的研究提供重要试验参考。

