喀斯特区不同退化程度植被群落植物-凋落物-土壤-微生物生态化学计量特征
俞月凤,何铁光,*,曾成城,宋同清,彭晚霞,韦彩会,苏利荣,张 野,范 适
1 广西壮族自治区农业科学院农业资源与环境研究所, 南宁 530007 2 中国科学院亚热带农业生态研究所, 长沙 410125 3 湖南环境生物职业技术学院园林学院, 衡阳 421005
生态化学计量学理论认为有机体能够通过控制自身的养分元素平衡,使其元素组成比值和外界环境的元素供应保持一种相对稳定的状态[1],这种内稳性是生态化学计量学研究的前提[2]。有机体C、N、P 元素含量存在一个相对稳定的比值,其中任何一种元素的较大变化都将使这一比值发生变化;因此,通过有机体C∶N∶P化学计量特征的变化,该理论可以用来判断有机体生长、发育或者繁殖的限制元素种类[3]。生态化学计量学是生态学研究的前沿领域之一,研究主要集中于生态过程中C、N、P元素的计量关系及其生态学意义。当前,国内外学者对陆地生态系统各组分(植物、凋落物、土壤和微生物)C∶N∶P生态化学计量学特征进行了大量研究,尤其在限制性养分元素判别方面形成了植物 N∶P 养分限制理论[4],但有关退化生态系统的生态化学计量特征及养分限制的研究较少,主要集中在退化草地、山地、湿地及竹林地等生态系统[5—8],且主要关注某一组分(土壤、植物、凋落物或者微生物)或土壤-植物-凋落物的生态化学计量学特征,将“植物-凋落物-土壤-微生物”连续体作为系统研究退化生态系统内部C、N、P 计量学及其相互关系的研究尚未见报道。在植物-土壤系统中,土壤养分循环与植物营养过程与微生物的分解作用密切关联,微生物生物量C∶N∶P决定了其对养分的矿化、固存作用,进而影响着土壤肥力[9];土壤有机质及植物凋落物反过来也会对微生物的分解速率产生影响,从而导致土壤养分有效性的改变[10],而植物养分化学计量比的改变则可以反映出养分有效性的变化;养分有效性的变化则可以通过植物的改变反映出来[11]。此外,植物养分元素的内稳态可反映各养分元素的平衡状态, 是植物对环境变化的响应策略[12]。植物生态化学计量内稳性研究已经得到学者们的关注,但有关研究还不多[13]。由于不同的生态系统类型、不同植物群落类型之间存在明显差异,植物生态化学计量内稳性在不同生态系统和群落中的特征亟待阐明。因此,利用生态化学计量学的思路来研究退化生态系统中“植物-凋落物-土壤-微生物”系统C、N、P元素的动态平衡及植物内稳性特征具有重要的生态学意义。
喀斯特地区环境由于其形成的碳酸盐岩基质的特殊性而与常态地貌有着极大的差别,过度的人为干扰造成了喀斯特地区植被的退化,水土流失加剧,导致了十分严重的石漠化现象,严重制约了该区域可持续发展。生态化学计量学的理论和方法可为研究喀斯特区域植被退化过程及其机理提供新思路。近年来,有关喀斯特地区生态化学计量学方面的研究发展较快。刘娜等[14]和刘立斌等[15]探究了喀斯特高原石漠化区次生林植物、凋落物和土壤C、N、P生态化学计量特征;Song等[16]报道了喀斯特地区土壤和微生物碳氮磷化学计量特征对不同演替阶段植物群落的响应;胡培雷等[17]研究了喀斯特石漠化地区不同退耕年限下桂牧1号杂交象草植物-土壤-微生物生态化学计量特征。这些研究表明喀斯特不同植被类型群落生态化学计量比存在差异,或受N 或受P 素制约,但对群落生态化学计量特征与喀斯特植被退化的关系及退化机理方面的研究尚显不足,研究喀斯特植被退化过程中植物、凋落物、土壤和微生物系统C、N、P生态化学计量特征及植物内稳性特征的变化,有助于理解喀斯特生态系统退化机理。本文以桂西北喀斯特地区为研究区域,通过建立不同退化程度植被群落样地,并进行土壤和植被调查,研究植物-凋落物-土壤-微生物系统生态化学计量变化特征、相互关系及植物内稳性特征,旨在揭示:(1)喀斯特生态系统退化是否会引起植被、凋落物、土壤、微生物系统C、N、P含量变化,从而改变其化学计量特征及养分限制格局与内稳性?(2)这种变化与喀斯特生态系统退化的关系如何?通过上述问题的探讨,以期为喀斯特退化生态系统植被恢复与重建提供科学依据。
1 研究区概况及研究方法
1.1 研究区概况
研究区选择在广西大化瑶族自治县(107°18′45″—108°03′45″E,23°32′30″—24°22′30″N),位于云贵高原向广西丘陵过渡地带的斜坡上,属于广西最典型的“九山半水半分田”的石山区贫困县。全县总面积2716 km2,耕地总面积162 km2,境内峰丛密布,喀斯特面积共2059 km2,占全县总面积的73%,喀斯特地貌较为典型。成土母质以碳酸盐岩为主,地带性红壤只是分布在土山,石山、半石山普遍为石灰土。研究区气候温和,属中亚热带季风气候,雨热同季。年平均气温18.2—21.3 ℃。1月份气温最低,平均12.2 ℃,极端最低气温零下3 ℃,7月份气温最高,平均28.2 ℃,极端最高气温39.7 ℃。年日照时数1217—1587 h,年积温6300 ℃。生长期、无霜期年平均分别达300 d、335 d。多年平均相对湿度74%—80%。年平均降雨量1249—1673 mm,蒸发量1213—1645 mm。桂西北喀斯特地区是西南喀斯特地区代表性区域,其生态环境极其脆弱,该区域一直以来是喀斯特地区生态恢复与重建的重点和难点。自20世纪80年代中期之后,该区域开始实施以植被恢复为主的宏观生态工程,植被开始得到自然恢复,因此不同退化程度的植被群落共存。
1.2 研究方法
1.2.1野外调查及取样
本研究在对研究区环境及植被特征全面调查的基础上,结合相关资料,采用空间序列代替时间序列的方法,将植被群落分为5个退化程度(表1):未退化(Ⅰ)、潜在退化(Ⅱ)、轻度退化(Ⅲ)、中度退化(Ⅳ)、重度退化(Ⅴ)。经过全面踏查,2016年7月选择符合5个退化程度的典型植被群落设置样地,每个退化程度设置9个20 m × 20 m样地,共计样地45个,样地设置及样地基本情况团队已报道过[18—19]。在样地内按“S”型随机采取5—8个表层土壤样品(0—15 cm),混合后代表该样地表层土样;在每个样地内选择各群落内的优势种采集植物叶片。各乔木按径阶选取平均标准木采集叶片,同种树种不同径阶标准木叶片混合,取冠层东南西北4 个方位和上中下各部位完整的成熟叶片,每份样品200—300 g;灌丛和灌草丛中灌木叶片的采集在地面借助剪刀完成,收集方法同上。采集草本植物叶片时直接用剪刀剪取成熟叶片。在样方的4个角和中央设置5个1 m×1 m的方格收集凋落物,其中部分为枯落物,如凋落叶片、枝条、草本和木炭等,有些是难以分辨的有机物分解碎片。
1.2.2样品处理及测定
每个土壤样品充分混匀后按四分法分成两份,一份现场密封后入冰柜保存(4 ℃),并尽快分析土壤微生物生物量C、N、P;一份带回实验室风干,先过1 mm筛,得到土壤样品再过0.149 mm筛,用于测定土壤有机质、全氮、全磷。收集到的叶片和凋落物带回实验室后,放入烘箱105℃ 杀青2 h后80℃烘干至恒量,然后粉碎、过0.149 mm筛、装信封待测定。有机碳(SOC)含量采用重铬酸钾氧化-外加热法测定,全氮(TN)含量采用半微量凯氏法-流动注射仪法测定,全磷(TP)含量采用NaOH熔融-钼锑抗显色-紫外分光光度法测定。植物全C含量采用重铬酸钾氧化-外加热法测定,N含量采用H2SO4-H2O2消煮、流动注射仪法测定,P含量采用H2SO4-H2O2消煮、钼锑抗比色法测定。土壤微生物量碳采用CHCl3熏蒸法-K2SO4提取-总有机碳自动分析仪法,微生物量氮采用CHCl3熏蒸-K2SO4提取-氮自动分析仪法,微生物量磷采用CHCl3熏-NaHCO3提取-Pi 测定-外加Pi 校正法-紫外分光光度法测定;微生物碳、氮转换系数为0.45,微生物磷转换系数为0.40[20]。
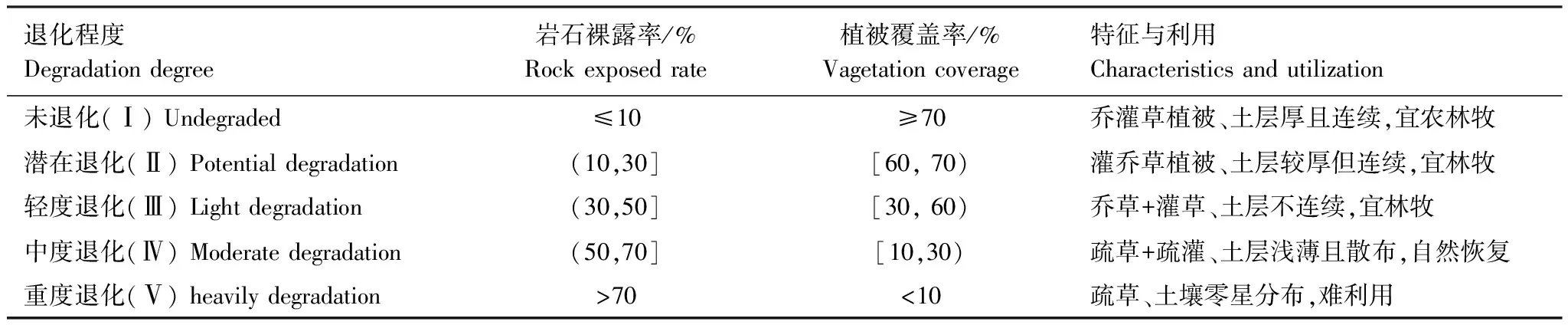
表1 植被群落退化等级划分标准
1.3 数据处理
化学计量比根据各优势种在群落内的重要值,利用加权平均计算。采用Excel 2010 和SPSS 18. 0 软件对数据进行统计分析。用单因素方差分析(ANOVA) 检验不同退化阶段土壤、植物、凋落物和微生物C、N、P 浓度及其化学计量比之间的差异性,然后用最小显著差数法(LSD) 检验差异显著性。
植物内稳态反映植物随着环境变化保持自身化学组成稳定的能力[21],内稳性的高低用内稳性指数来表示,通过内稳性模型计算得出,该模型公式为:
y=cx1/H
其中,x为土壤N或P含量(g/kg)或N∶P值,y为植物体器官对应的全氮(N)或全磷(P)含量(g/kg)或N∶P值,c为常数,H为植物内稳性指数。
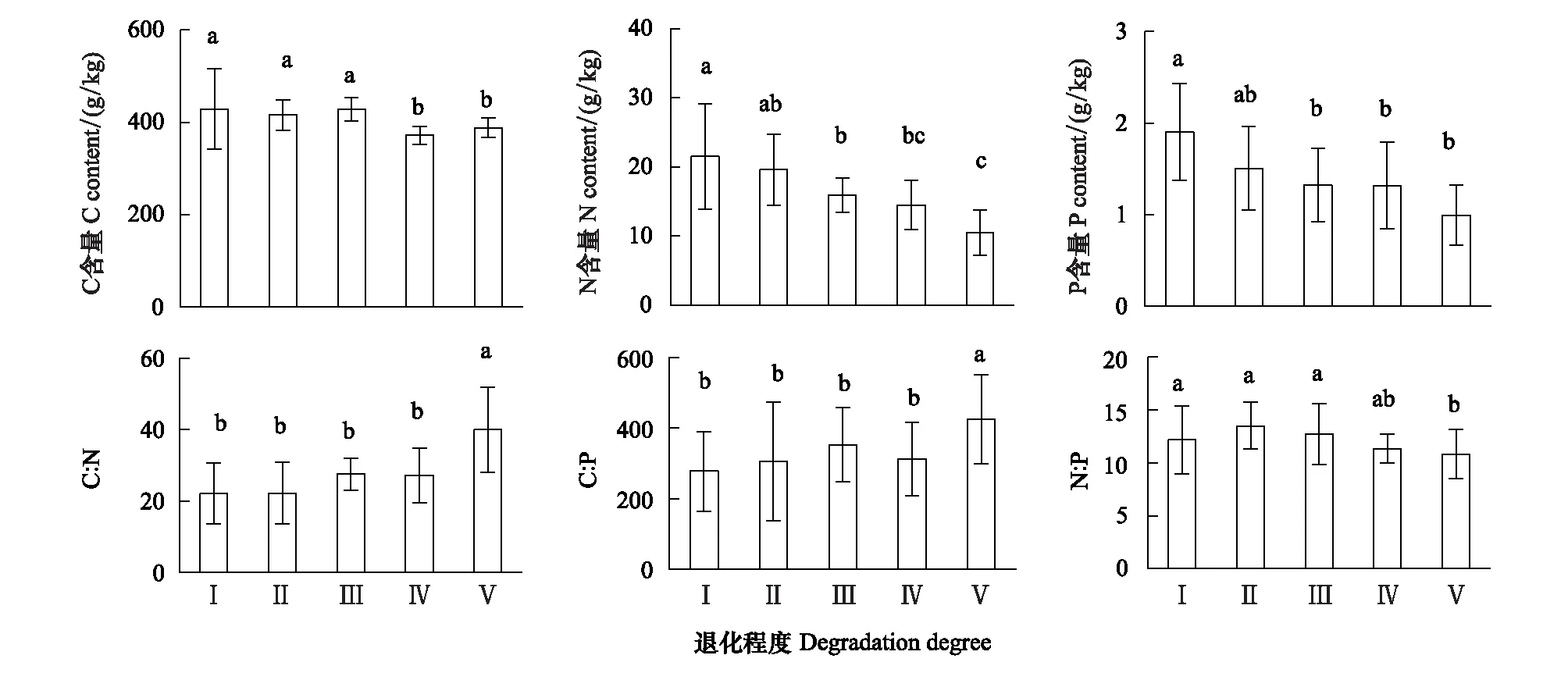
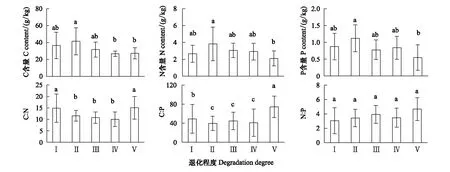
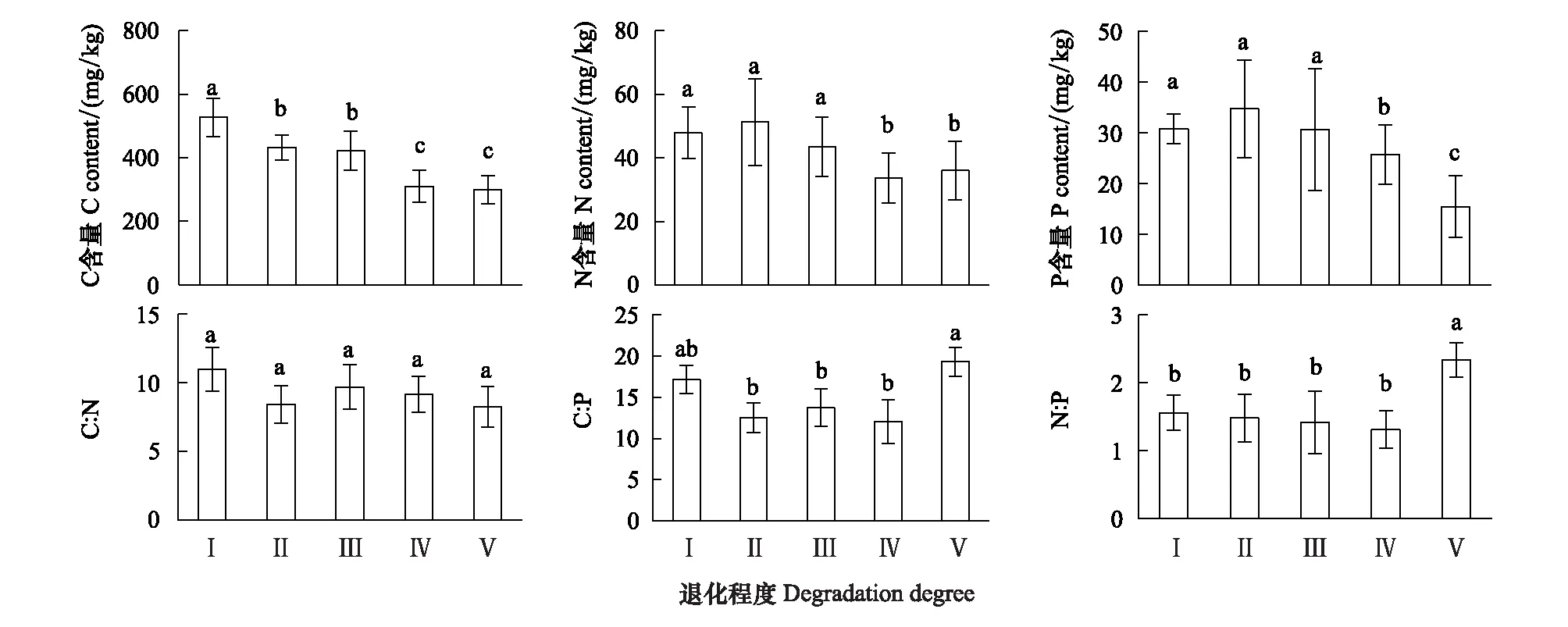
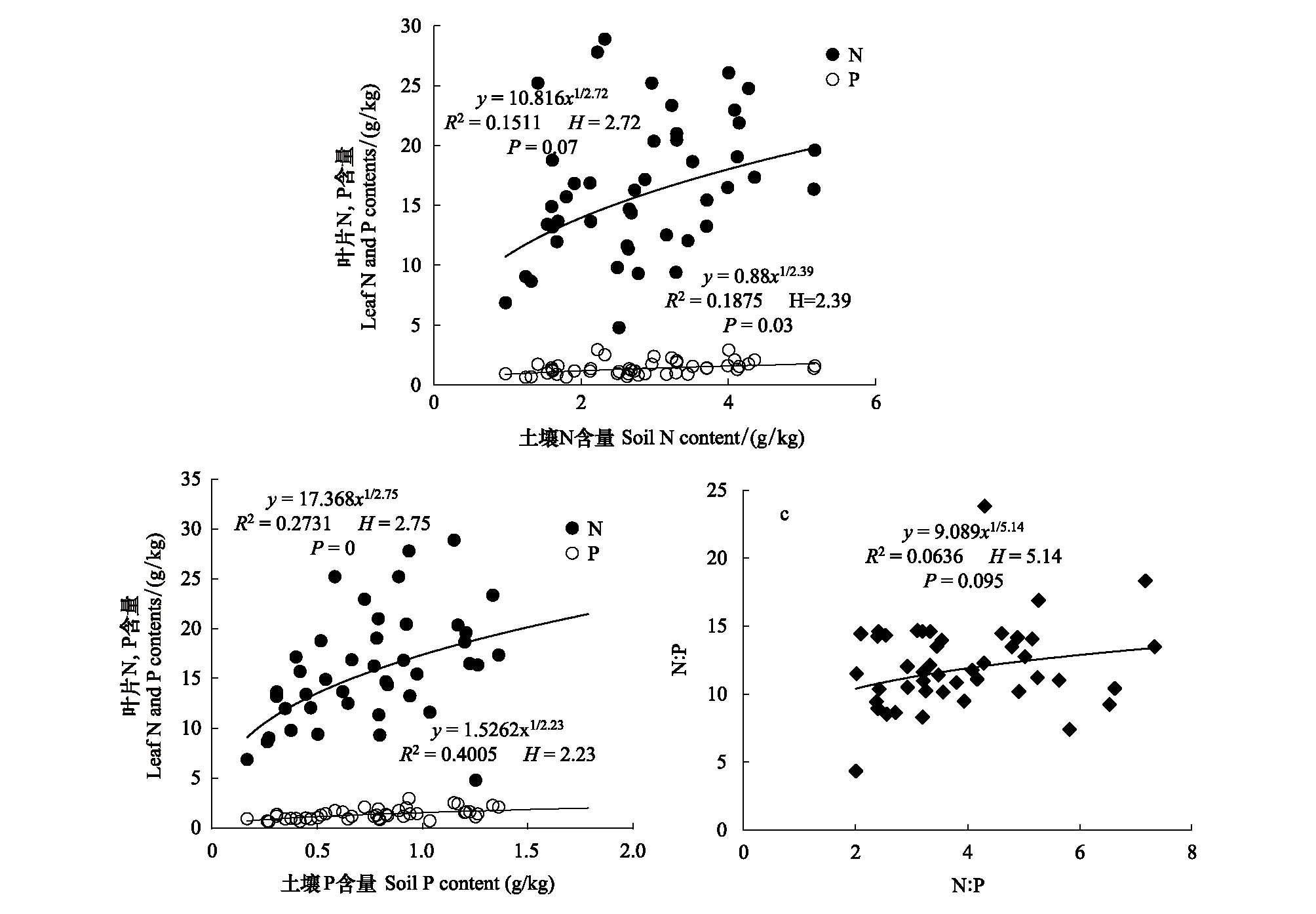
Persson[22]认为植物内稳性特征可用内稳性指数H进行界定。回归分析显著性检验采用α=0.1 进行单侧检验,若回归关系不显著 (P>0.1),被定义为“绝对稳态”;当回归分析显著时(P≤0.1),按内稳性指数可将植物划分为4种类型:H>4为稳态型;2 由图1 可知,随退化程度加剧,叶片C、N、P含量呈降低变化趋势,叶片C∶N和C∶P逐渐升高,N∶P则呈先升高后降低的趋势。未退化、潜在退化与轻度退化群落叶片的C含量及中度退化、重度退化群落叶片的C含量间均无显著差异,但前三者叶片C含量均显著高于后二者。未退化群落叶片N含量最高,与潜在退化群落无显著差异;潜在、轻度与中度退化群落叶片N含量间无显著差异;重度退化群落叶片N含量最低,与中度退化群落无显著差异,但显著低于轻度退化群落。未退化群落叶片P含量显著高于轻度、中度和重度退化群落,潜在退化群落叶片P含量则与其他群落间均无显著性差异。重度退化群落叶片C∶N和C∶P显著高于其他群落,其N∶P则最低;其他四个群落叶片的C∶N、C∶P和N∶P之间无显著性差异。 图1 不同退化程度群落植物叶片C、N、P 含量及化学计量比Fig.1 Leaf C、N、P contents and stoichiometric ratio in vegetation communities along degradation不同小写字母代表不同退化程度之间差异显著(P<0.05);Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别表示未退化、潜在退化、轻度退化、中度退化、重度退化 图2 喀斯特不同退化程度群落凋落物C、N、P 含量及化学计量比Fig.2 Litter C、N、P contents and stoichiometric ratio in vegetation communities along degradation in karst area 随着退化程度的加剧,凋落物C含量呈先降低后升高再降低的趋势,N、P含量表现为先升高后降低的趋势(图2)。中度退化群落凋落物C含量显著高于未退化、潜在退化及重度退化群落,且未退化、潜在退化及重度退化群落凋落物C含量并无显著差异,但均显著高于轻度退化群落。未退化、潜在退化和轻度退化群落凋落物N含量无显著差异,且均显著高于中度和重度退化群落凋落物N含量,且后两者之间并无显著差异。潜在退化群落凋落物P含量显著高于无退化、中度退化和重度退化群落,而轻度退化群落则与其他群落均无显著性差异。随退化程度加剧,凋落物C∶N和C∶P呈先降低后升高的趋势,中度退化和重度退化程度群落凋落物C∶N和C∶P并无显著差异,均显著高于未退化、潜在退化和轻度退化群落,且后三者间亦无显著差异。随退化程度加剧,凋落物N∶P呈下降趋势,未退化群落仅略高于潜退化和轻度退化群落,但显著高于中度和重度退化群落,且潜退化和轻度退化群落及中度和重度退化群落间并无显著差异。 随退化程度的加剧,土壤C、N、P 含量均呈先升高后降低的趋势(图3)。潜在退化群落的土壤C含量显著高于中度和重度退化群落,与未退化和轻度退化群落无显著差异,且后四者差异不显著。潜在退化群落土壤N、P含量显著高于重度退化群落,且后者与其他三个群落之间N、P含量并无显著差异。随退化程度加剧,土壤C∶N、C∶P均呈先降低后升高变化趋势;未退化和重度退化群落土壤C∶N差异不显著,但均显著高于其他三种退化程度群落,且后三者间亦无显著差异;重度退化群落土壤C∶P显著高于未退化群落,而未退化群落土壤C∶P亦显著高于潜在退化、轻度退化和中度退化群落,但后三者间土壤C∶P无显著差异。随退化程度加剧,土壤N∶P总体呈升高变化趋势,但不同退化程度群落之间土壤N∶P并无显著差异。 图3 喀斯特不同退化程度群落土壤C、N、P 含量及化学计量比Fig.3 Soil C、N、P contents and stoichiometric ratio in vegetation communities along degradation in karst area 由图4分析可知,随退化程度加剧,土壤微生物量C呈降低变化趋势,而微生物量N、P则呈先升高而后降低变化趋势。未退化群落土壤微生物量C显著高于潜在退化和轻度退化群落、中度退化和重度退化群落,且前二者微生物量C亦显著高于后二者,但前二者间及后二者间差异均不显著。潜在退化群落土壤微生物量N、P与未退化和轻度退化群落差异均不显著,但均显著高于中度和重度退化群落,而后二者微生物量N差异不显著,微生物量P差异显著。随退化程度加剧,土壤微生物量C∶N总体呈降低变化趋势,土壤微生物量C∶P和N∶P则呈先降低后升高变化趋势。不同退化程度群落土壤微生物量C∶N无显著性差异;重度退化群落土壤微生物量C∶P与未退化群落无显著差异,但显著高于其他三种群落,且后四者之间土壤微生物量C∶P差异并不显著;重度退化群落土壤微生物量N∶P显著高于其他群落,其他四种群落之间则差异不显著。 图4 喀斯特不同退化程度群落土壤微生物生物量C、N、P 含量及化学计量比Fig.4 Soil microbial biomass C、N、P contents and stoichiometric ratio in vegetation communities along degradation in karst area 如图5所示,植物叶片C与凋落物N、微生物量N呈极显著正相关,与凋落物C∶N呈极显著负相关,与微生物量C显著正相关;植物叶片N与土壤N、微生物量N呈显著正相关,与土壤C∶P、N∶P呈显著负相关;植物叶片P与凋落物C、土壤N、微生物量C呈显著正相关,与土壤P、微生物量C∶N呈极显著正相关,与土壤C∶P、N∶P呈极显著负相关;植物叶片C∶N与土壤C、N、微生物量C呈显著负相关;植物叶片C∶P与凋落物C、土壤N、P、微生物量C∶N呈显著或极显著负相关,与土壤C∶N、C∶P、N∶P呈显著或极显著正相关;植物叶片N∶P与凋落物N、N∶P呈显著正相关,与土壤P呈显著负相关。土壤C与凋落物N、N∶P、微生物量C、N呈显著或极显著正相关;土壤N与凋落物N∶P、微生物量P呈显著正相关。凋落物N与微生物量C、N呈极显著正相关;凋落物P与微生物量C、凋落物N∶P与微生物量N显著相关;凋落物C∶N与微生物C、N呈显著或极显著负相关。 图5 群落退化过程中植物叶片、凋落物、土壤、微生物量C、N、P含量与化学计量比的关系Fig.5 Relationships of leaf, litter, soil and microbial biomass C, N, P contents and stoichiometry during the degradation process 喀斯特植被退化过程中,随着土壤N、P含量及N∶P的变化,叶片N、P含量及N∶P利用稳态性模型模拟结果均显著(P<0.1),呈不同的内稳性特征(图6)。在土壤N、P含量变化下,植物叶片N元素的内稳性指数H分别为2.72和2.75,平均值为2.73,属于弱稳态型;植物叶片P元素的内稳性指数H则分别为2.39和2.23,平均值为2.31,属于弱稳态型。植物叶片N∶P内稳态指数H为5.14,属于稳态型。综合分析表明,植物叶片N元素的内稳性略高于P元素,但明显低于N∶P,也即,相对于N、P元素内稳定性,元素计量比N∶P具有更高的内稳性。 图6 土壤N、P含量、N∶P 与植物叶片N、P含量、N∶P的关系Fig.6 Relationship between soil N, P contents and leaf N and P contents 叶片是植物对环境变化做出反应的最敏感的指示部位[23]。植物叶片C 含量越高表明其比叶重越大,具有较强的防御能力,叶片N、P 含量越高,表明其资源竞争能力越强[24—25]。随群落退化程度的加剧,植物叶片的C、N、P含量呈下降趋势,表明喀斯特植被群落退化过程中,植物叶片养分含量降低,对环境变化的防御能力和资源竞争能力下降。叶片N、P含量与土壤N、P含量之间存在显著和极显著正相关关系,而与土壤C∶P、N∶P则呈显著和极显著负相关关系,表明植物的营养元素主要来源于土壤,其含量和土壤中含量密切相关[26];土壤C∶P、N∶P越高,表明土壤可利用性N、P含量越低[27],进而影响其叶片含量。 叶片是植物的主要光合器官,因此叶片的化学计量比能代表植物整株的状况[28]。叶片C∶N、C∶P比代表着植物吸收N、P元素时所能同化C的能力及固C效率的高低,可反映植物的生长速率和养分利用率,较高的C∶N、C∶P 对应较低的生长速率和较高的养分利用率[29—30],一定程度上也反映了土壤中N和P的供应状况[26]。植物在营养元素供应缺乏的情况下往往具有较高的养分利用效率,反之,营养元素供应充足, 元素利用效率则较低[31]。重度退化群落植物叶片C∶N、C∶P显著高于其他群落,表明当群落发生重度退化后,植物同化C的能力和固C速率显著性下降,植物的生长速率也显著降低,因而养分利用效率提高,可能原因是一方面群落退化后养分归还量减少,另一方面植被减少引起水土流失而导致养分流失,最终引起土壤养分供应不足。植物叶片的N∶:P临界值被认为可以作为判断环境对植物生长的养分供应状况的指标[4],当植物N∶ P<14 时,植物生长表现为受N限制;当N∶ P >16 时,表现为受P 限制;当14 凋落物是群落中联结土壤和植物的重要组成部分,其养分含量受群落优势植物及凋落物组成的影响[34]。本研究中,随退化程度的加剧,凋落物C含量呈先降低后升高再降低的趋势,N、P含量则表现为先增后减的变化趋势,这可能与不同退化程度群落中优势种组成不同有关。有关研究表明,当凋落物N<7 g/kg,P<0.5 g/kg时,凋落物N、P养分被叶片完全吸收;而N>10 g/kg、P>0.8 g/kg/时,则表明没有完全吸收[35—36]。本研究中,中度、重度退化群落凋落物N含量(4.64 g/kg、4.13 g/kg)低于7 g/kg,P含量(0.40 g/kg、0.41g/kg)均低于0.5 g/kg,表明植被群落退化达中度以上,会发生凋落物N、P的完全吸收,这说明群落退化后植物通过提高养分重吸收效率来适应土壤环境的变化。然而,退化群落凋落物N、P含量低的重要的原因可能是秉承了植物的特性[26],即植物的养分含量降低。凋落物N含量与叶片N∶P显著正相关,说明植物叶片N∶P越高时,植物生长N供应充足,凋落物N含量越高。 凋落物C∶N是预测凋落物分解速率最理想的指标[37],较低的C∶N对应较高的凋落物分解速率[38—39]。本研究中,随着退化程度的加剧,凋落物C∶N总体上呈增加趋势,说明喀斯特地区植被群落退化过程中,凋落物的分解速率降低,养分回归量减少。有研究表明,凋落物N∶P越高,凋落物的分解受到P素的限制越强,尤其是当凋落物的N∶P大于25或其P含量低于0.22 g/kg时[40]。本研究中,不同退化程度植被群落凋落物N∶P均小于25,且随退化程度加剧而下降,说明喀斯特区植被群落凋落物分解受P的限制小,并在群落退化过程中逐渐减小。凋落物N∶P与叶片N∶P之间显著正相关,可见凋落物分解与植物生长的养分限制类型有关。 植被退化过程中,随植物群落物种组成的改变,土壤的养分特征也发生变化[41]。土壤C、N与凋落物N、N∶P存在极显著或显著正相关关系,可能原因是凋落物N、N∶P能够影响其分解速率[38],从而影响土壤C、N含量,进一步说明土壤中N含量与凋落物密切相关,而P含量则与土壤中P含量相关性不显著,可能原因是两者的来源不同,土壤N主要来源于凋落物归还,而土壤中的P不仅来自于凋落物的输入,还与土壤成土母质中的矿物成分密切相关[42]。土壤C与微生物量C、N和土壤N与微生物量P存在极显著或显著正相关关系,说明微生物量C、N是土壤C、N动态的敏感指示者[43]。 土壤的 C∶N 可以衡量其 C、N 的营养平衡状况,并能影响其C、N 养分循环,是反映土壤质量的敏感指标[34,44],一般而言,土壤较低C∶N 表现为高肥力和较快的C、N矿化速率[45]。本研究中,中度退化群落土壤 C∶N 最低,但并不意味着其土壤肥力高,C、N、P不平衡性增加或降低也会引起土壤C∶N、C∶P、N∶P的变化[46],随着植被退化,土壤C含量的降幅高于N含量的降幅,从而C∶N 减小;而当植被退化到一定程度,达到重度退化,土壤中的N元素显著下降,因此重度退化群落土壤C∶N显著升高。较低的C∶P比是磷有效性高的一个指标[27]。随着退化程度的加剧,土壤C∶P不断升高,重度退化程度最高,说明重度退化群落P有效性显著降低。土壤N∶P可以作为养分限制类型的有效预测指标[27],不同退化程度群落土壤N∶P 之间差异不显著,说明植被群落发生退化,植被群落的养分限制格局没有改变。 土壤微生物是有机质的分解者,微生物量的任何变化,都会影响土壤养分的循环和有效性,能够及时反映土壤的质量状况[47]。本研究中,土壤微生物量随群落退化而变化的结果表明,植被群落退化后,群落稳定性下降,水热条件、相对湿度和温度等波动较大,尤其是重度退化群落,植被层次极不完整、生物多样性低,群落输入的有机质较少,因而土壤微生物生物量最低[48]。微生物C、N是衡量土壤微生物活性的重要指标,其数值的高低直接说明土壤肥力的好坏[34]。微生物量C、N与凋落物N含量呈极显著正相关,与凋落物C∶N则显著或极显著负相关,这是因为凋落物C∶N通常用来表示凋落物的质量,其对微生物分解和矿化作用有较大的影响,凋落物N含量高时对应较低的C∶N,其矿化和腐化都较易进行,分解快[25],微生物活性高。 土壤微生物量C∶N比值是否恒定,不同学者的观点各异。王绍强等[27]认为土壤微生物生物量的C∶N比约为10∶1,本研究中喀斯特地区不同退化程度群落土壤微生物生物量C∶N分布在8.27—11.01之间,平均值为9.32,与之接近。不同退化程度群落土壤微生物量C∶N 差异不显著,说明土壤微生物具有较高的内稳性。土壤微生物量C∶P 可作为衡量微生物矿化土壤有机质释放P或从土壤中吸收固持P 潜力的重要指标,比值一般在7—30之间[49]。本研究中重度退化群落土壤微生物量C∶P(19.32)较高,表明微生物与植物竞争土壤有效磷,出现固磷现象;其他群落土壤微生物量C∶P偏低,说明微生物在矿化土壤有机质中释放P 的潜力较大。 土壤养分含量的变化可以直接影响植物养分的吸收及其化学计量比,而植物则通生态化学计量及养分利用策略调节来适应土壤N、P含量的变化[50-51]。内稳态理论认为生命有机体能够维持自身体内化学元素组成不随外部环境的变化而发生剧烈改变,而是将其体内化学元素组成保持在相对狭窄的范围内[52]。内稳态特征是生态化学计量学研究的基础,内稳性的强弱反映了生物在长期进化过程中对环境变化的生理和生化调节的适应程度[53]。本研究中植物叶片N、P元素均为弱稳态型,N∶P则为稳态型,表现为HN∶P>HN>HP,表明喀斯特地区植物具有一定的内稳性,可以通过调节自身养分元素的平衡,使元素比值处于相对稳定的状态。同时在一定程度上证实了限制性养分元素稳定性假说:由于生理和养分平衡的制约,限制性养分元素在植物体内的含量具有相对稳定性, 对环境变化的响应也较为稳定[1],这表明随着喀斯特地区植被群落退化,在N养分限制的环境中,植物叶片N具有较强的内稳性。 桂西北喀斯特地区植被群落退化过程中,植物叶片、凋落物、土壤、微生物量C、N、P含量及其化学计量比发生明显变化,植物对环境变化的防御能力和资源竞争能力下降;植物的生长速率显著降低,而养分利用效率提高;植物生长主要受N限制,且退化越严重,N限制作用越明显;凋落物C∶N总体上呈增加趋势,说明喀斯特地区植被群落退化过程中,凋落物的分解速率降低,养分回归量减少;重度退化群落土壤P有效性显著降低;植被群落发生退化,植被群落的养分限制格局没有改变;重度退化群落土壤微生物量C∶P偏高,表明微生物与植物竞争土壤有效磷,出现固磷现象,而其他群落土壤微生物在矿化土壤有机质中释放P 的潜力较大。叶片N、P元素均为弱稳态型,N∶P则为稳态型,表明喀斯特地区植物具有一定的内稳性,可以通过控制自身养分元素的平衡,使其元素组成比值保持相对稳定的状态。研究结果对深入理解喀斯特植被退化过程中,生态系统各组分(植物叶片、凋落物、土壤、微生物)养分状况和养分循环具有重要意义。但本研究未考虑不同退化程度植物群落化学计量特征种间差异与种内特征及其指示作用,因此进一步对不同退化群落中相同植物种类间化学计量特征的差异进行研究具有重要意义。2 结果与分析
2.1 植物叶片C、N、P 含量及化学计量比
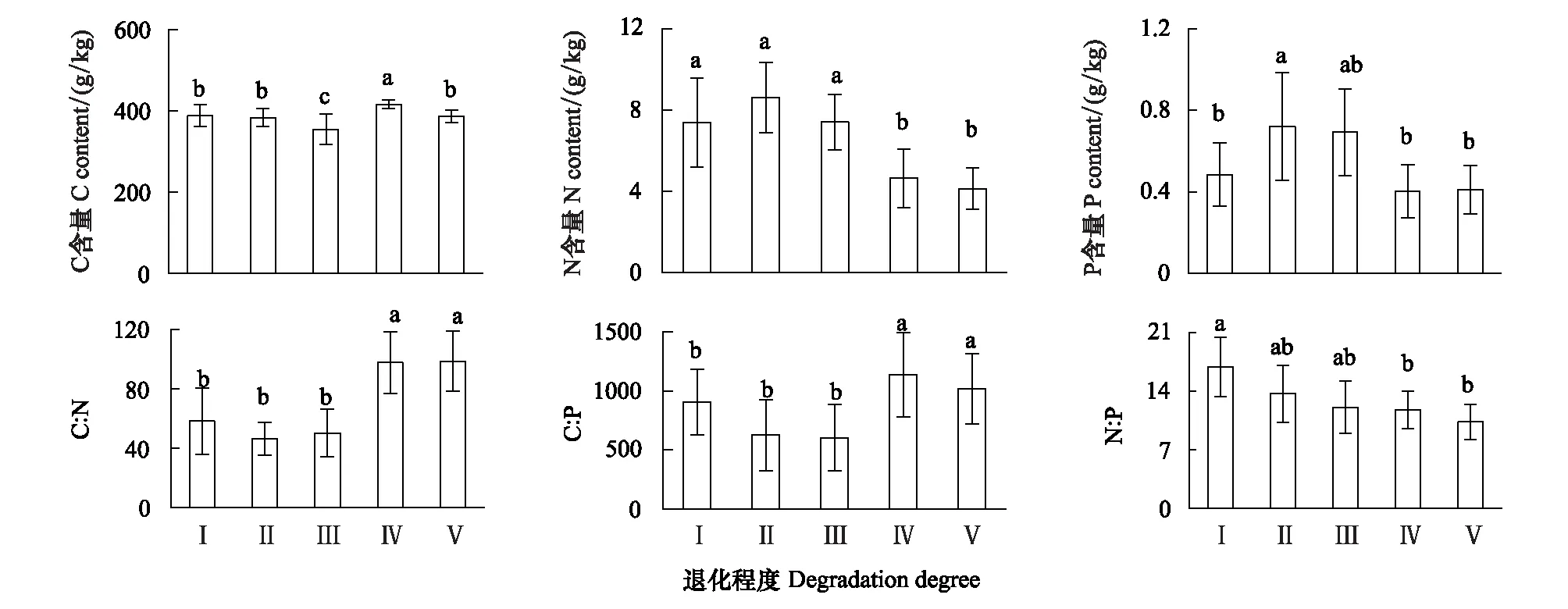
2.2 凋落物C、N、P 含量及化学计量比
2.3 土壤C、N、P 含量及化学计量比
2.4 土壤微生物量C、N、P 含量
2.5 植物-凋落物-土壤-微生物C、N、P及化学计量比的相关性

2.6 叶片N、P含量及N∶P比随土壤养分变化的内稳态分析
3 讨论
3.1 不同退化程度群落植物叶片C、N、P 含量及化学计量特征
3.2 不同退化程度群落凋落物C、N、P 含量及化学计量特征
3.3 不同退化程度群落土壤C、N、P 含量及化学计量特征
3.4 不同退化程度群落土壤微生物生物量C、N、P 含量及化学计量特征
3.5 植物叶片N、P含量及N∶P内稳性特征
4 结论
————水溶蚀岩石的奇观

