黄土丘陵区不同植被类型土壤细菌群落多样性特征
张 健,徐 明
(贵州大学生命科学学院/真菌资源研究所,贵州 贵阳 550025)
植被类型的变化不仅改变着土地的景观面貌,也改变了土壤生态系统的物质循环与能量流动,同时对土壤微生物的结构和功能产生深刻的影响[1-4]。长期以来,植被恢复被作为黄土丘陵区生态环境改善的首要任务,在该区域已开展了大量植被建设的探索与实践[5-6];但各种植被措施带来的生态环境影响需要经历一段时间后才能被认识清楚。土壤微生物对环境的变化非常敏感,不同植被类型在优势种、改善微环境、物质代谢和干扰历史等方面的差异可显著影响土壤微生物群落的演变[1-4]。由于黄土丘陵区地形复杂、生态系统多样等原因,不同植被类型下土壤微生物群落特征尚不十分清楚[3-4]。因此,亟待加强不同植被类型对区域生态环境影响的综合效益评价,特别是地下生态系统方面的研究工作[7]。揭示干旱和半干旱区典型植被类型与土壤微生物间的生态关系,将有助于提高对区域植被建设以及生态管理与实践的科学决策水平。
土壤微生物群落多样性是响应陆地生态系统变化方面的敏感性指标,在指示生态环境变化方面具有重要的生态学意义[7-9]。已有研究指出,土壤微生物多样性丧失和土壤微生物群落组成简单化可以损害多重生态服务功能,包括植物多样性、凋落物降解、养分利用和养分循环,进而威胁生态系统的可持续性[7,10]。因此,在我国大力开展植被建设、植被覆盖种类复杂化的背景下,研究不同植被类型下土壤微生物群落的组成和多样性显得尤为重要。
作为我国生态环境恢复的重点区域,黄土高原已经开展了内容丰富的生态恢复治理探索与实践工作,特别是随着退耕还林还草工程的大力实施,植被格局发生着显著而剧烈的变化[11]。有研究表明,土地利用类型可解释97%的土壤质量指数的变异性,不同植被措施对生态系统的植被组成与结构、生物量、凋落物、土壤水分、土壤养分、土壤微生物等影响显著[6,12-14]。尽管已有大量关于黄土高原不同植被类型与土壤微生物群落(酶活性、生物量、多样性)关系的研究报道[15-18],但综合考虑多种人工植被和天然植被的土壤微生物群落结构和功能等方面的研究却鲜见报道。因此,通过对典型人工植被类型和自然植被类型土壤微生物群落结构和功能特征进行研究,可以为提高黄土高原植被类型对土壤微生物群落影响的认识提供一定的理论依据。
1 研究区域与研究方法
1.1 研究区域
安塞县(北纬36°31′~37°20′,东经108°52′~109°26′)位于陕西省北部黄土高原中部,面积2 951 km2,属典型半干旱大陆气候区,年平均气温达8.6 ℃,多年平均降雨量500 mm,降雨量变异显著(约74%的降雨集中在6—9月)。地貌属典型的黄土丘陵沟壑区景观。海拔变化范围为997~1 731 m,主要土壤为黄土母质发育的钙质始成土(黄绵土),呈黄色,没有层理,粉质质地,疏松、空隙大,湿陷性大;在整个土壤深度内碳酸钙含量较高(9%~14%)。河漫滩土壤质地较粗,土壤肥力较高且碳酸钙含量较低。地带性植被为森林-灌木-草原,但由于长期的人类活动,天然植被已损失殆尽。目前的植被包括一些稀疏的次生林、人工植被和自然草地,涉及刺槐(Robiniapseudoacacia)、侧柏(Platycladusorientalis)、沙棘(Hippophaerhamnoides)和柠条(Caraganakorshinskii)等植物种。
1.2 样地设置与样品采集
2015年5月中下旬,通过在安塞县范围内进行大量野外调查,并充分考虑立地条件(坡向和坡度)的基础上,共选取10种不同的典型植被类型设置调查样地(表1),选取的植被类型主要包括自然和人工2类,各5种。其中自然生态系统下的5种植被类型表征了该区域植被自然演替过程的一些主要阶段:植被自然恢复3 a的退耕地(Af)→自然恢复草地为铁杆蒿草地(Ag)→自然恢复灌丛为杠柳灌丛(Ps)和狼牙刺灌丛(Sv)→自然森林为侧柏林(Po);人工植被类型也涵盖了植物的3种生活型:乔木为人工刺槐林和苹果园(Og)、灌丛为人工柠条灌丛(Ck)、草本为坡耕糜子地(Fl)和淤地坝玉米地(Cd)。调查记录样地的立地信息、植被群落状况和土地管理措施等相关信息。每个样地内分别设置2~3个5 m×5 m样方重复,样方间隔10 m以上;每个样方内利用土钻,按“S”型路线,采集6点0~20 cm土层混合样品,形成1个代表土壤样品。样品分为3份,分别用于DNA提取(冷冻干燥土样,-80 ℃条件下保存)、理化指标分析(风干磨碎后过筛,室温保存)和土壤微生物量分析(新鲜土样4 ℃条件下保存)。

表1 样地基本信息
1.3 样品分析
样地土壤温度应用红外线测温仪THI-440NH(日本TASCO温度计)测定[13];土壤水分采用烘干法测定;土壤的pH值(水土质量比为2.5)和EC值(水土质量比为5)为电极法测定、土壤颗粒组成通过激光粒度分析仪(Malvern,英国)测定;土壤C、N、S含量采用元素分析仪(Elementar,德国)测定;土壤铵态氮和硝态氮含量通过连续流动分析仪(SEAL,德国)测定;有机质含量采用低温外热重铬酸钾氧化比色法测定;微生物量碳氮通过氯仿熏蒸0.5 mol·L-1K2SO4提取,采用总有机碳分析仪(TOC-VCPH,Shimazu,Japan)测定。
采用MoBio PowerSoil® DNA Isolation Kit(San Diego,美国)试剂盒对土壤样品进行总DNA提取;选用原核微生物通用引物Pro341F:5′-CCTACGGGNBGCASCAG-3′和Pro805R:5′-GACTACHVGGGTATCTAATCC-3′ 16S rRNA基因的V3-V4片段进行PCR扩增;纯化后的PCR产物应用Illumina MiSeq PE 300建库测序。高通量测序在上海美吉生物医药科技有限公司完成。
1.4 数据分析
高通量测序数据分析在美吉生物I-Sanger云平台在线实现(https:∥cloud.majorbio.com/),原始DNA测序数据在Usearch平台(7.0版)上处理,采用RDP classifier贝叶斯算法对97%相似水平的操作分类单元(OTU)代表序列进行分类学分析;细菌16S rRNA基因比对Silva (version 132)数据库。在OTU水平上分析不同植被类型对土壤细菌群落α多样性的影响。基于tax_summary_a数据表,利用R语言绘制不同植被类型土壤细菌门纲目科水平的柱状图,R语言vegan包实现样本/环境因子与物种相似性聚类,并将结果呈现在群落heatmap图上。采用PICRUSt2进行土壤微生物群落的同源蛋白簇(COG)功能组成预测。采用PerMANOVA检验不同植被类型间土壤微生物群落组成差异显著性。采用非主坐标轴(PCoA)分析不同植被类型土壤细菌群落的β多样性。土壤细菌群落OTU水平基于加权标准化unifrac距离算法,环境因子基于欧氏距离(Euclidean distances)算法,采用Meantal test分析不同植被类型土壤微生物群落与环境因子间的相关关系,进一步采用冗余分析(RDA)确定不同环境因子的影响权重。土壤细菌群落α多样性和土壤环境因子运用SPSS 22.5软件进行One-way ANOVA统计。应用Sigma Plot 12.5和Adobe Illustrator(AI)软件进行绘图。
2 结果与分析
2.1 土壤理化性质
不同植被类型样地间土壤理化性质存在显著差异(表2),表现为全碳(C)、全氮(N)含量和电导率(EC)存在极显著差异(P<0.01),土壤有机碳(SOC)含量和碳氮比(C/N)存在显著差异(P<0.05),而其他土壤理化指标则差异不显著,这可能与植物的生物学特性及土地管理程度密切相关。

表2 不同植被类型土壤理化因子的描述统计
2.2 土壤细菌群落多样性
对不同植被类型土壤细菌群落α多样性指数进行比较(表3),天然植被类型土壤细菌群落α多样性指数略大于人工植被类型,但仅有基于丰度的覆盖率估计指数(ACE)在不同植被类型土壤细菌群落间存在显著差异(P<0.05)。其中,人工植被类型的物种丰富度总体呈现出刺槐林(Rp)>坡耕地(Fl)>柠条灌丛(Ck)>淤地坝农田(Cd)>果园(Og);天然植被类型的物种丰富度总体呈现出狼牙刺灌丛(Sd) >杠柳灌丛(Ps)>退耕地(Af)>侧柏林(Po)>铁杆蒿草地(Ag)。

表3 不同植被类型土壤细菌群落的α多样性统计
2.3 土壤细菌群落组成和结构
土壤细菌16S rRNA基因高通量测序共得到1 821 681 条有效序列。单个样品得到70 774~120 700 条有效序列,单个样品的平均序列长度为453~469 bp,以97%相似水平鉴定共得到8 201个OTUs。
不同植被类型土壤细菌群落在各分类水平上均存在明显差异。在门水平上共注释得到31个门,其中变形菌门(Proteobacteria)和放线菌门(Actinobacteria)分别占总丰度的28.87%和28.68%,为优势类群(图1)。在纲水平上共注释得到78个纲,放线菌纲(Actinobacteria,28.68%)和α-变形菌纲(Alphaproteobacteria,17.51%)为纲水平优势类群。在科水平上共注释得到349个科,芽单胞菌科(Gemmatimonadaceae,6.69%)、未分类Subgroup 6(6.10%)和鞘脂单胞菌科(Sphingomonadaceae,4.33%)等为优势科;在属水平上共注释得到676个属,酸杆菌门中未分类Subgroup_6(6.10%)、未分类芽单胞菌科(norank Gemmatimonadaceae,5.39%)和酸杆菌门中RB41(3.25%)等为优势属(图1)。
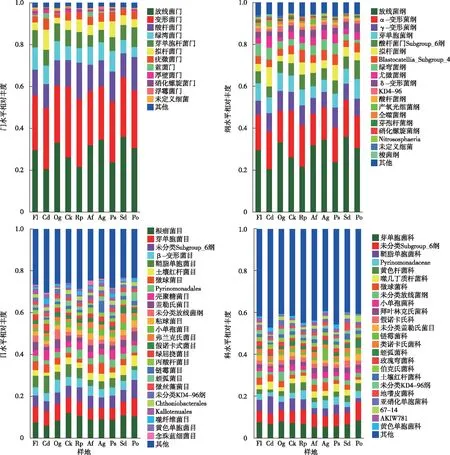
各样地含义参见表1。
进一步对不同植被类型间土壤细菌群落组成结构差异进行PerMANOVA检验(表4)。结果表明,天然植被与人工植被间土壤细菌群落组成差异存在显著差异(P<0.05);5种人工植被类型间土壤细菌群落组成差异达极显著水平(P<0.001);5种天然植物类型间土壤细菌群落组成差异也存在显著性差异(P<0.05)。研究表明,植被类型是土壤细菌群落组成结构分异的一个重要驱动因素,不同人工植被类型土壤微生物群落组成结构分异更为明显。
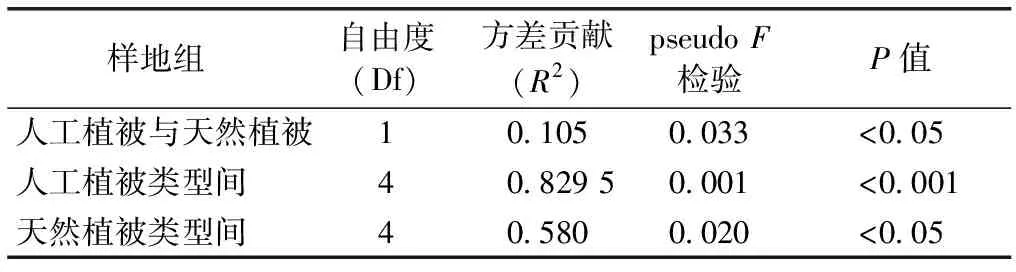
表4 不同植被类型土壤细菌群落组成差异PerMANOVA检验
基于土壤微生物群落属水平的样地聚类(图2)结果表明,刺槐林、杠柳灌丛、柠条灌丛合并成1个分支;退耕地和铁杆蒿群落在同一分支,两者之后与狼牙刺群落聚合;坡耕地和果园在同一分支;距离更远的分支依次是淤地坝农田、侧柏林。这种聚类结果反映出不同植被群落土壤细菌群落特征与样地的植物生物学特性、所处植被演替阶段和人为管理方式等方面有密切关联。
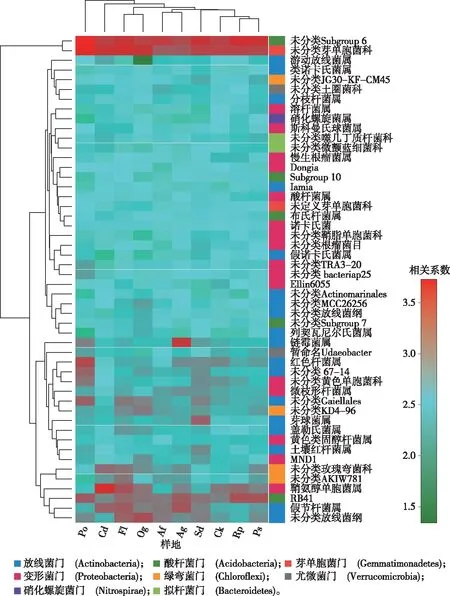
图中左侧为属水平聚类树,上侧为样地聚类树,通过色块颜色梯度来展示样本中不同物种丰富度的变化情况,右侧为以不同颜色标记各目的归属门类。各样地含义见表1。
2.4 土壤细菌群落功能分类
运用PICRUSt2对土壤细菌群落COG功能预测(图3)。结果表明,不同植被类型间的土壤细菌群落COG功能基因丰度存在不同程度的变异,其中,氨基酸转运和代谢(10.22%~10.57%)、核糖体的结构和生物发生(7.16%~7.40%)、能源生产和转换(7.21%~7.58%)、细胞壁/膜/包膜生物发生(6.40%~6.78%)、碳水化合物运输与代谢(5.71%~6.06%)、无机离子运输与代谢(5.75%~5.95%)以及未知功能(17.51%~18.15%)是相对丰度较高的功能类群(图3)。不同植被类型土壤细菌群落的COG功能组成结构的聚类情况与土壤细菌群落基于属水平的聚类情况(图2)存在明显的相似性。
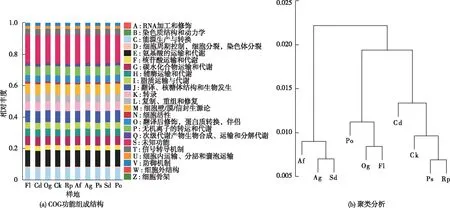
各样地含义参见表1。
2.5 土壤细菌群落与环境因子关系
采用Mantel test分析对土壤细菌群落组成和功能与环境因子间的相关性进行检验(表5),结果表明,环境因子与土壤细菌群落间存在极显著相关关系(P<0.01),这表明环境因子与土壤细菌群落间存在密切关联。土壤细菌群落组成与功能基因、功能基因与环境因子间的相关关系则均未达显著水平,这可能是由于土壤细菌群落功能基因往往存在一定程度的“功能冗余”。
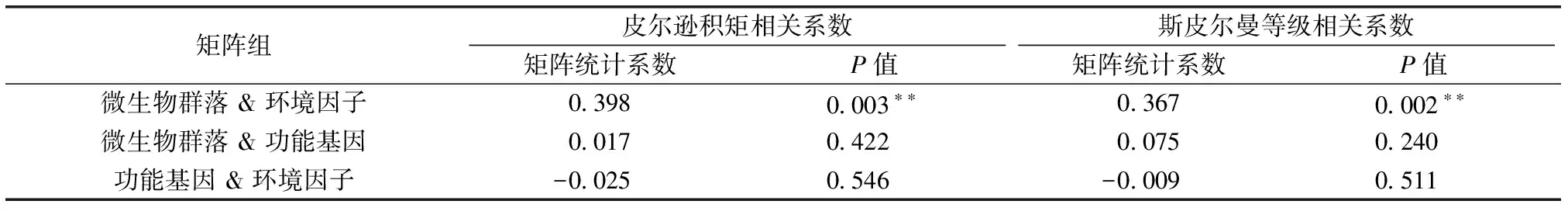
表5 土壤细菌群落组成和功能与环境因子间相关性检验
采用非主坐标轴(PCoA)分析了不同植被类型土壤细菌群落的β多样性特征(图4),结果表明,不同植被类型土壤细菌群落间存在明显差异。为了进一步分析影响土壤细菌群落组成分布的环境因子,通过因子排序的决策曲线分析法(DCA)来判别不同环境因子对土壤细菌群落分布的作用。结果表明,“梯度长度(Lengths of gradient)”=2.56(<3),因此,排序分析模型选择RDA分析。RDA分析结果显示,土壤细菌群落组成和结构与环境变量间的相互关系75.66%可以被RDA前2轴所解释,其中第1轴解释了18.33%的细菌群落变异信息,经置换检验满足极显著相关(P<0.01),第2轴解释了15.15%的变异信息,但无显著相关性(P>0.05)。经ANOVA.CCA(蒙特卡罗置换检验,迭代数为999)对每个变量的重要性检验可知,土壤细菌群落受到环境因子C含量(P<0.01)、N含量(P<0.01)、SOC含量(P<0.05)、电导率(EC)值(P<0.05)、pH值(P<0.05)、NO3含量(P<0.05)和SWC含量(P<0.05)的影响达到显著水平。
基于属水平与环境因子相关性,土壤环境因子聚类后形成2个分支,其中一个分支包括SMN含量、N含量、C含量、SMC含量、SOC含量、S含量、EC值、NH4含量和砂粒含量等土壤养分因素,另一个分支包括NO3含量、土壤水分含量、C/N比、pH值、黏粒含量、粉粒含量和土壤温度等土壤理化综合因素,这种聚类较为客观地反映了不同土壤理化指标在土壤环境中的协同作用关系。土壤细菌群落的优势属与环境因子间的显著作用关系一定程度上反映该微生物属类群产生影响的关键环境因子,对于进一步揭示土壤细菌群落不同类群在土壤中的主要生态功能提供了一定线索,如红色杆菌属(Rubrobacter)与SMN含量、TN含量、TC含量、SMC含量和EC值等环境因子间呈显著的正向相关关系,而与土壤温度呈极显著的负向相关关系;硝化螺菌属(Nitrospira)与NO3含量和水分含量表现出极显著的正向相关关系;放线菌门的莱氏杆菌属(Lechevalieria)与C/N比、pH值和温度等土壤环境因子呈极显著的正向相关关系,而与SMN含量、TN含量、TC含量、SMC含量和SOC含量等土壤环境因子则呈极显著的负向相关关系,这与已有Lechevalieria属具有耐干旱和高盐环境的报道一致。
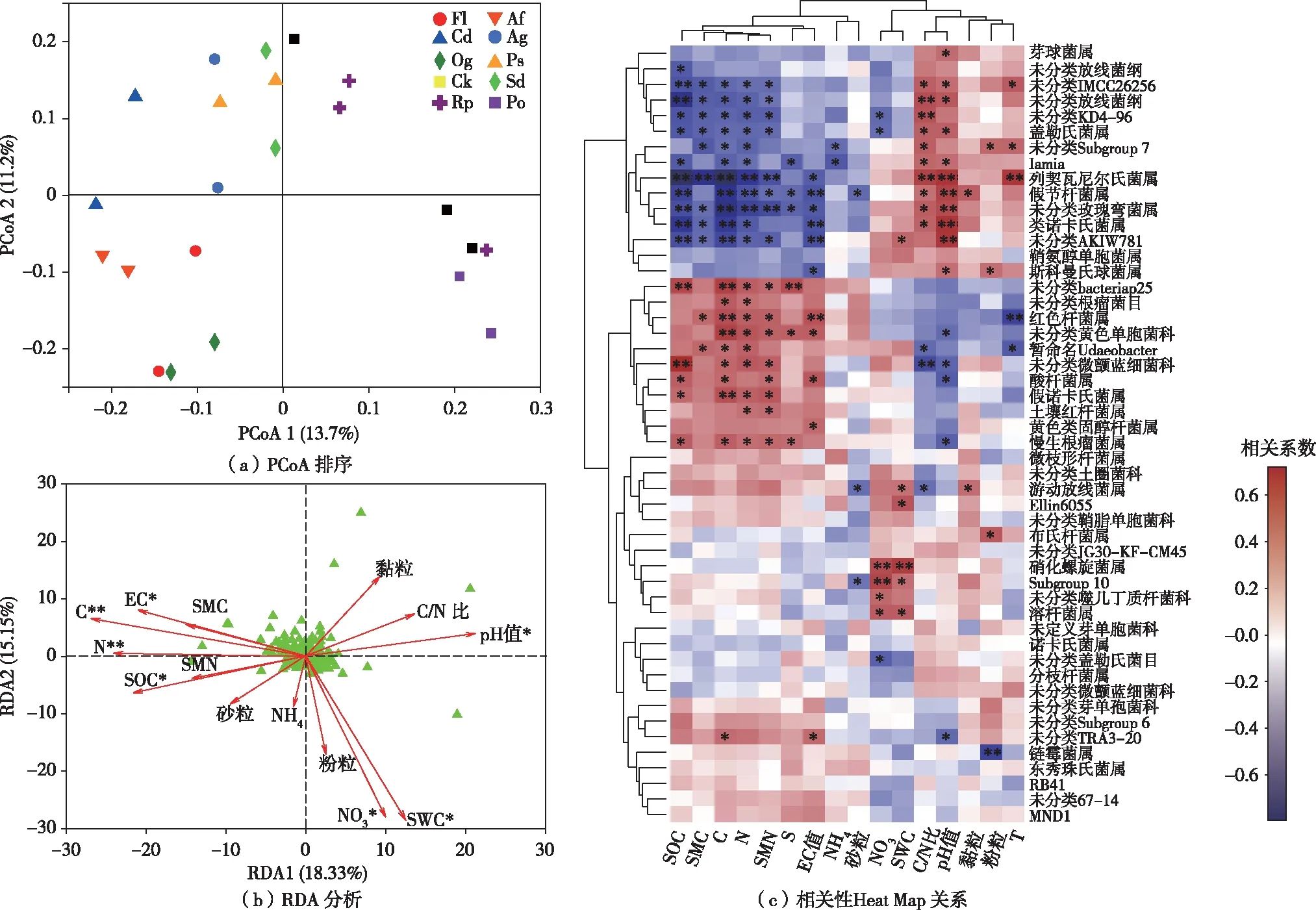
各样地含义参见表1。X轴和Y轴分别为环境因子和属水平,两者间的相关系数(r值)由不同颜色展示。图中左侧为属水平聚类树,上侧为环境因子聚类树。***表示P<0.001,**表示P<0.01,*表示P<0.05。
3 讨论
3.1 不同植被类型土壤细菌群落特征
以人工植被与自然植被各5种代表性类型为调查对象,其中坡耕地、淤地坝农田和果园是人为管理强度较大的农用地,土壤受到人为农田管理活动(翻耕、除草、施肥、打药等)干扰较为频繁,代表着强度的人为干扰植被类型;淤地坝农田的土壤来源与坡耕地和果园的区别较大,淤地坝农田土壤来源于坡面径流冲刷下来的泥沙沉积物,来源组成复杂,同时由于淤地坝位于沟道,水分条件较坡面好。因此,淤地坝农田生境下土壤细菌群落不同于坡耕地和果园土壤细菌群落,坡耕地和果园可能主要归因于人为干扰影响的土壤细菌群落,而淤地坝农田土壤微生物群落则体现出非生物环境因子影响的土壤细菌群落,且在该区域同等人为干扰(农事活动)的作用下,非生物环境因子(土壤性质、水分含量)可对土壤细菌群落有更加深刻的影响。柠条灌丛和刺槐林是黄土高原常见的人工水土保持植被类型,2种植被一般人工建植后就很少再有人工管理,后续主要经历近自然演替过程[11]。但由于研究区域半干旱半湿润的气候,赋加相对贫瘠的土壤养分和水分条件,植被自然演替需要经历较长时间。
退耕地属植被次生演替的早期,优势种草本植物主要为菊科植物茵陈蒿(A.capillaris);铁杆蒿群落是退耕地演替过程中一个相对稳定的草本植物群落阶段[5]。因此,2个群落同处在黄土丘陵区植被恢复演替的草本阶段,两者的土壤微生物类群相似性较高。杠柳和狼牙刺都属黄土丘陵区植被自然演替过程中常见的灌木树种,但对生境的选择存在一定差异,狼牙刺属豆科灌木,是黄土丘陵区土著种,常在干旱阳坡、半阳坡地区等干旱生境中形成灌木林[19];杆柳属萝摩科一种落叶蔓生灌木,具有较宽的生态位,是研究区植被恢复演替过程中出现早、持续时间长的木本植物[20]。同时,杠柳在黄土高原丘陵区刺槐林下也是常见次生自然灌木。因此,杠柳灌丛和刺槐林的土壤细菌群落更为相似,这也符合它们在自然环境中的分布情况。侧柏属柏科常绿乔木,具有喜光、耐干旱、耐瘠薄的生物学特性,是黄土丘陵区自然分布的乡土树种,代表研究区域经历长期自然恢复演替形成的一种顶级植被类型,其土壤细菌群落也不同于其他植被类型生境。
3.2 土壤微生物群落的结构与功能特征
变形菌门和放线菌门已作为土壤细菌细菌群落中的优势类群被广泛报道[2],特别是在干旱和半干旱生境优势度更大[21],如黄土高原地区[14,22],这可能与这两大类群物种丰富度、功能多样性以及胁迫环境适应能力强等方面密切相关[23]。根瘤菌目为相对丰度最高的目水平类群,根瘤菌新的分类系统体系中包含了传统的“互接种族”和现代的“系统发育关系”鉴定类群,新根瘤菌的多样性不断得以丰富,目前根瘤菌目下不仅包含与豆科等宿主植物形成根瘤类群,也包含了土壤传播的根瘤菌[24];而且这与研究选取植被类型样地中植物优势种多为豆科植物,伴生种中豆科植物也分布极为普遍有关[25]。相对于革兰氏阴性(G-)细菌具有更薄、更易渗透的细胞壁结构,放线菌的许多成员则是革兰氏阳性(G+)单性细菌,通常具有厚厚的肽聚糖细胞壁特征[23],这是它们能够在多种胁迫环境存在的一种结构基础。放线菌门中物种组成极为丰富,它们具有不同生活方式,与各种高等生物的关联中扮演着各种角色[23];而且很多类群具有耐旱、盐碱、高温、辐射等环境胁迫因子能力[23];大部分菌属为世界广布种,如假诺卡氏菌属、红色杆菌属、链霉菌属、芽生球菌属、土壤红杆菌属、游动放线菌属、分枝杆菌属等,寻找新的放线菌物种可能会导致发现潜在的新的结构和有益的次生代谢产物而受到广泛关注[26]。可见,针对该研究区域内放线菌资源,有必要加强进一步深入研究。
土壤微生物群落功能多样性是反映土壤微生物群落状态与功能的指标,指示不同生态环境下土壤微生物群落的生态特征,与土壤功能、植被发育、生态系统的可持续之间密切关联[27- 28]。不同植被类型土壤细菌群落的COG功能组成结构差异不明显,其中,未知功能和氨基酸转运和代谢是土壤细菌群落的优势功能类群,这与该区域土壤微生物群落代谢对氨基酸类利用的“偏好”特征报道相一致[14, 29],同时,大比例的未知功能基因类群的存在,表明有关该区域土壤微生物群落功能基因的描述有待深入研究。经土壤细菌群落组成与功能基因组成的相关性检验不存在显著性关联(表5)。因此,推测不同植被类型土壤细菌群落的COG功能可能存在一定程度“功能冗余”,这可能与黄土丘陵区相对残酷的自然胁迫环境和人为干扰环境有关。土壤细菌群落的“功能冗余”一方面可能是一种微生物群落维持机制(生态策略),这在应对外界环境变化与各种干扰过程中可起到重要缓冲作用[30];另一方面,微生物群落功能预测的研究技术方法仍存在局限性,如目前仍有大量细菌物种不能实现分离培养,它们的生物学特性与生态功能尚不十分清楚[30]。
3.3 土壤微生物与环境因子间的相互关系
不同植被类型不仅在调节生境小气候功能存在一定差异,而且通过植物源养分(凋落物、根系分泌物)的输入以及养分的分解、转化和积累等物质循环过程也存在不同,进而影响到土壤系统理化性质与微生物群落间协同演变过程[2-4]。该研究中土壤细菌群落不同相对丰度优势属类群与环境因子间存在显著的相关关系,且不同类群与不同环境因子间相互关系存在明显差异,这可能与土壤不同环境因子对微生物具有不同程度的影响作用,进而与微生物的生态位密切关联[1]。已有研究报道不同植被群落的土壤理化因子间存在着显著差异,包括土壤水分、温度、有机质含量、铵态氮含量和硝态氮含量等[6,13];大量研究表明土壤的非生物性质是土壤细菌和真菌的结构和组成的主要调节因子,如pH值和有机物含量[31]。黄土丘陵区属于高原干旱半干旱气候条件,水分、紫外线、盐碱性、高温等环境胁迫因子对表层土壤生态系统影响剧烈。由于黄土丘陵区水土流失问题曾经较为严重,土壤养分条件相对贫瘠,特别是土壤生态系统中生命宏量元素碳与氮的质量情况将对微生物群落产生重要影响。该研究中土壤有机碳含量、全碳含量、全氮含量、电导率、pH值、硝态氮含量和土壤水分含量是不同植被类型土壤细菌群落重要的影响因子,这与以往研究报道较为一致[14,18,32]。
4 结论
黄土丘陵区植被类型对土壤细菌群落组成结构和功能具有重要的影响,土壤微生物群落特征表现出其对植被类型的优势种生物学特性、植被演替、土壤性质和人为管理方式等方面的综合响应。因此,植被类型是影响黄土丘陵区土壤细菌群落结构和功能重要的驱动因素。
致谢:野外实验承蒙中国科学院安塞水土保持综合试验站的大力支持,在此表示诚挚的谢意!

